Щелочной элемент — Википедия

Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно гидроксида калия.
Впервые использовать щелочной электролит в химических источниках тока предложили независимо друг от друга Вальдемар Джангнер (англ.) в 1899 году и Томас Эдисон в 1901 году[1][2]. Они использовали щелочной электролит в никель-кадмиевых аккумуляторах.
В марганцево-цинковых элементах питания щелочной электролит впервые применил канадский инженер Льюис Урри (англ.)русск. в середине 1950-х годов, работавший в Union Carbide (англ.), выпускавшей элементы питания под маркой «Eveready». Льюис Урри использовал наработки Томаса Эдисона[3]. В 1960 году Урри вместе с Карлом Кордешем и Полом Маршалом получил патент на конструкцию щелочного элемента
Типичные характеристики щелочного элемента питания[5][6]:
- ЭДС элемента: 1,5 В;
- Удельная энергия: 65—90 Вт∙ч/кг;
- Удельная мощность: 100—150 кВт/м³;
- Рабочая температура: -30…+55 °С.
На аноде проходят реакции окисления цинка. Вначале образуется гидроксид цинка:
Zn + 2OH− → Zn(OH)2 + 2e−
Который затем разлагается на оксид цинка и воду.
Zn(OH)2 → ZnO + H2O
На катоде, в свою очередь, происходят реакции восстановления оксида марганца (IV) в оксид марганца (III):
2MnO2 + H2O + 2e− → Mn2O3 + 2OH−
В целом, химические процессы внутри элемента при использовании KOH в качестве электролита можно описать следующим уравнением:
Zn + 2KOH + 2MnO2 + 2e− → 2e− + ZnO + 2KOH + Mn2O 3
В отличие от солевого элемента, в щелочном электролит в процессе разрядки батареи практически не расходуется, а значит, достаточно малого его количества. Поэтому в щелочном элементе в среднем в 1,5 раза больше диоксида марганца.
 Основные части щелочного элемента
Основные части щелочного элементаПо конструкции щелочной элемент похож на солевой, но основные части в нём расположены в обратном порядке. Анодная паста (3) в виде цинкового порошка, пропитанного загущённым щелочным электролитом, располагается во внутренней части элемента и имеет отрицательный потенциал, который снимается латунным стержнем (2). От активной массы, диоксида марганца, смешанного с графитом или сажей (5), анодная паста отделена сепаратором (4), также пропитанным электролитом. Положительный вывод, в отличие от солевого элемента, выполнен в виде стального никелированного стакана (1), а отрицательный — в виде стальной тарелки (9). Оболочка (6) изолирована от стакана и предотвращает короткое замыкание, которое может возникнуть при установке нескольких элементов в батарейный отсек. Прокладка (8) воспринимает давление газов, образующихся при работе. Выделение газов в щелочном элементе значительно меньше, чем в солевом, поэтому объём камеры для их сбора тоже меньше. Для предотвращения взрыва батареи при неправильном использовании (например, коротком замыкании), в ней имеется предохранительная мембрана (7). При превышении давления газов происходит разрыв мембраны и разгерметизация элемента — результатом обычно становится течь электролита.
Для увеличения срока хранения в ранних конструкциях элементов производилось амальгамирование цинкового порошка, однако такой способ продления срока хранения элементов делает элементы опасными для использования в быту. Поэтому в современные элементы вводят специальные органические ингибиторы коррозии.
Срок хранения щелочного элемента больше, чем у солевого, за счёт герметичной конструкции, также он не столь требователен к условиям хранения.
В отличие от солевых элементов щелочные могут работать при большем разрядном токе. Кроме того, отсутствует эффект «усталости» элемента, когда после работы на большой нагрузке происходит значительное падение напряжения на выводах элемента, и для восстановления его работоспособности требуется определённое время «отдыха». Однако при коротком замыкании или установке в неверной полярности также возможна течь электролита.
Щелочной элемент имеет то же рабочее напряжение, что и обычный марганцево-цинковый при большей ёмкости, разрядном токе, сроке хранения и рабочем диапазоне температур. Щелочные элементы выпускаются в тех же типоразмерах, что и солевые, и потому могут применяться в тех же приборах, например, в фонарях, электронных игрушках, переносных магнитофонах и т.д. Однако за счёт лучших разрядных характеристик возможно применение их как в устройствах, потребляющих значительный ток (фотовспышки, радиоуправляемые модели), так и в устройствах, потребляющих относительно небольшой ток в течение длительного времени (электронные часы).
Сравнение солевых и щелочных элементов[править | править код]
Благодаря такой конструкции, у щелочного элемента есть следующие особенности:
- Отсутствие расхода электролита, а значит меньшее его количество, необходимое для работы
- Анодом является порошкообразный цинк, а не цинковый стакан, поэтому реакция идёт на значительно большей поверхности.
- Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным.
Отсюда можно выделить следующие преимущества и недостатки:
Преимущества[править | править код]
- Ёмкость — в 1,5–10 раз больше, чем у солевых элементов, в зависимости от режима работы, при том же типоразмере элемента
- Меньший саморазряд, длительный срок хранения
- Лучшая работа при низких температурах
- Лучшая работа при больших токах нагрузки
- Меньше падение напряжения по мере разряда
Недостатки[править | править код]
- Более высокая цена
- Большая масса
- Неприемлемы способы восстановления работоспособности, применимые для солевых элементов. Однако существуют особые конструкции щелочных элементов, допускающие определённое количество (обычно, до 25) перезарядок. Такие элементы называют «Rechargeable Alkaline Manganese» (RAM, перезаряжаемые щелочные марганцевые).
- Вересов Г.П. Электропитание бытовой радиоэлектронной аппаратуры. — М.: Радио и связь, 1983. — С. 85—95. — 128 с.
- В.В. Китаев, Бокуняев А.А. Колканов М.Ф. Электропитание устройств связи. — М.: Связь, 1975. — С. 225—235. — 328 с. — 24 000 экз.
- Костиков В.Г. Парфенов Е.М. Шахнов В.А. Источники электропитания электронных средств. Схемотехника и конструирование: Учебник для ВУЗов. — 2. — М.: Горячая линия — Телеком, 2001. — 344 с. — 3000 экз. — ISBN 5-93517-052-3.
Литиевый элемент питания — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 марта 2018; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 марта 2018; проверки требуют 7 правок. Литиевый (Li/FeS2) гальванический элемент формфактора АА, 1,5 В[1] Литиевые гальванические элементы формфактора CR123A, 3 В Миниатюрный литиевый гальванический элемент ДМЛ-120 (МЛ2325, аналог CR2325) Устройство миниатюрного литиевого элемента CR2032Литиевый элемент — одиночный неперезаряжаемый гальванический элемент, в котором в качестве анода используется литий или его соединения. Катод и электролит литиевого элемента может иметь много видов, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода. Отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение от 1,5 В (совместим с щелочными элементами) до 3,7 В. Литиевые элементы питания широко распространены в современной портативной электронной технике.
К достоинствам литиевых элементов можно отнести[2]:
- меньшую, чем у серебра и ртути, дефицитность;
- возможность выполнения особо плоских элементов (толщиной 1-1,5 мм), позволяющих производить особо плоские устройства, такие как наручные часы;
- возможность получения различных рабочих напряжений (1,5: 2,8; 3 и 3,5 В), что невозможно реализовать в других видах гальванических элементов;
- исключительно малые токи саморазряда и высокая степень герметичности, что позволяет хранить литиевые элементы до начала эксплуатации 5-7 лет без нарушения герметичности;
- возможность хранения и работы в широком диапазоне отрицательных и положительных температур.
В качестве катода в литиевом элементе могут использоваться:
и другие
Литиевые элементы нашли применение в устройствах, предъявляющих высокие требования к элементам питания на протяжении длительного срока службы, таким как электрокардиостимулятор и другие имплантируемые медицинские устройства. Такие устройства могут работать автономно до 15 лет. Применение литиевых элементов в устройствах с небольшим сроком службы не всегда оправдано. Так, литиевый элемент может прослужить дольше, чем детская игрушка, для которой он был приобретен. Диапазон применения литиевых элементов практически аналогичен применению щелочных элементов — это большое количество различных устройств, таких как часы или фотокамера.
Типоразмеры[править | править код]
Небольшие («таблеточные») литиевые элементы часто используются в портативных электронных устройствах с малым энергопотреблением (часы, калькуляторы), а также в компьютерах для питания энергозависимой памяти CMOS и часов.
ru.wikipedia.org
Миниатюрный элемент питания — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 мая 2015; проверки требуют 50 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 мая 2015; проверки требуют 50 правок. Миниатюрные элементы питания различного размераМиниатюрный элемент питания (кнопочный элемент питания) — гальванический элемент питания размером с пуговицу. Впервые широко начал применяться в электронных наручных часах, поэтому называется также
Об опасности миниатюрных элементов питания для детей – см. соответствующий раздел.
Миниатюрные гальванические элементы питания отличаются по высоте, диаметру, напряжению (В) и ёмкости (мА·ч), а также химическим составом.
У каждого элемента питания есть наименование, по которому можно определить вышеназванные параметры.
Напряжение[править | править код]
Разные производители используют разную маркировку, вследствие чего иногда бывает непросто найти замену отслужившему элементу питания. Ниже приводятся наиболее распространённые наименования.
Серебряно-цинковые[править | править код]
- LD — для электроприборов с низким и равномерным энергопотреблением.
- HD — для электроприборов с высоким и неравномерным энергопотреблением.
- MD — для любых режимов. (нет в таблице)
| диаметр, мм | высота, мм | тип | МЭК-код | Renata, Varta (V), Duracell (D) | Maxell, Panasonic, Sony, Toshiba | Seiko | Rayovac |
|---|---|---|---|---|---|---|---|
| 11,6 | 5,4 | LD | 303 | SR44SW | SB-A9 | ||
| 11,6 | 5,4 | HD | SR44 | 357 | SR44W | SB-B9 | RW42 |
| 11,6 | 4,2 | LD | 301 | SR43SW | SB-A8 | RW34 | |
| 11,6 | 4,2 | HD | SR43 | 386 | SR43W | SB-B8 | |
| 11,6 | 3,6 | LD | SR43 | 344 | SR1136SW | RW36 | |
| 11,6 | 3,6 | HD | 350 | ||||
| 11,6 | 3 | LD | SR54 | 390 | SR1130SW | SB-AU | RW39 |
| 11,6 | 3 | HD | 389 | SR1130W | SB-BU | ||
| 11,6 | 2,1 | LD | 381 | SR1120SW | SBAS-DS | RW30 | |
| 11,6 | 2,1 | HD | 391 | SR1120W | SB-BS/ES | ||
| 11,5 | 1,65 | LD | 366 | SR1116SW | RW318 | ||
| 9,5 | 3,6 | LD | SR45 | 394 | SR936SW | SB-A4 | RW33 |
| 9,5 | 3,6 | HD | 380 | SR936W | |||
| 9,5 | 2,7 | LD | 395 | SR927SW | SBAP-DP | RW313 | |
| 9,5 | 2,7 | HD | SR57 | 399 | SR927W | SB-BP/EP | |
| 9,5 | 2,1 | LD | SR69 | 371 | SR920SW | SB-AN | RW315 |
| 9,5 | 2,1 | HD | SR69 | 370 | SR920W | SB-BN | |
| 9,5 | 1,65 | LD | SR68 | 373 | SR916SW | SBAJ-DJ | RW317 |
| 7,9 | 5,4 | LD | 309 | SR754SW | RW38 | ||
| 7,9 | 5,4 | HD | 393 | SR754W | SB-B3 | ||
| 7,9 | 3,6 | LD | SR41 | 384 | SR41SW | SBA1-D1 | RW37 |
| 7,9 | 3,6 | HD | SR41 | 392 | SR41W | SB-B1 | RW47 |
| 7,9 | 3,1 | LD | 329 | SR730SW | RW300 | ||
| 7,9 | 2,6 | LD | 397 | SR726SW | SB-AL | RW311 | |
| 7,9 | 2,6 | HD | 396 | SR726W | SB-BL | ||
| 7,9 | 2,1 | LD | SR58 | 362 | SR721SW | SB-AK/DK | RW310 |
| 7,9 | 2,1 | HD | SR721W | SR721W | SB-BK/EK | ||
| 7,9 | 1,65 | LD | 315 | SR716SW | SB-AT | RW316 | |
| 7,9 | 1,45 | LD | 341 | SR714SW | |||
| 7,9 | 1,3 | LD | 346 | SR712SW | SB-DH | ||
| 6,8 | 2,6 | LD | SR626 | 377 | SR626SW | SB-AW | RW329 |
| 6,8 | 2,6 | HD | 376 | SR626W | |||
| 6,8 | 2,15 | LD | SR60 | 364 | SR621SW | SBAG-DG | RW320 |
| 6,8 | 2,15 | HD | 363 | SR621W | |||
| 6,8 | 1,65 | LD | 321 | SR616SW | SBAF/DF | RW321 | |
| 6,8 | 1,45 | LD | 339 | SR614SW | |||
| 6,8 | 1,05 | LD | 333 | ||||
| 5,8 | 2,7 | LD | 319 | SR527SW | SBAE/DE | RW328 | |
| 5,8 | 2,15 | LD | 379 | SR521SW | SBAC-DC | RW327 | |
| 5,8 | 1,65 | LD | 317 | SR516SW | SB-AR | RW326 | |
| 5,8 | 1,25 | LD | 335 | SR512SW | SB-AB | ||
| 4,8 | 1,65 | LD | 337 | SR416SW |
Марганцево-щелочные элементы[править | править код]
Марганцево-щелочные элементы G13-A и LR44| диаметр, мм | высота, мм | Номинальная ёмкость, (мАч) | МЭК-код | Renata | Varta | Seiko, SmartBuy, Videx | Rayovac | Camelion, Hyundai | GP |
|---|---|---|---|---|---|---|---|---|---|
| 16 | 6,2 | 190 | LR9 | V625U | AG625 | PX625A | |||
| 11,6 | 5,4 | 110 | LR44 | LR1154 | V13GA | AG13 | RW82 | G13 | A76 |
| 11,6 | 4,2 | 70 | LR43 | LR1142 | V12GA | AG12 | RW84 | G12 | GP186A |
| 11,6 | 3,1 | 44 | LR54 | LR1130 | V10GA | AG10 | RW49 | G10 | GP189A |
| 11,6 | 2,1 | 24 | LR55 | LR1120 | V8GA | AG8 | RW40 | G8 | GP191A |
| 9,5 | 3,6 | 50 | LR45 | LR936 | V9GA | AG9 | G9 | GP94A | |
| 9,5 | 2,6 | 34 | LR57 | LR926 | V7GA | AG7 | G7 | ||
| 9,5 | 2,1 | 30 | LR69 | LR920 | V6GA | AG6 | G6 | GP71A | |
| 7,9 | 5,4 | 53 | LR48 | LR754 | V5GA | AG5 | G5 | GP93A | |
| 7,9 | 3,6 | 24 | LR41 | LR736 | V3GA | AG3 | G3 | ||
| 7,9 | 2,6 | 25 | LR59 | LR726 | AG2 | G2 | |||
| 7,9 | 2,15 | 21 | LR58 | LR721 | AG11 | G11 | GP62A | ||
| 6,8 | 2,6 | 12 | LR66 | LR626 | V4GA | AG4 | G4 | GP77A | |
| 6,8 | 2,15 | 8 | LR60 | LR621 | V1GA | AG1 | G1 | ||
| 5,8 | 2,15 | 9 | LR63 | LR521 | AG0 | G0 |
Воздушно-цинковые элементы[править | править код]
| диаметр, мм | высота, мм | МЭК-код | Renata | Varta | Rayovac |
|---|---|---|---|---|---|
| 11,6 | 5,4 | PR44 | ZA675 | V675A | DA675 |
| 7,9 | 5,4 | PR48 | ZA13 | V13A | DA13 |
| 7,9 | 3,6 | PR41 | ZA312 | V312A | DA312 |
| 5,9 | 3,6 | PR70 | ZA10 | V10 | DA230 |
Литиевые элементы (3V)[править | править код]
Литиевые элементы Литиевый элемент питания CR2032. Вид со стороны анода и катодаБольшинство производителей использует одинаковую схему наименований.
Элементы типоразмера CR2032 имеют особую сферу применения: именно они используются для питания постоянно действующих энергозависимых компонентов (CMOS-память, часы) подавляющего большинства материнских плат современных компьютеров.
Дисковые аккумуляторы Д-0,55С по сравнению с рублёвой монетой Миниатюрный литий-ионный аккумулятор формфактора 2032 Дисковые аккумуляторы Д-0,26Д и Д-0,06Существуют также дисковые аккумуляторы (например, никель-кадмиевые или литиевые). Они имеют меньшую, в сравнении с гальваническими элементами, ёмкость.
Они применяются как альтернатива гальваническим элементам в устройствах, требующих частой смены источника питания (слуховые аппараты, фотовспышки, электрические фонарики), а также для резервного питания часов различных устройств (например, игровой приставки Sega Dreamcast), в наручных часах с подзарядкой от солнечных батарей.
В СССР для питания электронных устройств были распространены дисковые никель-кадмиевые аккумуляторы.
| Название аккумулятора | Диаметр мм | Высота мм | Напряжение вольт | Ёмкость А/час | Рекомендуемый ток разряда, мА | Применение |
|---|---|---|---|---|---|---|
| Д-0,03 | 11,6 | 5,5 | 1,2 | 0,03 | 3 | фотоаппараты, слуховые аппараты |
| Д-0,06 | 15,6 | 6,4 | 1,2 | 0,06 | 12 | фотоаппараты, фотоэкспонометры, слуховые аппараты |
| Д-0,125 | 20 | 6,6 | 1,2 | 0,125 | 12,5 | аккумуляторные электрические фонарики, микрокалькулятор «Электроника МК-33» |
| Д-0,26 | 25,2 | 9,3 | 1,2 | 0,26 | 26 | аккумуляторные электрические фонарики, фотовспышки, микрокалькуляторы «Электроника» моделей Б3-35, Б3-36, МК-35 и МК-36. |
| Д-0,55 | 34,6 | 9,8 | 1,2 | 0,55 | 55 | фотовспышки, микрокалькуляторы «Электроника» моделей Б3-18 и Б3-34 |
| 7Д-0,125 | 8,4 | 0,125 | 12,5 | замена батареек «Крона» |
Из-за своего размера миниатюрные элементы питания могут быть легко проглочены детьми.
Попавший в пищевод или дыхательные пути миниатюрный элемент питания или аккумулятор может привести к химическим и термическим ожогам. В случае застревания и длительного воздействия застрявший элемент питания может вызвать летальное кровотечение. [1]
В целях предотвращения этого крышки батарейных отсеков на детских игрушках, использующих такие элементы питания или аккумуляторы, часто оснащают фиксирующими винтами, иногда с нестандартной головкой.
- батарея A23
- батарея A27
- батарея «Крона»
ru.wikipedia.org
Химический источник тока — Википедия
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с серной кислотой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда[1].
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно, пока обеспечивается подача реагентов.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока[править | править код]
Гальванические элементы[править | править код]
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
- См. также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Литий-железо-дисульфидный элемент | FeS2 | Li | 1,50 | |
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
Электрические аккумуляторы[править | править код]
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- См. также Категория: Аккумуляторы.
Топливные элементы[править | править код]
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- См. также Категория: Топливные элементы.
- ↑ Exhibit 1 — The Clarendon Dry Pile». Oxford Physics Teaching, History Archive. Retrieved 18 January 2008
- ↑ В демонстрационных экспериментах зачастую используют мякоть плодов апельсина, яблоки и пр.
- Дасоян М. А. Химические источники тока. — 2-е изд. — Л., 1969.
- Романов В. В., Хашев Ю. М. Химические источники тока. — М., 1968.
- Орлов В. А. Малогабаритные источники тока. — 2-е изд. — М., 1970.
- Вайнел Д. В. Аккумуляторные батареи. — пер. с англ., 4-е изд. — М. — Л., 1960.
- The Primary Battery / ed. G. W. Heise, N. C. Cahoon. — N. Y. — L., 1971. — Т. v. 1.
| |||
ru.wikipedia.org
Багдадская батарея — Википедия
Материал из Википедии — свободной энциклопедии
Три составные части батарейкиБагда́дская батаре́йка (также Селевкийские вазы) — месопотамский артефакт парфянского или сасанидского периодов, который вслед за его первооткрывателем — немецким археологом Вильгельмом Кёнигом, директором Национального музея Ирака, — иногда считают древним гальваническим элементом, созданным за 2000 лет до рождения Алессандро Вольта.
В наше время багдадская батарейка находится в Национальном музее Ирака.
Вильгельм Кёниг в своей книге «В потерянном раю» даёт такое описание багдадской батарейке:
… верхний конец стержня примерно на сантиметр выступал над цилиндром и был покрыт тонким, светло-желтым, но полностью окисленным слоем металла, по виду похожего на свинец. Нижний конец железного стержня не доставал до днища цилиндра, на котором находился слой асфальта толщиной примерно три миллиметра.
Первая «батарейка», обнаруженная Кёнигом близ Багдада в июне 1936 года (в некоторых источниках говорится, что в 1938 году), представляла собой 13-сантиметровый сосуд, горлышко которого было залито битумом, а через него проведен железный прут со следами коррозии. Внутри сосуда находился медный цилиндр, внутри которого находился железный стержень[1].
Вильгельм Кёниг предположил, что багдадская батарейка (точнее, «гальванический» элемент), заполненная кислотой или щёлочью, могла создать электрическое напряжение в один вольт. Кёниг пересмотрел экспонаты Национального музея Ирака. Его удивили медные посеребрённые вазы, относящиеся к 2500 году до н. э. Как предположил Кёниг, серебро на вазах было нанесено электролитическим методом.
Версию Кёнига о том, что находка является батарейкой, подтверждал профессор Дж. Б. Перчински из Университета Северной Каролины. Он создал точную копию «батарейки» и наполнил её пятипроцентным винным уксусом. Было зафиксировано напряжение в 0,5 вольта.
Немецкий египтолог Арне Эггебрехт при помощи опыта доказывал, что ещё более 2000 лет назад была известна гальванизация. Для подтверждения он использовал статуэтку Осириса. Использовав 10 сосудов, подобных багдадской батарейке, и солевой раствор золота, за несколько часов учёный покрыл статуэтку ровным слоем золота.
В 1947 году американский физик Уиллард Ф. Грей изготовил точную копию багдадской батарейки, использовав сульфат меди в качестве электролита. Батарейка дала электрический ток с напряжением около 2 вольт. После было проделано множество подобных экспериментов, но напряжение получалось примерно таким же: от 0,8 вольт до 2 вольт.
В 29 выпуске телепередачи «Разрушители легенд» были протестированы терракотовые копии багдадской батарейки: используя лимонный сок как электролит, удалось получить электричество напряжением около 4 вольт.
С другой стороны, скептически настроенные археологи отмечают, что сама демонстрация возможности использования находки в качестве источника электрического тока не доказывает, что она на самом деле так применялась. К тому же слой асфальта покрывает медный цилиндр полностью, что исключает подключения проводов снаружи. Также асфальт хорошо подходит для запечатывания сосудов для сохранности содержимого, однако для гальванических элементов такого типа герметизация не только не нужна, но и контрпродуктивна, так как препятствует возможности добавления или замены электролита. Не было найдено никакого сопутствующего электрического оборудования, которое могло бы использовать «батарейки», не было найдено даже проводников тока. Также неизвестны образцы того времени, покрытые золотом с помощью электричества, все они были позолочены хорошо известным процессом амальгамирования. Вдобавок багдадская батарейка почти идентична найденным сосудам из близлежащей Селевкии с известной функцией — они использовались для хранения свитков.
- ‘«Riddle of ‘Baghdad’s batteries» // BBC, 27 February, 2003. (англ.)
- «Battery, Baghdad, 250 BC» at the Smith College Museum of Ancient Inventions (англ.)
- Von Handorf, D E., Crotty, D. E., The Baghdad battery — myth or reality? // Plating and Surface Finishing (USA). Vol. 89, no. 5, pp. 84-87. May 2002
- Brian Haughton «The Baghdad battery», Hidden History: Lost Civilizations, Secret Knowledge, and Ancient Mysteries, pages 129—132, Career Press, 2007 ISBN 1564148971.
- Dubpernell, G. Evidence of the use of primitive batteries in antiquity // Selected Topics in the History of Electrochemistry, The Electrochemical Society, I-22 Princetn, NJ. 1978.
- Eggert, G. The Enigma of the ‘Battery of Baghdad . // Proceedings 7th European Skeptics Conference. 1995.
- Eggert, G. The enigmatic battery of Baghdad . // Skeptical Inquirer, May-June 1996 V20 N3 PG31(4).
- MacKechnie, J. C. An Early Electric cell? // Journal of the Institute of Electrical Engineers, 6:356-57. 1960.
- Paszthory E. Electricity generation or Magic? The analysis of an unusual group of finds from Mesopotamia. // MASCA Research Papers in Science and Technology 6:31-8. 1989.
- Gerhard Eggert The enigmatic ‘Battery of Baghdad’ // Skeptical Inquirer. — 1996. — № 3 (20) — P.31-34.
ru.wikipedia.org
Батарейка Википедия
Батарея соединённых последовательно трёх залитых смолой гальванических элементов в общем картонном корпусе «Планета-1» типоразмера 3R12 (3336) У этого термина существуют и другие значения, см. Батарея. Гальванические элементы, батареи элементов и батареи аккумуляторовБатарея (фр. batterie) — два или более соединённых параллельно или последовательно электрических элементов. Обычно под этим термином подразумевается соединение электрохимических источников электроэнергии/электрического тока (гальванических элементов, аккумуляторов, топливных элементов).
В электротехнике источники электроэнергии (гальванические элементы, аккумулятор), термоэлементы или фотоэлементы соединяют в батарею, чтобы получить напряжение, снимаемое с батареи (при последовательном соединении), силу тока или ёмкость (при параллельном соединении), образованного источника больше, чем может дать один элемент.
Прародителем батареи последовательно соединённых электрохимических элементов можно считать вольтов столб, изобретённый Алессандро Вольта в 1800 году, состоящий из последовательно соединённых медно-цинковых гальванических элементов.
Батарейкой в обиходе обычно не совсем корректно называют одиночные гальванические элементы (например, типа АА), которые обычно в источниках питания устройств соединяются в батарею для получения необходимого напряжения.
Батареей называют и цепь, содержащую только пассивные электрические элементы: резисторы (для увеличения рассеиваемой мощности или изменения сопротивления), конденсаторы (для увеличения ёмкости или увеличения рабочего напряжения), изменения ёмкости. Такие устройства, снабжённые элементами коммутации — переключателями, гнёздами и т. п. часто называют магазинами (магазин сопротивлений, магазин ёмкостей).
ru-wiki.ru
Литий-ионный аккумулятор — Википедия
 Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]
Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, который широко распространён в современной бытовой электронной технике и находит своё применение в качестве источника энергии в электромобилях и накопителях энергии в энергетических системах. Это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты, видеокамеры и электромобили.
Первый литий-ионный аккумулятор выпустила корпорация Sony в 1991 году.
Нобелевская премия по химии 2019 года была вручена троим учёным «За создание литий-ионных батарей».
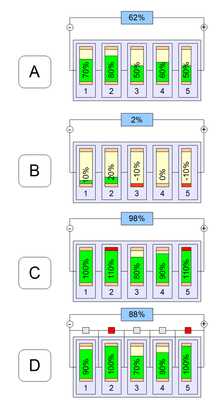 При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во время зарядки батареи
При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во время зарядки батареиХарактеристики литий-ионных аккумуляторов зависят от химического состава составляющих компонентов и варьируются в следующих пределах:
Контроллер заряда/разряда (плата защиты) цилиндрического литий-ионного аккумулятора, конструкционно припаянный к отрицательному контакту аккумулятора и обратной фольгированной стороной выполняющий его функции. На снимке частично демонтирован и отсоединён от проводника, идущего к положительному контакту аккумулятораЧасто в корпус аккумулятора встраивают контроллер защиты (или PCB-плата (англ. Protection Circuit Module)), который отключает аккумулятор, предотвращая превышение напряжения заряда, чрезмерный разряд и превышение температуры, приводящие его к преждевременной деградации или разрушению. Также этот контроллер может опционально ограничивать ток потребления. Тем не менее, надо учитывать, что не все аккумуляторы снабжаются защитой. В целях снижения стоимости производители могут не устанавливать её. Кроме того, в устройствах в которых встроен контроллер защиты, а также в аккумуляторных батареях (к примеру ноутбуков) используются только аккумуляторы без встроенной платы защиты[5].
Литиевые аккумуляторы имеют специальные требования при подключении нескольких ячеек последовательно. Зарядные устройства для таких многосоставных аккумуляторов с ячейками или сами аккумуляторные батареи снабжаются схемой балансировки ячеек. Смысл балансировки в том, что электрические свойства ячеек могут немного отличаться, и какая-то ячейка достигнет полного заряда/разряда раньше других. При этом необходимо прекратить заряд этой ячейки, продолжая заряжать остальные, так как переразряд или перезаряд литий-ионных аккумуляторов выводит их из строя. Эту функцию выполняет специальный узел — балансир[en] (или BMS-плата (англ. Battery Management System)[6]). Он шунтирует заряженную ячейку так, чтобы ток заряда шёл мимо неё. Балансиры одновременно выполняют функцию платы защиты в отношении каждого из аккумуляторов, так и батареи в целом[7][8].
Зарядные устройства могут поддерживать конечное напряжение заряда в диапазоне 4,15—4,25В.
Кроме контроллера защиты, литий-ионные, а также литий-полимерные аккумуляторы выпускаемые в формфакторах АА и ААА с напряжением 1,5 В (не следует путать с аналогичного размера формфакторами 14500 и 10440 напряжением 3,7 В, а также с незаряжаемыми одноразовыми литиевыми элементами питания напряжением тоже 1,5 В) оборудуются встроенными электронными преобразователями напряжения. Отличие таких аккумуляторов — стабилизированное напряжение на выходе на контактах в 1,5 В независимо от рабочего напряжения самой ячейки аккумулятора и его моментальное обнуление, когда напряжение самой литиевой ячейки становится ниже допустимого (срабатывает плата защиты).
Литий-ионный аккумулятор. Схема работыЛитий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделённых пористым сепаратором, пропитанным электролитом. Пакет электродов помещён в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъёмникам. Корпус иногда оснащают предохранительным клапаном, сбрасывающим внутреннее давление при аварийных ситуациях или нарушениях условий эксплуатации. Литий-ионные аккумуляторы различаются по типу используемого катодного материала. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет способность внедряться (интеркалироваться) в кристаллическую решётку других материалов (например, в графит, оксиды и соли металлов) с образованием химической связи, например: в графит с образованием LiC6, оксиды (LiMnO2) и соли (LiMnRON) металлов.
Первоначально в качестве отрицательных пластин применялся металлический литий, затем — каменноугольный кокс. В дальнейшем стал применяться графит. Применение оксидов кобальта позволяет аккумуляторам работать при значительно более низких температурах, повышает количество циклов разряда/заряда одного аккумулятора. Распространение литий-железо-фосфатных аккумуляторов обусловлено их относительно низкой стоимостью. Литий-ионные аккумуляторы применяются в комплекте с системой контроля и управления — СКУ или BMS (battery management system), — и специальным устройством заряда/разряда.
В настоящее время в массовом производстве литий-ионных аккумуляторов используются три класса катодных материалов:
- кобальтат лития LiCoO2 и твёрдые растворы на основе изоструктурного ему никелата лития
- литий-марганцевая шпинель LiMn2O4
- литий-феррофосфат LiFePO4.
Электрохимические схемы литий-ионных аккумуляторов:
- литий-кобальтовые LiCoO2 + 6C → Li1-xCoO2 + LiC6
- литий-ферро-фосфатные LiFePO4 + 6C → Li1-xFePO4 + LiC6
Благодаря низкому саморазряду и большому количеству циклов заряда/разряда, Li-ion-аккумуляторы наиболее предпочтительны для применения в альтернативной энергетике. При этом, помимо системы СКУ они укомплектовываются инверторами (преобразователи напряжения).
- Высокая энергетическая плотность (ёмкость).[источник не указан 619 дней]
- Низкий саморазряд.
- Высокий ток работы
- Не требуют обслуживания.
Широко применяемые литий-ионные аккумуляторы при перезаряде, несоблюдении условий заряда или при механическом повреждении часто бывают чрезвычайно огнеопасными.
- Огнеопасны
- Теряют работоспособность при переразряде
- Теряют ёмкость на холоде
- От 200 до 500 циклов зарядки
Взрывоопасность[править | править код]
Вздувшийся литий-ионный аккумулятор в плоском алюминиевом корпусе типоразмера ENEL10 (Li-42B, NP-45). Бумажная этикетка снятаАккумуляторы Li-ion первого поколения были подвержены взрывному эффекту. Это объяснялось тем, что в них использовался анод из металлического лития, на котором в процессе многократных циклов зарядки/разрядки возникали пространственные образования (дендриты), приводящие к замыканию электродов и, как следствие, возгоранию или взрыву. Этот недостаток удалось окончательно устранить заменой материала анода на графит. Подобные процессы происходили и на катодах литий-ионных аккумуляторов на основе оксида кобальта при нарушении условий эксплуатации (перезарядке). Литий-ферро-фосфатные аккумуляторы полностью лишены этих недостатков. Кроме того, все современные зарядные устройства для литий-ионных аккумуляторов предотвращают перезаряд и перегрев вследствие слишком интенсивного заряда.[источник не указан 498 дней]
Литиевые аккумуляторы изредка проявляют склонность к взрывному самовозгоранию.[16][17][18] Интенсивность горения даже от миниатюрных аккумуляторов такова, что может приводить к тяжким последствиям.[19] Авиакомпании и международные организации принимают меры к ограничению перевозок литиевых аккумуляторов и устройств с ними на авиатранспорте.[20][21]
Самовозгорание литиевого аккумулятора очень плохо поддается тушению традиционными средствами. В процессе термического разгона неисправного или поврежденного аккумулятора происходит не только выделение запасенной электрической энергии, но и ряд химических реакций, выделяющих вещества для поддержания горения, горючие газы от электролита[22], а также в случае не LiFePO4 электродов[23], выделяется кислород. Потому вспыхнувший аккумулятор способен гореть без доступа воздуха и для его тушения непригодны средства изоляции от атмосферного кислорода. Более того, металлический литий активно реагирует с водой с образованием горючего газа водорода, потому тушение литиевых аккумуляторов водой эффективно только для тех видов аккумуляторов, где масса литиевого электрода невелика. В целом тушение загоревшегося литиевого аккумулятора неэффективно. Целью тушения может быть лишь снижение температуры аккумулятора и предотвращение распространения пламени[24][25][26].
Эффект памяти[править | править код]
Традиционно считается, что, в отличие от Ni-Cd и Ni-MH аккумуляторов, Li-Ion аккумуляторы полностью избавлены от эффекта памяти. По результатам исследований учёных Института Пауля Шерера (Швейцария) в 2013 году этот эффект был таки обнаружен, но оказался ничтожен.[27]
Причиной его является то, что основой работы батареи являются процессы высвобождения и обратного захвата ионов лития, динамика которых ухудшается в случае неполной зарядки.[28] Во время зарядки ионы лития один за другим покидают частицы литий-феррофосфата, размер которых составляет десятки микрометров. Катодный материал начинает разделяться на частицы с разным содержанием лития. Заряжание батареи происходит на фоне возрастания электрохимического потенциала. В определённый момент он достигает предельного значения. Это приводит к ускорению высвобождения оставшихся ионов лития из катодного материала, но они уже не меняют суммарного напряжения батареи. Если батарея не будет полностью заряжена, то на катоде останется некоторое число частиц, близких к пограничному состоянию. Они практически достигли барьера высвобождения ионов лития, но не успели его преодолеть. При разряде свободные ионы лития стремятся вернуться на место и рекомбинировать с ионами феррофосфата. Однако на поверхности катода их также встречают частицы в пограничном состоянии, уже содержащие литий. Обратный захват затрудняется, и нарушается микроструктура электрода.
В настоящее время просматриваются два пути решения проблемы: внесение изменений в алгоритмы работы системы управления батареями и разработка катодов с увеличенной площадью поверхности.
Требования к режимам заряда/разряда[править | править код]
Глубокий разряд полностью выводит из строя литий-ионный аккумулятор. Также на жизненный цикл аккумуляторов влияет глубина его разряда перед очередной зарядкой и зарядка токами выше установленных производителем. Крайне чувствительны они и к напряжению зарядки. Если его повысить всего на 4 %, то аккумуляторы будут вдвое быстрее терять ёмкость от цикла к циклу. Ток зарядки зависит от разницы напряжений между аккумулятором и зарядным устройством и от сопротивления как самого аккумулятора, так и подводимых к нему проводов. Поэтому увеличение напряжения зарядки на 4 % может приводить к увеличению тока зарядки в 10 раз. Это отрицательно сказывается на аккумуляторе. Он может перегреваться и деградировать[29].
Старение[править | править код]
Литиевые аккумуляторы стареют, даже если не используются. Соответственно, нет смысла покупать аккумулятор «про запас» или чрезмерно увлекаться «экономией» его ресурса.
Оптимальные условия хранения Li-ion-аккумуляторов достигаются при 40-процентном заряде от ёмкости аккумулятора и температуре 0…10 °C:[30]
| Температура, ⁰C | С 40%-м зарядом, % за год | Со 100%-м зарядом, % за год |
|---|---|---|
| 0 | 2 | 6 |
| 25 | 4 | 20 |
| 40 | 15 | 35 |
| 60 | 25 | 40 % за три месяца |
Снижение ёмкости при низких температурах[править | править код]
Как и в других типах аккумуляторов, разрядка в условиях низких температур приводит к снижению отдаваемой энергии, в особенности при температурах ниже 0 ⁰C. Так, снижение запаса отдаваемой энергии при понижении температуры от +20 ⁰C до +4 ⁰C приводит к уменьшению отдаваемой энергии на ~5-7 %, дальнейшее понижение температуры разрядки ниже 0 ⁰C приводит к потере отдаваемой энергии на десятки процентов и может приводить к преждевременному исчерпанию ресурса. Химия литий-ионных аккумуляторов более чувствительна к температурам заряжания, и оно оптимально при температурах ~ +20 ⁰C, а при температурах ниже +5 ⁰C не рекомендовано.[31]
Как и для других типов аккумуляторов, одним из вариантов решения проблемы являются аккумуляторы с внутренним подогревом.[32]
- ↑ А.М. Скундин, О.А. Брылев. Наноматериалы в современных химических источниках тока (неопр.). МГУ (2011г).
- ↑ Li-ion 4.35V vs 4.20V сколько теряем? Тест SANYO UR18650ZTA. / Зарядки, пауэрбанки, провода и переходники / iXBT Live (рус.). iXBT Live (26 августа 2018). Дата обращения 18 октября 2019.
- ↑ Топовые аккумуляторы 21700: LG M50 5000мАч vs Samsung 48G 4800мАч / Зарядки, пауэрбанки, провода и переходники / iXBT Live (рус.). iXBT Live (30 июня 2018). Дата обращения 18 октября 2019.
- ↑ Sony VTC6A и VTC6 с одинаковыми Matrix-кодами — результаты тестов (неопр.). www.ecigtalk.ru. Дата обращения 18 октября 2019.
- ↑ Н. Бровка, О. Янченков Применение специализированных микропроцессоров для построения схем контроля и защиты литий-ионных и литий-полимерных аккумуляторных батарей // Журнал «Компоненты и Технологии». — № 3, 2007 г. С. 132—135. ISSN 2079-6811.
- ↑ Обзор BMS контроллера заряда литий-ионных аккумуляторов 18650 3.7В на YouTube
- ↑ Сердечный Д. В., Томашевский Ю. Б. Управление процессом заряда многоэлементных литий-ионных аккумуляторных батарей / Научная статья // Журнал «Измерение. Мониторинг. Управление. Контроль». — № 3 (21), 2017 г. С. 115—123. УДК 621.314. DOI 10.21685/2307-5538-2017-3-16. ISSN 1999-5458.
- ↑ Сазонов И. Е., Лукьяненко М. В. Выравнивание заряда в литий-ионных аккумуляторных батареях / Научная статья // Сборник материалов IX Междунарародной научно-практической конференции, посвящённой Дню космонавтики]]. «Актуальные проблемы авиации и космонавтики» [Электронныйресурс]. Красноярск: СибГУ им. М. Ф. Решетнева — № 9, т. 1, 2013 г. С. 204. УДК 537.22. ISSN 1999-5458.
- ↑ [1].
- ↑ [2].
- ↑ [3].
- ↑ [4]
- ↑ [5]
- ↑ [6].
- ↑ [7].
- ↑ Возгорания на Dreamliner связаны с аккумуляторами
- ↑ Samsung отзывает Galaxy Note 7 из-за возможности возгорания
- ↑ Находившийся за рулем Tesla бывший агент ФБР погиб в ДТП
- ↑ Should You Be Worried About Your E-Cigarette Exploding?
- ↑ Лайнер экстренно сел из-за загоревшегося планшета Samsung
- ↑ Lithium Batteries as Cargo in 2016 Update III
- ↑ Bandhauer Todd M., Garimella Srinivas, Fuller Thomas F. A Critical Review of Thermal Issues in Lithium-Ion Batteries (англ.) // Journal of The Electrochemical Society. — 2011. — Vol. 158, no. 3. — P. R1. — ISSN 0013-4651. — DOI:10.1149/1.3515880. [исправить]
- ↑ Zaghib K., Dubé J., Dallaire A., Galoustov K., Guerfi A., Ramanathan M., Benmayza A., Prakash J., Mauger A., Julien C.M. Enhanced thermal safety and high power performance of carbon-coated LiFePO4 olivine cathode for Li-ion batteries (англ.) // Journal of Power Sources. — 2012. — December (vol. 219). — P. 36—44. — ISSN 0378-7753. — DOI:10.1016/j.jpowsour.2012.05.018. [исправить]
- ↑ http://www.powerinfo.ru/accumulator-liion.php
- ↑ Гореть, а не тлеть! Что на самом деле случилось с электроседаном Tesla Motors?
- ↑ Аспекты безопасности литий-ионных аккумуляторов
- ↑ Paul Scherrer Institut (PSI) :: Memory effect now also found in lithium-ion batteries (неопр.). Дата обращения 2 мая 2013. Архивировано 11 мая 2013 года.
- ↑ Экономия батареи на Андроид: советы и мифы | AndroidLime (неопр.). androidlime.ru. Дата обращения 29 февраля 2016.
- ↑ Мельничук О. В., Фетисов В. С. Особенности заряда и разряда литиевых аккумуляторных батарей и современные технические средства управления этими процессами / Научная статья // Журнал «Электротехнические и информационные комплексы и системы». — № 2, т. 12, 2016 г. С. 41-48. УДК 621.355.9. ISSN 1999-5458.
- ↑ 5 практических советов по эксплуатации литий-ионных аккумуляторов (рус.)
- ↑ Эксплуатация и хранение литий-ионных аккумуляторов (рус.)
- ↑ Независимая интернет-газета «Новый взгляд». 22.01.2016.Созданы литий-ионные аккумуляторы с подогревом
ru.wikipedia.org

