Лабораторная работа №2 Биуретовая реакция (Пиотровского)
Цель работы:
Провести биуретовую реакцию (Пиотровского)
Ход работы:
В 2 пробирки наливают: в одну – 5 капель 1%-ного раствора яичного белка, в другую 5 капель 1% раствора пшеничного белка. В обе пробирки прибавляют по 5 капель 10%-ного раствора едкого натра и по 1 капле 1% раствора сернокислой меди. В обоих пробирках появляется устойчивое красно-фиолетовое (или сине-фиолетовое) окрашивание.
В пробирку наливают 20 капель 10% раствора едкого натра, добавляют 1-2 капли 1% раствора сернокислой меди и перемешивают. Затем набирают в пипетку разбавленный раствор белка и спускают его по стене пробирку так, чтобы он наслаивался сверху. На границе двух слоев жидкости образуется фиолетовое кольцо.
Вывод:
В данной работе мы провели биуретовоую реакцию (Пиотровского). При добавлении к щелочному раствору белка раствора сернокислой меди жидкость приобретает красно-фиолетовое или сине-фиолетовое окрашивание. Реакция обусловлена присутствием в белке пептидных связей, которые с ионами меди образуют окрашенные солеобразные комплексные соединения. Окраска биуретового комплекса зависит от количества медной соли в растворе и от структуры вещества, с которым координирован ион меди. Продукты распада белка – пептоны и полипептиды – дают биуретовую реакцию с красным оттенком.
Лабораторная работа №3 Нингидриновая реакция на α-аминокислоты
Цель работы:
Провести нингидриновую реакцию на α-аминокислоты
Ход работы:
В 3 пробирки наливают: в одну 5 капель 1% раствора яичного белка, в другую 5 капель дистиллированной воды и добавляют около 0.1 г пшеничной муки, в третью – 5 капель 0.1% раствора глицина.
В каждую пробирку наливают по 2-3 капли 0.1% раствора нингидрина и кипятят.
Через 1-2 минуты появляется розовое, красное, а затем синее окрашивание. При стоянии интенсивность окраски увеличивается.
Вывод:
В данной лабораторной работе провели нингидриновую реакцию на α-аминокислоты. Раствор белка при нагревании с разбавленным раствором нингидрина окрашивается в синий цвет. Реакция обусловлена наличием в белке остатков α-аминокислот. При взаимодействии с нингидрином α-аминокислоты окисляются и распадаются с образованием аммиака, альдегида и угольной кислоты. Нингидрин восстанавливается и конденсируется с другой частицей нингидрина и аммиаком. В результате образуется сложное соединение мурексидного строения, окрашенное в синий цвет.
Лабораторная работа №4 Ксантопротеиновая реакция на циклические аминокислоты
Цель работы:
Провести ксантопротеиновые реакции на циклические аминокислоты
Ход работы:
В 3 пробирки наливают: в первую 5 капель 1% раствора яичного белка, во вторую – 5 капель 1% раствора пшеничного белка, в третью-5 капель 1% раствора желатина. Во все пробирки добавляют 2-3 капли концентрированной азотной кислоты и нагревают.
В первой и второй пробирках жидкость окрашивается в лимонно-желтый цвет, в третьей получается едва заметное бледно-желтое окрашиваение. Желатин не содержит циклических аминокислот; бледно-желтое окрашивание обусловлено незначительной примесью других белков.
После охлаждения в каждую пробирку добавляют по 10 капель концентрированного раствора аммиака или 30% раствора едкого натра. Окраска жидкости переходит в оранжевую.
Вывод:
В данной лабораторной работе провели ксантопротеиновую реакцию на циклические аминокислоты. При нагревании растворов большинства белков с концентрированной азотной кислотой жидкость окрашивается в лимонно-желтый цвет, переходящий при подщелачивании в оранжевый.
Реакция обусловлена присутствием в белке циклических аминокислот, которые при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные желтого цвета. Последние при добавлении щелочи превращаются в соли хиноидной структуры, окрашенные в оранжевый цвет.
studfile.net
Лабораторная работа № 1 цветные реакции на белки
При взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции. Образование их обусловлено присутствием в молекуле белка связей или различных аминокислот, т.е. определенных химических группировок, обуславливающих ход реакции. Поэтому и вещества не белковой природы, но имеющие те же химические группировки, могут давать эти реакции.
Различают так называемые универсальные цветные реакции, свойственные всем белкам — это биуретовая и нингидриновая реакции, остальные цветные реакции обусловлены природой радикалов аминокислот.
По цветным реакциям можно доказать белковую природу вещества, обнаружить наличие или отсутствие отдельных аминокислот. Кроме того, разработаны методы количественного определения белков и аминокислот, в основе которых лежат цветные реакции.
1. Биуретовая реакция
 Биуретовая
реакция является универсальной на
пептидную связь в белках. Вещества,
имеющие в своем составе не менее 2-х
пептидных связей дают эту реакцию.
Биуретовая
реакция является универсальной на
пептидную связь в белках. Вещества,
имеющие в своем составе не менее 2-х
пептидных связей дают эту реакцию.
Реакция состоит в том, что в щелочной среде в присутствии сернокислой меди белки и полипептиды дают сине-фиолетовое или красно-фиолетовое окрашивание в зависимости от длины пептида вследствие образования комплексных соединений меди с пептидной группой. Продукты гидролиза белков (пептоны) могут давать розовое, красное окрашивание.
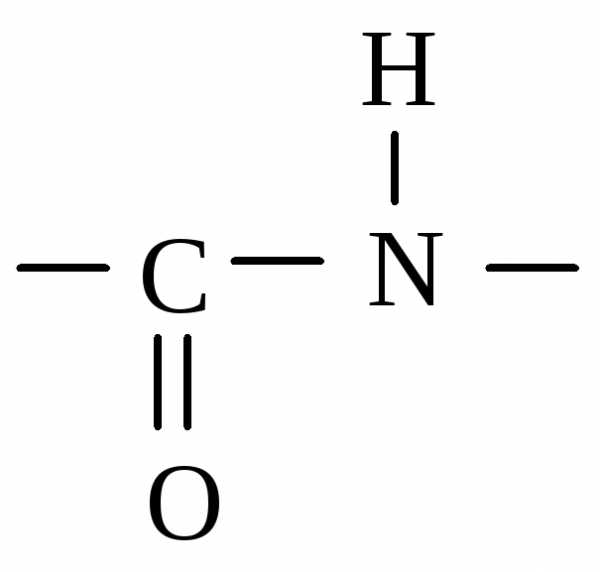
Названа эта реакция так потому, что ее дает и биурет, содержащий также пептидные связи. Биурет, имеющий две группировки -СО-NН-, образуется при нагревании сухой мочевины с отщеплением аммиака:
мочевина биурет
Группа, образующая пептидную связь |-СО-NН-|, в щелочной среде присутствует в таутомерной енольной форме:
лактамная лактимная
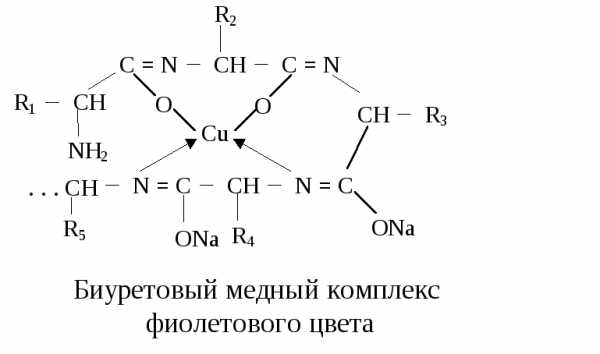
Щелочная среда приводит к появлению отрицательного заряда вследствие диссоциации ОН — группы, благодаря этому кислород взаимодействует с медью с образованием солеобразной связи, а медь в свою очередь с атомами азота связана через дополнительно координационные связи за счет использования их неподеленных электронных пар. Это ведет к образованию стабильного комплекса. Схематично реакцию можно представить так:
лактимная форма полипептида
Ход работы: В пробирку налить 1мл раствора белка, 1-2 мл 10% NаОН и 1-2 капли раствора сернокислой меди (1%). При взбалтывании появляется фиолетовое окрашивание. Образуется Сu*Na протеинат. Проделать тот же опыт, заменив NаОН чистой водой.
2. Ксантопротеиновая реакция
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот – триптофана, фенилаланина, тирозина, содержащих в своем составе ароматическое ядро.
Реакция носит название от греч. слова Xanthos – желтый. Ряд белков при добавлении к ним концентрированной азотной кислоты при нагревании дают желтое окрашивание, которое может переходить в оранжевое в щелочной среде.
Реакция вызвана нитрованием бензольного ядра указанных циклических аминокислот и образованием нитросоединений желтого цвета.
Тирозин Динитротирозин (желт.цв.)
При подщелачивании возникает хиноидная структура, окрашенная в оранжевый цвет.
Натриевая соль динитротирозина хиноидной структуры (оранжевого цвета)
Аналогично протекает реакция нитрования триптофана.
Ксантопротеиновую реакцию дают почти все белки. Ксантопротеиновая реакция обуславливает появление желтого окрашивания при попадании концентрированной азотной кислоты на кожу, ногти. Эту реакцию могут давать и более простые ароматические соединения (например, фенолы).
Исключение составляют клупеин и сальмин (из группы протаминов) и желатина, в молекуле которых почти полностью отсутствуют ароматические аминокислоты.
Ход работы: К раствору белка 1 мл прилить 5-6 капель концентрированной азотной кислоты, белок выпадает в осадок. При подогревании (осторожно) раствор окрашивается в желтый цвет. После охлаждения в пробирку наливают по каплям 10% раствор едкого натра до появления оранжевого окрашивания вследствие образования натриевой соли динитротирозина.
Биуретовая реакция
Принцип метода.В щелочной среде в присутствии солей меди растворы белка приобретают фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле. Продукты неполного гидролиза белка, содержащие не менее двух пептидных связей, дают биуретовую реакцию с красным оттенком. Реакция обусловлена наличием пептидных групп, которые в щелочной среде образуют с ионами двухвалентной меди окрашенные комплексы.
В щелочной среде пептидная группа присутствует в своей таутомерной енольной форме:
Ион меди взаимодействует с отрицательным зарядом диссоциированной в этих условиях ОН-группой – возникает солеобразная связь; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Комплексное соединение меди с енолизованными пептидными группами при участии четырех атомов азота можно представить следующим образом:
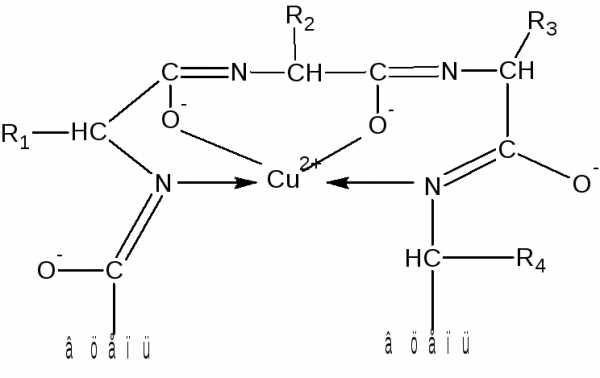
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 10 капель 10%-ного раствора NаОН и по одной капле 1%-ного раствора сульфата меди. Содержимое пробирок тщательно перемешивают. Развивается фиолетовое окрашивание с соответствующим оттенком.
Нингидриновая реакция
Принцип метода.Белки, полипептиды, как и свободные-аминокислоты, дают синее или фиолетовое окрашивание с нингидрином (гидрат трикетогидриндена). Реакция характерна для-аминогрупп аминокислот.
На Iстадии реакции образуется восстановленный нингидрин за счет окислительного дезаминирования (образованиеNН3) и декарбоксилирования (образование СО2)-аминокислот:
Окисленный Восстановленный
нингидрин нингидрин
На IIстадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570нм) пропорциональна количеству аминокислоты:

Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 3 капли 0,5%-ного раствора нингидрина и нагревают до кипения. Через 2–3 минуты в пробирках появляется розовое, красное, а затем сине-фиолетовое окрашивание.
Ксантопротеиновая реакция
Принцип метода. При добавлении к раствору белка концентрированной азотной кислоты белок выпадает в осадок, который при нагревании растворяется и жидкость окрашивается в желтый цвет. Эта реакция характерна для ароматических аминокислот (фенилаланина, тирозина и триптофона), которые подвергаются нитрованию:
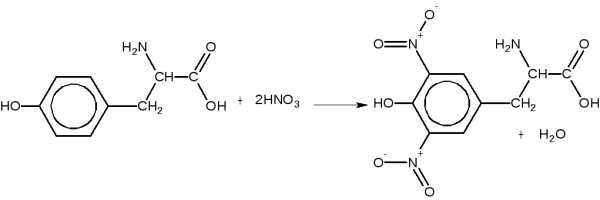
Нитропроизводное аминокислот в щелочной среде образуют соли хиноидной структуры, окрашенные в оранжевый цвет. Например:
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. Затем в пробирки добавляют по 3 капли концентрированной азотной кислоты и нагревают (осторожно!). При нагревании раствор и выпавший белый осадок или муть от свернувшегося белка окрашиваются в ярко-желтый цвет при наличии ароматических аминокислот: в пробирке с желатином появляется едва заметное бледно-желтое окрашивание (обусловленное незначительной примесью других белков). Пробирки охлаждают, после этого в них осторожно добавляют по 10 капель 30%-ного раствора гидроксида натрия. Выпавший в начале осадок белка растворяется, и жидкость окрашивается в ярко-оранжевый цвет.
studfile.net
Биуретовая реакция с пептидами — Справочник химика 21
Продукты распада белка — полипептиды — также дают биурето-вую реакцию. Цвет образующихся медных комплексов определяется числом аминокислот, связанных пептидной связью. Дипептиды дают синюю окраску, трипептиды — фиолетовую, а тетрапептиды и более сложные пептиды — красную. Фиолетовый цвет медного комплекса с белком в условиях проведения биуретовой реакции указывает на преобладание в сложной белковой частице трипептидных группировок (это подтверждается и другими данными). [c.120]Характерная для пептидов и белков биуретовая реакция заключается в образовании комплекса Си с пептидной группой [c.455]
Биуретовая реакция является не только качественной, но и количественной. Она позволяет следить за ходом гидролиза белков и устанавливать содержание пептидов в смесях с различной длиной цепи. Значительный вклад в изучение биуретовой реакции и способов ее использования для определения строения белков внесли Н. И. Гаврилов,. М. И. Плехан и К- Т. Порошин. [c.504]
Для обнаружения пептидных связей в пептидах и белках жит биуретовая реакция (см. 7.5), в которую вступают Ь пептиды и белки, содержащие по крайней мере две такие 1зи. [c.335]
Пептиды вступают во все реакции, свойственные аминогруппе и карбоксильной группе. Специфической реакцией пептидов является так называемая биуретовая реакция (см. стр. 846). Щелочные растворы пептидов при добавлении солей окисной меди дают характерную окраску, обусловленную образованием комплексных анионов, содержащих медь. [c.811]
Специфической реакцией на пептиды является так называемая биуретовая реакция (стр. 700). Щелочные растворы пептидов при добавлении солей окисной меди окрашиваются в синий, фиолетовый или красно-фиолетовый цвет. Дипептиды окрашиваются в синий, трипептиды — в фиолетовый, тетрапептиды и более сложные пептиды окрашиваются в красно-фиолетовый цвет. Окраска обусловлена образованием комплексных анионов, содержащих медь. [c.686]
Пептиды дают все реакции, которые характерны для аминокислот, с теми, однако, коррективами, которые вносят увеличение молекулярного веса, увеличение расстояния между аминной и карбоксильной группами и главное — появление новой функциональной группы — амидной. Специфической для пептидов является биуретовая реакция с солями меди в щелочной среде пептиды дают окрашенные комплексы,, например, [c.504]
Цветные реакции на белки. 1. Биуретовая реакция. При добавлении к раствору белка едкого натра и нескольких капель разбавленного раствора медного купороса появляется фиолетовое окрашивание, которое связано, как показывает опыт, с наличием в молекуле белка многочисленных пептид- [c.277]
Пепсин действует на внутренние пептидные связи, расщепляя белки на пептиды. О действии пепсина на белок, например на фибрин (нерастворимый белок плазмы), можно судить, наблюдая растворение кусочков фибрина. Полученный раствор дает положительную биуретовую реакцию, указывающую на появление в растворе пептидов. [c.165]
Окраска комплекса зависит также и от тех аминокислотных остатков, которые входят в состав пептида. Так, оксиаминокислоты смещают спектр поглощения в сторону более коротких волн. Пептиды, образованные по у Карбоксильной группе глутаминовой кислоты, не дают биуретовой реакции. [c.504]
Пептиды обладают некоторыми свойствами белков. Водные растворы пептидов с большими молекулами, подобно растворам белков, легко образуют пену. Пептиды, состоящие из более чем трех или четырех аминокислот, дают биуретовую реакцию. Некоторые из них осаждаются из раствора при добавлении электролитов и вновь растворяются после их удаления. [c.411]
Белки дают ряд цветных реакций, обусловленных наличием определенных аминокислотных остатков нли общих химических группировок. Эти реакции широко используются для аналитических целей. Среди них широко известны нингидриновая реакция, позволяющая проводить количественное определение аминогрупп в белках, пептидах и аминокислотах, а также биуретовая реакция, применяемая для качественного и количественного определения белков и пептидов. (При нагревании белка или пептида, но не аминокислоты, с Си 01 в щелочном растворе образуется окрашенное в фиолетовый цвет комплексное соединение меди, количество которого можно определить спектрофотометрически.) Цветные реакции на отдельные аминокислоты используются для обнаружения пептидов, содержащих соответствующие аминокислотные остатки. Для идентификации гуанидиновой группы аргинина применяется реакция Сакагучи — при взаимодействии с а-нафтолом и гипохлоритом натрия гуанидины в щелочной среде дают красное окрашивание. Индольное кольцо триптофана может быть обнаружено реакцией Эрлиха — красно-фиолетовое окрашивание при реакции с п-диме-тиламинобенэальдегидом в Н 804. Реакция Паули позволяет выявить остатки гистидина и тирозина, которые в щелочных растворах реагируют с диазобеизолсульфокислотой, образуя производные, окрашенные в красный цвет. [c.32]
Соли трехва.лентного железа дают хорошо известные окраски с фенолами (см. стр. 303), енолами, а-оксикислотами и с гидроксамовыми кислотами (см. стр. 235, 237, 643). Две известные цветные роакции, проводиАгые в щелочной среде, а именно реакция барбитуровых кислот с солядш кобальта и биуретовая реакция пептидов с медной солью, на бумаге оказываются сравнительно мало чувствптельпылгн. [c.169]
В сильно щелочном растворе при добавлении соли меди такие вещества, как биурет (НгМ—СО—ЫН—СО—-ЫНг), оксакид (НгЫ—СО—СО—хМНг), полипептиды и белки образуют окрашенные в сине-фиолетовый и красновато-фиолетовый цвет комплексные С0.Т1И. Биуретовая реакция, таким образом, обусловлена присутствием в молекуле или двух —СО—ЫН-групп или — СО—ЫН-группы и групп — С (-ЫН)—ЫНг или — СНг
www.chem21.info
Полипептиды биуретовая реакция — Справочник химика 21
БИУРЕТОВАЯ РЕАКЦИЯ — цветная реакция, которую дают с солями меди в щелочной среде биурет h3N ONH ONh3, амиды и имиды кислот, полипептиды, белки и другие соединения, содержащие группировки —СО—NH—, Б. р. — цветная реакция на белок — лежит в основе его количественного колориметрического определения. Если к щелочному раствору белка прибавить раствор uSO , появляется фиолетовое окрашивание. Чувствитель-1юсть Б. р. невысока. [c.45]Биуретовая реакция — одна из цветных реакций на белок и полипептиды. [c.99]
Продукты распада белка — полипептиды — также дают биурето-вую реакцию. Цвет образующихся медных комплексов определяется числом аминокислот, связанных пептидной связью. Дипептиды дают синюю окраску, трипептиды — фиолетовую, а тетрапептиды и более сложные пептиды — красную. Фиолетовый цвет медного комплекса с белком в условиях проведения биуретовой реакции указывает на преобладание в сложной белковой частице трипептидных группировок (это подтверждается и другими данными). [c.120]
Еще в 1888 г. А. Я- Данилевский высказал гипотезу о том, что различные а-аминокислоты, образуя белки, соединяются за счет аминогрупп и карбоксильных групп при помощи группировки —СО—НН—, впоследствии названной пептидной связью. Наличие пептидных связей в белках доказано многими фактами. В первую очередь оно подтверждается присутствием в продуктах гидролиза белков полипептидов — веществ, содержащих пептидные связи. Белки, как и полипептиды, дают так называемую биуретовую реакцию, характерную для соединений с пептидными связями (стр. 296). [c.290]
Для изучения компонентов нуклеопротеинов удобно использовать растительный объект — пекарские дрожжи. Продукты кислотного гидролиза нуклеопротеинов могут быть обнаружены специс )ическими реакциями биуретовой реакцией обнаруживают наличие полипептидов в гидролизате, пуриновые основания дают специфическую реакцию образования осадка солей серебра, фосфорную кислоту обнаруживают по реакции с молибдатом аммония, рибозу или дезоксирибозу — с помощью реакции Троммера. [c.95]
Биуретовая реакция является одной из цветных реакций на белок и полипептиды (см. стр. 151). [c.147]
БИУРЕТОВАЯ РЕАКЦИЯ — цветная реакция, к-рую дают с солями меди в щелочной среде биурет, амиды и имиды к-т, белки, полипептиды и некоторые др. соединепия. [c.222]
Биуретовая реакция (реакция Пиотровского). В щелочной среде белки, а также продукты их гидролиза — полипептиды дают фиолетовое или красно-фиолотовос окрашивание с солями меди. Реакция обусловлена наличием пептидных связей. Положительная биуретовая реакция проявляется у соединений, содержащих не менее двух [c.6]
При образовании биурета молекула аммиака отщепляется o i двух молекул мочевины. Отсюда и название биурет, указывающо4 на наличие двух остатков мочевины (от латинского urea — мочевина Биуретовая реакция является одной из цветных реакций на бел и полипептиды (см. стр. 125). [c.122]
Биуретовая реакция является одной из цветных реакций на полипептиды, а также на белок. К осадку циануровой кислоты, оставшемуся после извлечения биурета, добавляют 2-3 капли раствора аммиака и одну каплю раствора медного купороса — образуется сиреневого цвета осадок комплексной медной соли циануровой кислоты. [c.253]
Определение белков. Для определения белков или полипептидов применяется так называемая биуретовая реакция, т. е. взаимодействие с солями меди в щелочной среде, приводящее к образованию растворимых продуктов фиолетового цвета. Из простейших соединений такую реакцию дает биурет, откуда и возникло название этой реакции [228—231] [c.287]
В щелочной среде в присутствии солей меди белки дают фиолетовое окрашивание. Окраску дает комплексное соединение меди с пептидными группами —СО—ЫН—. Биуретовая реакция получается также с продуктами неполного гидролиза белка — пептонами и полипептидами. [c.9]
Продукты распада белка — пептоны и полипептиды — дают биуретовую реакцию с красным оттенком Ч [c.10]
Простейшие полипептиды — кристаллические вещества, растворимые в воде и почти не растворимые в спирте. Они дают биуретовую реакцию. Полипептиды, как и белки, играют важную роль в процессах жизнедеятельности и являются продуктами частичного гидролиза белков. [c.299]
Простейшие полипептиды — кристаллические вещества, растворимые в воде и почти не растворимые в спирте. Они дают биуретовую реакцию. Полипептиды, как и белки, играют важную [c.340]
Подобно белкам, сложные полипептиды дают с водой коллоидные растворы они способны при некоторых условиях свертываться и выпадать в осадок, давать биуретовую реакцию и ряд других цветных реакций, характерных для белков. Некоторые синтетические полипептиды оказались тождественными полипептидам, полученным при неполном гидролизе белковых веществ. Так, синтетические полипептиды расщепляются на отдельные аминокислоты при действии пищеварительных ферментов кишечного сока. Ферменты же отличаются специфичностью действия. Достаточно незначительного изменения в структуре соединения, чтобы оно стало недоступным действию фермента. Расщепление синтетических полипептидов на [c.39]
Полипептиды и белки дают биуретовую реакцию (стр. 700). Для белков характерна фиолетовая окраска образующихся медных комплексов, для пептонов— красная. Полипептиды дают окраски от синей до фиолетовой (стр. 686). [c.706]
В сильно щелочном растворе при добавлении соли меди такие ве
www.chem21.info
Биуретовая реакция на обнаружение пептидных связей — Студопедия.Нет
в белках
Принцип реакции: белки (полипептиды) в щелочном растворе в присутствии сульфата меди (II) образуют комплексные соединения меди, окрашенные в сине-фиолетовый цвет, интенсивность которого зависит от количества пептидных связей в молекуле белка.
Первоначально пептидные группы полипептида претерпевают в щелочной среде енолизацию:
Енольная форма полипептида взаимодействует с гидроксидом меди (II) и образует окрашенный в сине-фиолетовый цвет комплекс:
Продукты неполного гидролиза белка (пептиды) дают красное или розовое окрашивание в биуретовой реакции.
Материалы и реактивы: разбавленный 1%-ный раствор яичного белка, 10%-ный раствор гидроксида натрия (или калия), 1%-ный раствор сульфата меди.
Оборудование: стеклянные палочки, штатив с пробирками, пипетки, капельница.
Порядок выполнения работы: к 3 см3 раствора яичного белка добавляют 1 см3 раствора гидроксида натрия, 1…2 капли раствора сульфата меди, перемешивают.
Содержимое пробирки окрашивается в красно-фиолетовый цвет.
1.2.2.2 Цветные реакции с белками на обнаружение
карбоновых аминокислот
Принцип реакции: для обнаружения с помощью цветных реакций остатков карбоновых аминокислот, входящих в состав белков, используют характерные для этих аминокислот цветные реакции. Так, при выявлении α-аминокислот используют нингидриновую реакцию (см. п. 1.2.1.1), цистеина и цистина – реакцию Фоля (см. п. 1.2.1.2).
Материалы и реактивы: раствор яичного белка (1%-ный ), 1%-ный раствор нингидрина в 95 %-ном растворе ацетона, реактив Фоля.
Оборудование: стеклянные палочки, пробирки, штатив для пробирок, пипетки градуировочные, водяная баня, термометр лабораторный, часы.
Порядок проведения работы.
Нингидриновая реакция. К 1 см3 раствора яичного белка (исследуемого продукта) добавляют 3 капли раствора нингидрина. Смесь перемешивают и ставят на водяную баню при температуре 70 °С на 5 мин. Наблюдают образование сине-фиолетового окрашивания, свидетельствующего о присутствии в молекуле белка остатков
α-аминокислот.
Реакция Фоля. К 3 см3 раствора яичного белка добавляют 3 см3 реактива Фоля и после перемешивания кипятят на водяной бане в течение 2 мин. После остывания наблюдают образование бурого или чёрного осадка, свидетельствующего о наличии в молекуле белка остатков цистеина и цистина.
1.2.2.3 Цветные реакции с белками на обнаружение
циклических аминокислот
Ксантопротеиновая реакция. Принцип реакции: для обнаружения циклических аминокислот в составе молекулы белка с помощью цветных реакций используют характерные для этих аминокислот реакции. При выявлении остатков ароматических аминокислот используют ксантопротеиновую реакцию.
Материалы и реактивы: раствор яичного белка (1%-ный ), концентрированная азотная кислота, 10%-ный раствор гидроксида натрия.
Оборудование: стеклянные палочки, пробирки со штативом, пипетки градуировочные, капельницы, водяная баня, термометр лабораторный, часы, горелка.
Порядок проведения работы: к 1 см3 раствора яичного белка (исследуемого вещества) добавляют 3 капли раствора нингидрина. Смесь перемешивают и ставят на водяную баню при температуре 70 °С на 5 минут. Развивается сине-фиолетовое окрашивание.
studopedia.net
Биуретовая реакция — Справочник химика 21
БИУРЕТОВАЯ РЕАКЦИЯ — цветная реакция, которую дают с солями меди в щелочной среде биурет h3N ONH ONh3, амиды и имиды кислот, полипептиды, белки и другие соединения, содержащие группировки —СО—NH—, Б. р. — цветная реакция на белок — лежит в основе его количественного колориметрического определения. Если к щелочному раствору белка прибавить раствор uSO , появляется фиолетовое окрашивание. Чувствитель-1юсть Б. р. невысока. [c.45]БИУРЕТОВАЯ РЕАКЦИЯ, цветная р-ция на биурет, к-рую осуществляют, прибавляя к щелочному р-ру последнего разб. водный р-р соли Си (обычно СиЗО ), При этом р-р окрашивается в интенсивный фиолетовый цвет благодаря образованию комплексного соед. (ф-ла I, М -катион ще- [c.295]
Биуретовая реакция — одна из цветных реакций на белок и полипептиды. [c.99]
Белки относятся к высокомолекулярным соединениям. Молекулярная масса их 20 000 и даже 15 000 000 у. е. Они растворяются в воде, образуя коллоидные растворы (вследствие огромных размеров молекул). Белки устойчивы лишь в определенных условиях. При повышении температуры происходит необратимая коагуляция белков, а под действием электролитов — обратимая. Первая характерная для белков реакция ксантопротеиновая—реакция с азотной кислотой. Под действием азотной кислоты белок свертывается, образуя сгусток оранжевого цвета. Вторая характерная реакция на белки — это биуретовая реакция — фиолетовое окрашивание белка при взаимодействии его с гидроксидом меди. [c.371]
Цветные реакции белков. Биуретовая реакция. При взаимодействии в щелочной среде с солями меди (Си504) все белки дают фиолетовое окрашивание. Аналогичную реакцию дает уже упомянутый ранее биурет (стр. 215), откуда и происходит название этой реакции [c.296]
Раствор белка Раствор гидроксида калия раствор сульфата меди Окраска красно-фиолетовая (биуретовая реакция) [c.241]
Продукты распада белка — полипептиды — также дают биурето-вую реакцию. Цвет образующихся медных комплексов определяется числом аминокислот, связанных пептидной связью. Дипептиды дают синюю окраску, трипептиды — фиолетовую, а тетрапептиды и более сложные пептиды — красную. Фиолетовый цвет медного комплекса с белком в условиях проведения биуретовой реакции указывает на преобладание в сложной белковой частице трипептидных группировок (это подтверждается и другими данными). [c.120]
Биуретовая реакция на белки. В пробирку с 1 мл 10%-ного раствора яичного альбумина вливают 1 мл 10″6-ного раствора едкого натра и 2 капли 2%-ного раствора медного купороса. Появляется красно-фиолетовое окрашивание, указывающее на наличие в белковой молекуле пептидных связей —СО—КН—. [c.120]
В чем заключается сущность биуретовой реакции на белках [c.394]
Вулканическая деятельность во всех ее проявлениях играла в этом отношении выдающуюся роль. Обогащая обширные зоны поверхности, в том числе и те, которые граничили с водоемами, соединениями металлов, вулканы способствовали развитию каталитических реакций. Вещества, выбрасываемые во время извержений, получаются в активном состоянии это, например, оксид кремния (IV) в форме высокопористой массы —пемзы, образующейся при застывании кислых лав (ее пористость достигает 80%) и др. Другой важной породой, которая могла функционировать и как адсорбент, фиксирующий на своей поверхности разнообразные частицы, и как катализатор, является глина. Глины относят к числу древнейших пород. Глинистые минералы (например, монтмориллонит) имеют пластинчатое строение силикатные слои, максимальное расстояние между которыми равно приблизительно 1,4 нм, разделены слоями молекул воды толщина этих слоев может изменяться в широких пределах. Глины обратимо связывают катионы и таким образом могут служить в качестве регулятора солевого состава окружающей водной среды. Скопление органических веществ на поверхности глинистых минералов, возможно, сыграло решающую роль в появлении предбиологических структур и возникновении жизни (Д. Бернал). По Акабори, из формальдегида, аммиака и циановодорода в абиогенную эру образовался амино-ацетонитрил, который подвергался гидролизу и полимеризации на поверхности глин, образуя вещества, близкие к белкам. Акабори показал, что нагревание аминоацетонитрила с кислой глиной ведет к появлению продукта, дающего биуретовую реакцию (реакция на белок). Твердые карбонаты, которые входят в большом количестве в состав земной коры, вероятно, катализировали процесс образования углеводов. Гидроксид кальция также может служить катализатором в таких процессах. Исходным веществом для синтеза углеводов служит формальдегид. Прямым опытом доказано (Г. Эйлер и А. Эйлер), что гликолевый альдегид и пентозы получаются из формальдегида в присутствии карбоната кальция. Схему образования углеводов из простейших соединений предложил М. Кальвин. [c.377]
Биуретовая реакция — образование фиолетового окрашивания при действии на белок щелочи и нескольких капель медного купороса. Биуретовую реакцию дает также мочевина (стр. 416). [c.422]
Еще в 1888 г. А. Я- Данилевский высказал гипотезу о том, что различные а-аминокислоты, образуя белки, соединяются за счет аминогрупп и карбоксильных групп при помощи группировки —СО—НН—, впоследствии названной пептидной связью. Наличие пептидных связей в белках доказано многими фактами. В первую очередь оно подтверждается присутствием в продуктах гидролиза белков полипептидов — веществ, содержащих пептидные связи. Белки, как и полипептиды, дают так называемую биуретовую реакцию, характерную для соединений с пептидными связями (стр. 296). [c.290]
Биуретовая реакция является не только качественной, но и количественной. Она позволяет следить за ходом гидролиза белков и устанавливать содержание пептидов в смесях с различной длиной цепи. Значительный вклад в изучение биуретовой реакции и способов ее использования для определения строения белков внесли Н. И. Гаврилов,. М. И. Плехан и К- Т. Порошин. [c.504]
Вскоре вьщеление пузырьков аммиака прекращается и реакционная масса затвердевает при продолжающемся нагревании вследствие образования новых веществ — биурета и циануровой кислоты. Для разделения этих веществ можно воспользоваться различной растворимостью их в воде. Охладив пробирку, добавьте в нее 5—6 капель воды (1) и прокипятите в течение 2—3 мин. При этом более легко растворимый биурет перейдет в раствор. Дайте отстояться трудно растворимому осадку циануровой кислоты. Слейте осторожно раствор биурета в другую пробирку и добавьте к нему 2 капли 2 н. NaOH (2). При этом незначительная муть от следов
www.chem21.info

