Конформации н-бутана
Для насыщенных углеводородов характерна структурная изомерия, связанная с разветвлением их углеродной цепи. Структурные изомеры отличаются между собой только порядком размещения атомов углерода в молекуле.
Структурная изомерия насыщенных углеводородов начинается с бутана. Бутан существует в виде двух, пентан — в виде трех изомеров:
Гексан имеет пять структурных изомеров, гептан — девять, октан — $18$ нонан — $35$, декан — $75$ и т. д. Чем больше в молекуле насыщенного углеводорода атомов углерода, тем больше изомеров он образует. Для углеводорода $C_{13}H_{28}$ возможно $802$ изомеров, для $C_{14}H_{30}$ — уже $1858$ изомеров, для $C_{15}H_{32} — 4347$, для $C_{20}H_{42}$ возможные $366319$ изомеров и т. д.
Конформационная изомерия бутана
Молекулу бутана удобно рассматривать как дизамещенный этан. В зависимости от угла поворота заместителей вокруг связи $C2-C3$ различают четыре характеристические конформации:
- полностью заслоненная (син-планарная) — связи $C-H$ и $C-C$ расположены одна за другой, торсионный угол $\varphi = 0^\circ$;
- скошенная (гош- или син-клинальная) — торсионный угол $\varphi = 60^\circ$
- частично в заслоненная (анти-клинальная) — отличается от полностью заслоненной конформации тем, что $C-C$-связи не совпадают, торсионный угол $\varphi -120^\circ$;
- заторможеная (анти-планарная) — торсионный угол $\varphi = 180^\circ$:
Рисунок 1.
Максимальную потенциальную энергию имеет син-планарная конформация, для которой наряду с торсионным напряжением существует и вандерваальсовы напряжение, возникающее в результате отталкивания групп, в этом случае метильных, которые смещены на расстояние, меньше суммы их вандерваальсовы радиусов.
Минимальная внутренняя энергия характерна для анти-планарной конформации, которая не имеет торсионных напряжений. Барьер ротации для молекулы бутана составляет $26$ кДж / моль, вследствие чего при комнатной температуре заслоненные конформации не возникают, а $69\%$ молекул этого вещества находятся в самой стабильной заторможенной анти-конформации и $31\%$ — в гош-конформации (рис. 2).
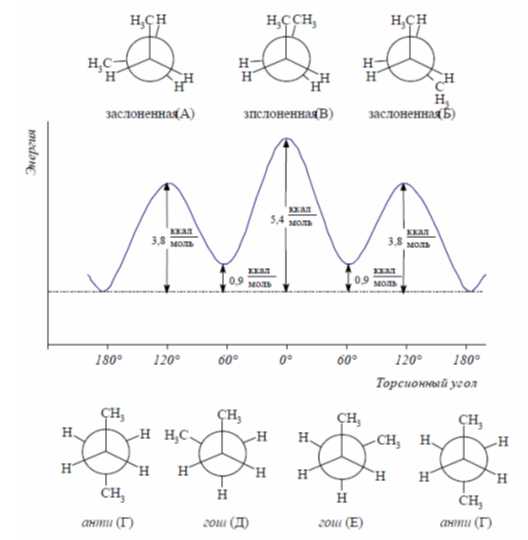
Рисунок 2. Зависимость потенциальной энергии н-бутана от угла $\varphi$
Составы конформационных смесей насыщенных углеводородов
Точные составы конформационных смесей определяются разностями свободных энергий конформаций $\triangle G^\circ$(конф.) с помощью уравнения Гиббса. В табл. 1 указаны расчетные значения энергии взаимодействий различных групп в насыщенных углеводородах.
Рисунок 3. Расчетные значения энергии взаимодействий различных групп в насыщенных углеводородах
Характерными особенностями конформаций разветвленных насыщенных углеводородов является обязательное наличие скошенного (гош-бутанового) взаимодействия электронных оболочек метильных или других алкильных заместителей и атомов водорода основных углеродных цепей. Так моно-метилзамещенные алканы в наиболее стабильных конформационных формах имеют одно или два гош-взаимодействия. В 2-метилзамещенных углеводородах наблюдается лишь одно гош-взаимодействие. В 3-метил-, 4-метил- и более замещенных алканов в наиболее стабильных из гош-конформаций наблюдается два гош-взаимодействия метильных групп и атомов водорода основных углеродных цепей.
Энергия конформационых форм
Для оценки энергий конформационых форм разветвленных углеводородов пользуются принципом аддитивности энергий взаимодействий групп $H-H$, $H-CH_3$ и $CH_3-CH_3$, которые приведенны в табл. 1. В качестве примера на рисунке 4 приведены зависимости потенциальных энергий различных конформационных форм 2-метилбутана от торсионного угла поворота вокруг центральной углерод-углеродной связи.
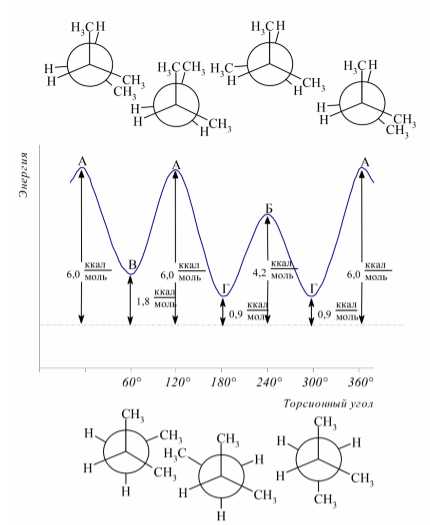
Рисунок 4.
Различия в энергиях между заслоненной конформацией и гош-конформером 2-метилбутана соответствуют принципу аддитивности энергии взаимодействий атомов и групп.
Подобный подход оказывается верным и при оценке стабильности других разветвленных алканов. Так, например, из двух гош-конформацонных форм 2,3-диметилбутана наиболее стабильной оказывается та, где имеются два гош-взаимодействия метильных групп:
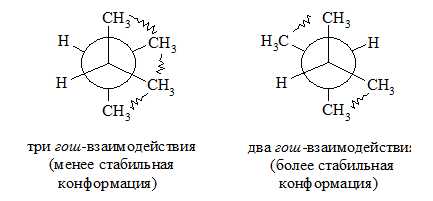
Рисунок 5.
spravochnick.ru
Конформации этана и пропана
Для насыщенных углеводородов характерна поворотная изомерия. Простая $\sigma $-связь не создает препятствий для вращения атомных группировок, которые окружают ее. Поэтому, например, в молекуле этана внутреннее вращение одной группы $-CH_3$ относительно второй не должно вызывать деформации $\sigma $- связи $C-C$ и может быть свободным. Опыты показывают, что при комнатной температуре это вращательное движение тормозится. Причиной торможения является взаимодействие не соединенных между собой атомов водорода в двух $CH_3$- группах, приводит к отталкиванию между этими атомами. Такой заторможен вращательное движение в молекулах этана и других углеводородов и их замещенных приводит к появлению поворотных изомеров.
Конформация
При вращении одной метательного группы в молекуле этана относительно второй вокруг углерод-углеродной связи атомы этих групп могут занимать в пространстве много различных взаимных положений. Это легко проследить на модели молекулы этана. Такие структуры молекулы характерны веществам с различным взаимным расположением атомов в пространстве. Они возникают при вращении вокруг простой углерод-углеродной связи, в отношении которой определяется положение атомов в пространстве. Это и называют конформациями (от лат. conformic — подобный), или поворотными изомерами (конформерами).
Конформации этана
Из большого количества конформаций этана можно выделить две крайние. Если вращать в пространстве одну $CH_3$-группу относительно второй и смотреть на модель этана вдоль $C-C$-связи, то можно заметить, что при одной из крайних конформаций атомы водорода одной $CH_3$-группы будут «заслонять», «затенять» атомы водорода второй $CH_3$-группы. Такую конформацию называют заслоненной, или затененной. При второй крайней конформации атомы водорода одной СН3-группы размещены в промежутках между атомами водорода второй $CH_3$-группы. Такую конформацию называют заторможенной (рис. 1).
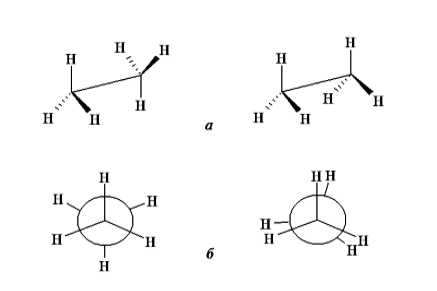
Рисунок 1. Перспективные формулы (а) и проекции Ньюмена (б) для заторможенной и заслоненной конформации этана
Для более наглядного изображения конформаций часто пользуются другой проекцией, где в центре, на пересечении трех прямых, находится атом углерода близкой к нам метательного группы. Связи $C-H$ второй метильной группы размещены по площади круга (на рис. 1 показаны штриховыми линиями). Такой способ изображения конформаций получил название формул Ньюмена.
Замечание 1
Конформеры, изображены на рис. 1 отличаются друг от друга взаимным поворотом в пространстве $C-H$-связей одной метильной группы и $C-H$-связей второй метильной группы относительно связи $C-C$. Это взаимное их размещения в пространстве характеризует углом поворота $\varphi $.
Устойчивость конформаций
От обычных изомеров конформеры отличаются тем, что их, как правило, нельзя выделить в индивидуальном состоянии. Атомы в молекуле находятся в непрерывном движении и одна конформация легко переходит в другую. Конформации, которые возникают при свободном вращении вокруг $\sigma $-связей, имеют разную устойчивость. Как правило, молекула пытается приобрести такую конформацию, при которой ее потенциальная энергия была бы минимальной. Более энергетически выгодная, а потому и более устойчивая — заторможенная конформация, поскольку в ней атомы водорода одной метильной группы находятся на расстоянии от атомов водорода второй метильной группы, и поэтому взаимное отталкивание между ними будет минимальным. Запас внутренней энергии такой молекулы уменьшается. В связи с этим при таких положениях водородных атомов внутреннее вращение вокруг $C-C$-связи в какой-то степени тормозится. Отсюда и название конформации — заторможенная. Для перехода молекулы с заторможенной конформации в затененную необходимо затратить $12,6$ кДж / моль энергии.
Для этана переходы из заторможенной в заслоненную конформацию достигаются поворотом на $60^\circ$ относительно двух связей $C — H$:
Рисунок 2.
Такой незначительный энергетический барьер, находится на уровне энергии теплового движения молекулы, не позволяет выделить отдельные поворотные изомеры, но существование их может быть зафиксировано некоторыми физическими методами, например, электронографическими, спектроскопическими и другими.
Конформации 1,2-дихлорэтана
При увеличении количества углеродных атомов в цепи возрастает количество возможных конформаций. Так, для бутана их уже шесть. Дизамещенные этана, например, 1,2-дихлорэтан, имеют конформаций больше, чем этан: транс-конформацию, две скошенные конформации и затененные конформации (рис. 3).
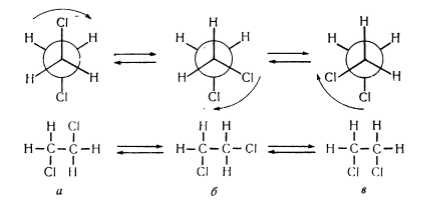
Рисунок 3. Конформации 1,2-ди-хлорэтана: а — транс-конформация; б, в — гош-конформации
В транс-конфорформации атомы хлора размещены в пространстве по разные стороны $C-C$-связи и отделены друг от друга (лат. trans — по ту сторону). Поэтому транс-конформация для дихлорэтана является энергетически выгодной и наиболее устойчивой. В скошенных конформациях атомы хлора расположены в пространстве ближе, чем в транс конформациях. Скошенные конформации, в которых двугранный угол между отдельными заместителями равен $60^\circ$, называют гош-конформациями (от старого французского слова, означающего «скручивание»), гош-конформации дихлорэтана менее устойчивы, чем его транс-конформации. Энергия молекулы дихлорэтана в гош-конформации больше от энергии гош-конформации на $5,9$ кДж / моль. Максимальную энергию его молекулы наблюдают в затененных конформациях (рис. 4).
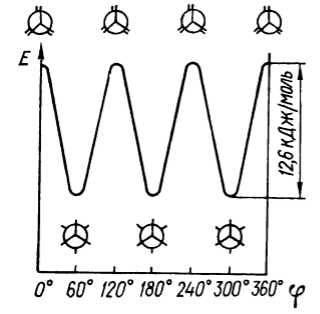
Рисунок 4. График зависимости потенциальной энергии Е от угла вращения $\varphi $ в молекуле этана
Конформеры дихлорэтана отличаются дипольными моментами. Так, транс-конформер неполярный, а гош-конформеры — полярные. В результате 1,2-дихлорэтан имеет средний дипольный момент ($1,27 \ D$ при $25^\circ \ C$) .При повышении температуры количество менее устойчивых гош-конформаций увеличивается и дипольный момент дихлорэтана повышается. При $315^\circ \ C$ он уже составляет $1,57 \ D$.
Конформации пропана
Для следующего гомолога, пропана, также имеется торсионное напряжение, возникающее в результате отталкивания двух пар атомов водорода (аналогично этану) и одного дополнительного взаимодействия между связями $C-H$ и $C-CH_3$ в заслоненной конформации:
Рисунок 5.
Барьер вращения для пропана несколько выше, чем для этана, и составляет $3,4$ ккал / моль. Так как энергия каждого взаимодействия пары атомов водорода в заслоненной конформации составляет $1$ ккал / моль, энергия взаимодействия метильной группы и атома водорода в заслоненной конформации пропана и следующих гомологов алканов может быть оценена в $1,4$ ккал/моль.
spravochnick.ru
Потенциальная энергия конформаций н-бутана — Мегаобучалка
[1] С. 50–85, [2] С. 8–13, [3] С. 3–44.
Наука, изучающая пространственное строение органических соединений называется стереохимией.
Различное химическое строение лежит в основе такого явления как изомерия. Изомерами называются соединения, имеющие одинаковый состав, но отличающиеся последовательностью соединения атомов в молекуле.
Изомерия подразделяется:
1) на структурную;
2) пространственную (стереоизомерию).
Стереоизомеры — это изомеры, отличающихся расположением атомов в пространстве.
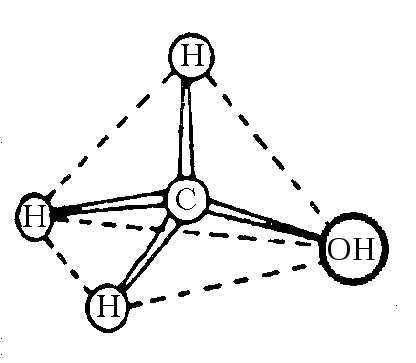
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ SP3-ГИБРИДИЗОВАННОГО АТОМА УГЛЕРОДА. ПОНЯТИЕ О КОНФИГУРАЦИИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Конфигурация— это определенное пространственное расположение атомов в молекуле без учета различий, возникающих за счет вращения вокруг одинарных связей.
Основы стереоизомерии заложены Вант-Гоффом, который в 1874 году сформулировал идею о том, что атом углерода в sp 3-гибридизованном состоянии имеет тетраэдрическую конфигурацию, т. е. располагается в центре воображаемого тетраэдра, а четыре его заместителя находятся в вершинах тетраэдра.
При sp3-гибридизации происходит смешивание одной s и трех p орбиталей атома
углерода, и образуются 4 одинаковые sp3-гибридизованные орбитали, имеющие форму
несимметричной объемной восьмерки. Четыре одинаковые sp3-гибридизованные орбитали относительно ядра атома углерода будут располагаться на максимальном удалении друг
от друга, так что их оси симметрии направлены к вершинам правильного тетраэдра под углом 109,5º друг к другу.
Таким образом, атом углерода в sp3-гибридизации имеет тетраэдрическую (тетрагональную) конфигурацию. В sp3-гибридизованном состоянии атом углерода находится в молекулах алканов, циклоалканов, насыщенных алифатических радикалах других соединений и способен образовывать s-связи. s-Связи образуются при перекрывании двух
а также двух гибридизованных орбиталей.
Так, в молекуле метана 4 sp3-гибридизованные орбитали атома углерода перекрываются с четырьмя s-орбиталями атомов водорода, образуя s-связи. Поскольку sp3-гибри-дизированные орбитали атома углерода располагаются тетраэдрически, то и образующиеся четыре s-связи также будут располагаться тетраэдрически. Пространственное расположение s-связей, как правило, отражает пространственную структуру молекулы. Следовательно,
молекула метана будет иметь тетраэдрическую конфигурацию. Расстояние между атомами углерода и водорода, связанными s-связью, равно 0,109 нм, энергия связи С–Н равна
414 кДж/моль.
Для изображения на плоскости тетраэдрической конфигурации атома углерода используются стереохимические формулы. Для их изображения тетраэдрическую модель ориентируют так, чтобы атом углерода и две его связи находились в плоскости, тогда третья связь будет направлена вперед от плоскости проекции, а четвертая — за плоскость проекции. Связь, направленную вперед, изображают сплошным клином, основанием, направленным
| CH3OHметанол тетраэдрическая конфигурация атома углерода |
КОНФИГУРАЦИЯ И КОНФОРМАЦИИ ЭТАНА.
ПРОЕКЦИОННЫЕ ФОРМУЛЫ НЬЮМЕНА
В молекуле этана наряду с s-связями С–Н имеется и s-связь С–С, образованная перекрыванием двух sp3-гибридизованных орбиталей атомов углерода. Эта s-связь имеет длину 0,154 нм и энергию 348 кДж/моль. Вокруг s-связи возможно вращение, при вращении вокруг связи С–С будут возникать различные пространственные формы молекулы, называемые
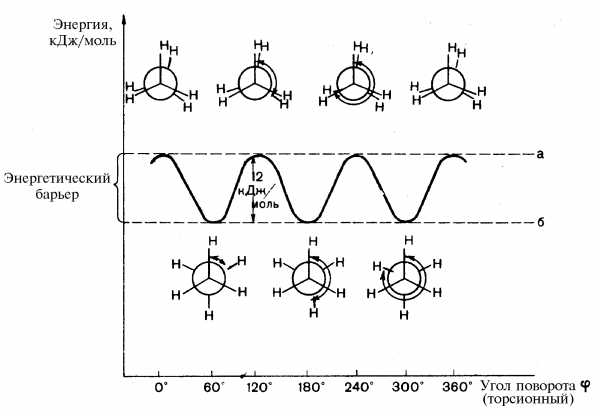
Взаимные переходы конформаций осуществляются без разрыва s-связей. Угол поворота по s-связи называется торсионнымиобозначается j. За минимальный отсчет торсионного угла принимают 60º, следовательно из множества возникающих конформаций во внимание принимается только шесть. Относительно большой внутренней энергией обычно обладают конформации, в которых заместители находятся в наиболее близком расположении друг к другу. Такие конформации называются заслоненными. Конформации, в которых заместители наиболее удалены друг от друга в пространстве, обладают относительно меньшей внутренней энергией, называются заторможенными. Внутренняя энергия в заслоненной конформации этана на 12 кДж/моль выше, чем его энергия в заторможенной конформации. Эта величина энергии составляет энергетический барьер вращения, и его происхождение связано с взаимодействием противолежащих s-связей С–Н при их сближении в заслоненной конформации. Это увеличение энергии системы называют торсионным напряжением.
У более сложных соединений наряду с торсионным напряжением действует еще один фактор, затрудняющий свободное вращение, — ван-дер-ваальсово напряжение. Оно обусловлено силами отталкивания между валентно не связанными, большими по объему заместителями, находящихся на расстоянии меньше суммы их вандерваальсовых радиусов.
Для изображения конформаций используют проекционные формулы Ньюмена. Для этого молекулу располагают так, чтобы s-связь, относительно которой образуются конформации, располагалась перпендикулярно плоскости. Ближайший к наблюдателю атом углерода обозначают точкой и отходящими от нее тремя лучами, остальные s-связи этого атома углерода. Кругом обозначают удаленный атом углерода и «высовывающимися» из-за круга черточками — его s-связи.
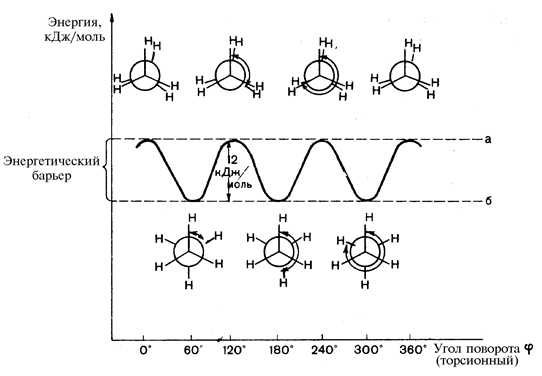
Потенциальная энергия конформаций этана:
а — конформации заслоненные; б — конформации заторможенные
КОНФОРМАЦИИ БУТАНА
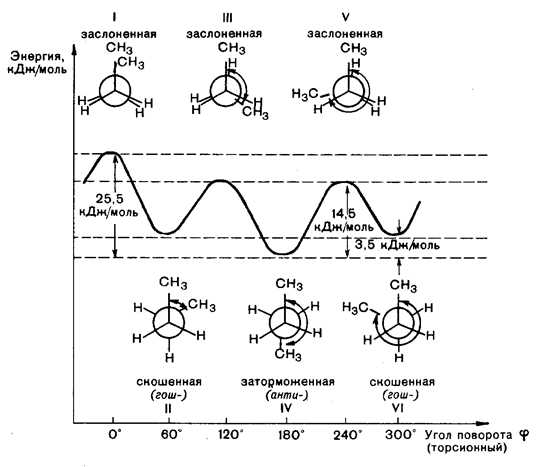
Рассмотрим конформации бутана, возникающие при вращении вокруг С2–С3 связи. Наиболее выгодной является заторможенная конформация IV, в которой угол между двумя СН3-группами составляет 180º. В конформациях III и V в заслоненном положении находятся СН3 и Н, в конформации I — две СН3 группы. Поэтому заслоненная конформация I обладает большей энергией. Конформации II и VI с углом 60º между двумя СН3-группами называются скошенными или гош-конформациями.
Энергия скошенных конформаций на 3,5 кДж/моль больше энергии заторможенной конформации. Это объясняется взаимодействием двух метильных групп, расположении их под углом 60º.
В отличие от других конформаций энергетически более выгодные конформации,
лежащие в точках минимума энергетической кривой, принято называть конформерами.
Разница в энергии конформеров бутана — заторможенного IV и скошенного II (или VI) — невелика. Поэтому они легко переходят друг в друга (в равновесии при обычных условиях находится 69 % молекул бутана в анти-конформации и 31 % в гош-конформации).
Потенциальная энергия конформаций н-бутана
КОНФОРМАЦИИ СОЕДИНЕНИЙ С ДЛИННОЙ УГЛЕРОДНОЙ ЦЕПЬЮ
В длинных углеродных цепях вращение возможно вокруг нескольких С–С связей.
Поэтому вся цепь может принимать разнообразные геометрические формы. Длинные цепи насыщенных углеводородов преимущественно находятся в «зигзагообразной» конформации, в которой атомы углерода в каждом бутановом фрагменте находятся по отношению друг
к другу в заторможенной конформации.
а б в г
Конформации открытой углеродной цепи:
а — клешневидная; б — нерегулярная; в — зигзагообразная; г — заторможенная конформация бутанового фрагмента
Например, длинноцепочечные ацильные остатки пальмитиновой С15Н31СООН и стеариновой С17Н35СООН кислот в зигзагообразной конформации входят в состав липидного бислоя клеточных мембран.
В клешневидной конформации сближаются в пространстве атомы углерода, удаленные друг от друга в «зигзагообразной» конформации. Такими сближенными оказываются, например, каждый первый и пятый или каждый первый и шестой атомы углеродной цепи. Между функциональными группами, находящимися у сближенных атомов углерода, может происходить взаимодействие, в результате которого образуются различные циклические
соединения.
КОНФОРМАЦИИ КАРБОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
В циклических соединениях, наряду с торсионным и ван-дер-ваальсовым напряжением, появляется специфический вид напряжения — угловое или байеровское напряжение
(по имени автора теории напряжения циклов А. Байера). Если бы циклы были плоскими, то
в них валентные углы значительно бы отклонялись от нормального, соответствующего
sp3-гибридизации (109,5º).
Напряжение, вызванное отклонением валентных углов между атомами углерода в цикле от нормального значения, называется угловым. Чем больше угол в цикле отклоняется от нормального валентного, тем выше угловое напряжение, тем цикл менее устойчив.
а б в
г
megaobuchalka.ru
Потенциальная энергия конформаций этана:
СТЕРЕОИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель: сформировать знания о единстве строения, конфигурации и конформации органических молекул как основы для понимания связи пространственного строения с биологической активностью.
Литература
[1] С. 50–85, [2] С. 8–13, [3] С. 3–44.
Наука, изучающая пространственное строение органических соединений называется стереохимией.
Различное химическое строение лежит в основе такого явления как изомерия. Изомерами называются соединения, имеющие одинаковый состав, но отличающиеся последовательностью соединения атомов в молекуле.
Изомерия подразделяется:
1) на структурную;
2) пространственную (стереоизомерию).
Стереоизомеры — это изомеры, отличающихся расположением атомов в пространстве.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ SP3-ГИБРИДИЗОВАННОГО АТОМА УГЛЕРОДА. ПОНЯТИЕ О КОНФИГУРАЦИИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Конфигурация — это определенное пространственное расположение атомов в молекуле без учета различий, возникающих за счет вращения вокруг одинарных связей.
Основы стереоизомерии заложены Вант-Гоффом, который в 1874 году сформулировал идею о том, что атом углерода в sp3-гибридизованном состоянии имеет тетраэдрическую конфигурацию, т. е. располагается в центре воображаемого тетраэдра, а четыре его заместителя находятся в вершинах тетраэдра.
При sp3-гибридизации происходит смешивание одной s и трех p орбиталей атома углерода, и образуются 4 одинаковые sp3-гибридизованные орбитали, имеющие форму несимметричной объемной восьмерки. Четыре одинаковые sp3-гибридизованные орбитали относительно ядра атома углерода будут располагаться на максимальном удалении друг от друга, так что их оси симметрии направлены к вершинам правильного тетраэдра под углом 109,5º друг к другу. Таким образом, атом углерода в sp3-гибридизации имеет тетраэдрическую (тетрагональную) конфигурацию. В sp3-гибридизованном состоянии атом углерода находится в молекулах алканов, циклоалканов, насыщенных алифатических радикалах других соединений и способен образовывать -связи. -Связи образуются при перекрывании двух s-орбиталей, s-орбитали и гибридизованной орбитали, а также двух гибридизованных орбиталей.

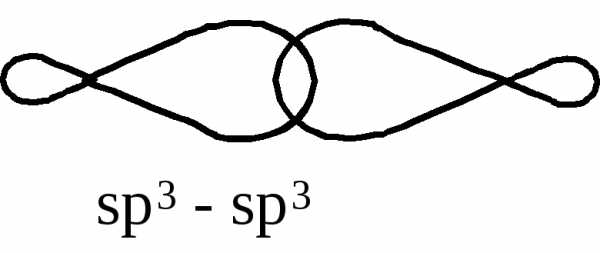
Так, в молекуле метана 4 sp3-гибридизованные орбитали атома углерода перекрываются с четырьмя s-орбиталями атомов водорода, образуя -связи. Поскольку sp3-гибри-дизированные орбитали атома углерода располагаются тетраэдрически, то и образующиеся четыре -связи также будут располагаться тетраэдрически. Пространственное расположение -связей, как правило, отражает пространственную структуру молекулы. Следовательно, молекула метана будет иметь тетраэдрическую конфигурацию. Расстояние между атомами углерода и водорода, связанными -связью, равно 0,109 нм, энергия связи С–Н равна 414 кДж/моль.
Для изображения на плоскости тетраэдрической конфигурации атома углерода используются стереохимические формулы. Для их изображения тетраэдрическую модель ориентируют так, чтобы атом углерода и две его связи находились в плоскости, тогда третья связь будет направлена вперед от плоскости проекции, а четвертая — за плоскость проекции. Связь, направленную вперед, изображают сплошным клином, основанием, направленным к наблюдателю; связь же, направленную за плоскость проекции, изображают заштрихованным клином.
CH3OH метанол тетраэдрическая конфигурация атома углерода |
КОНФИГУРАЦИЯ И КОНФОРМАЦИИ ЭТАНА. ПРОЕКЦИОННЫЕ ФОРМУЛЫ НЬЮМЕНА
В молекуле этана наряду с -связями С–Н имеется и -связь С–С, образованная перекрыванием двух sp3-гибридизованных орбиталей атомов углерода. Эта -связь имеет длину 0,154 нм и энергию 348 кДж/моль. Вокруг -связи возможно вращение, при вращении вокруг связи С–С будут возникать различные пространственные формы молекулы, называемые конформациями. Конформации различаются запасом внутренней энергии.
В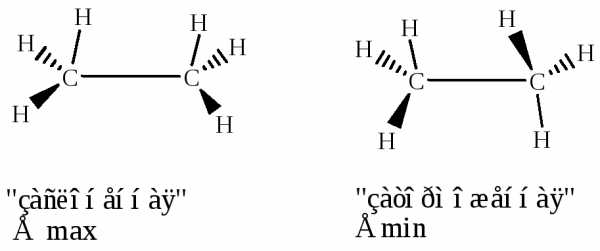 заимные
переходы конформаций осуществляются
без разрыва -связей.
Угол поворота по -связи
называется торсионным и обозначается
. За минимальный
отсчет торсионного угла принимают 60º,
следовательно из множества возникающих
конформаций во внимание принимается
только шесть. Относительно большой
внутренней энергией обычно обладают
конформации, в которых заместители
находятся в наиболее близком расположении
друг к другу. Такие конформации называются заслоненными. Конформации, в которых
заместители наиболее удалены друг от
друга в пространстве, обладают относительно
меньшей внутренней энергией, называются заторможенными. Внутренняя энергия
в заслоненной конформации этана на 12
кДж/моль выше, чем его энергия в
заторможенной конформации. Эта величина
энергии составляет энергетический
барьер вращения, и его происхождение
связано с взаимодействием противолежащих
-связей С–Н при их
сближении в заслоненной конформации.
Это увеличение энергии системы называют торсионным напряжением.
заимные
переходы конформаций осуществляются
без разрыва -связей.
Угол поворота по -связи
называется торсионным и обозначается
. За минимальный
отсчет торсионного угла принимают 60º,
следовательно из множества возникающих
конформаций во внимание принимается
только шесть. Относительно большой
внутренней энергией обычно обладают
конформации, в которых заместители
находятся в наиболее близком расположении
друг к другу. Такие конформации называются заслоненными. Конформации, в которых
заместители наиболее удалены друг от
друга в пространстве, обладают относительно
меньшей внутренней энергией, называются заторможенными. Внутренняя энергия
в заслоненной конформации этана на 12
кДж/моль выше, чем его энергия в
заторможенной конформации. Эта величина
энергии составляет энергетический
барьер вращения, и его происхождение
связано с взаимодействием противолежащих
-связей С–Н при их
сближении в заслоненной конформации.
Это увеличение энергии системы называют торсионным напряжением.
У более сложных соединений наряду с торсионным напряжением действует еще один фактор, затрудняющий свободное вращение, — ван-дер-ваальсово напряжение. Оно обусловлено силами отталкивания между валентно не связанными, большими по объему заместителями, находящихся на расстоянии меньше суммы их вандерваальсовых радиусов.
Для изображения конформаций используют проекционные формулы Ньюмена. Для этого молекулу располагают так, чтобы -связь, относительно которой образуются конформации, располагалась перпендикулярно плоскости. Ближайший к наблюдателю атом углерода обозначают точкой и отходящими от нее тремя лучами, остальные -связи этого атома углерода. Кругом обозначают удаленный атом углерода и «высовывающимися» из-за круга черточками — его -связи.
а — конформации заслоненные; б — конформации заторможенные
КОНФОРМАЦИИ БУТАНА
Р ассмотрим
конформации бутана, возникающие при
вращении вокруг С2–С3 связи.
Наиболее выгодной является заторможенная
конформация IV, в которой угол между
двумя СН3-группами составляет
180º. В конформациях III и V в заслоненном
положении находятся СН3 и Н, в
конформации I — две СН3 группы.
Поэтому заслоненная конформация I
обладает большей энергией. Конформации
II и VI с углом 60º между двумя СН3-группами
называются скошенными или
гош-конформациями.
ассмотрим
конформации бутана, возникающие при
вращении вокруг С2–С3 связи.
Наиболее выгодной является заторможенная
конформация IV, в которой угол между
двумя СН3-группами составляет
180º. В конформациях III и V в заслоненном
положении находятся СН3 и Н, в
конформации I — две СН3 группы.
Поэтому заслоненная конформация I
обладает большей энергией. Конформации
II и VI с углом 60º между двумя СН3-группами
называются скошенными или
гош-конформациями.
Энергия скошенных конформаций на 3,5 кДж/моль больше энергии заторможенной конформации. Это объясняется взаимодействием двух метильных групп, расположении их под углом 60º.
В отличие от других конформаций энергетически более выгодные конформации, лежащие в точках минимума энергетической кривой, принято называть конформерами. Разница в энергии конформеров бутана — заторможенного IV и скошенного II (или VI) — невелика. Поэтому они легко переходят друг в друга (в равновесии при обычных условиях находится 69 % молекул бутана в анти-конформации и 31 % в гош-конформации).
Частично частично Потенциальная энергия конформаций н-бутана
КОНФОРМАЦИИ СОЕДИНЕНИЙ С ДЛИННОЙ УГЛЕРОДНОЙ ЦЕПЬЮ
В длинных углеродных цепях вращение возможно вокруг нескольких С–С связей. Поэтому вся цепь может принимать разнообразные геометрические формы. Длинные цепи насыщенных углеводородов преимущественно находятся в «зигзагообразной» конформации, в которой атомы углерода в каждом бутановом фрагменте находятся по отношению друг к другу в заторможенной конформации.
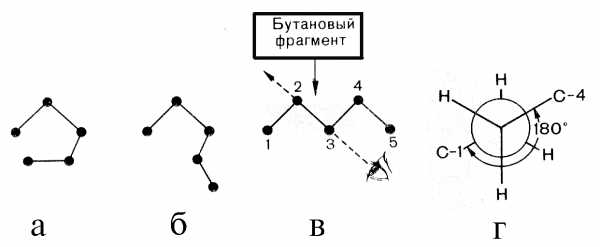
а б в г
Конформации открытой углеродной цепи:
а — клешневидная; б — нерегулярная; в — зигзагообразная; г — заторможенная конформация бутанового фрагмента
Например, длинноцепочечные ацильные остатки пальмитиновой С15Н31СООН и стеариновой С17Н35СООН кислот в зигзагообразной конформации входят в состав липидного бислоя клеточных мембран.
В клешневидной конформации сближаются в пространстве атомы углерода, удаленные друг от друга в «зигзагообразной» конформации. Такими сближенными оказываются, например, каждый первый и пятый или каждый первый и шестой атомы углеродной цепи. Между функциональными группами, находящимися у сближенных атомов углерода, может происходить взаимодействие, в результате которого образуются различные циклические соединения.
КОНФОРМАЦИИ КАРБОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
В циклических соединениях, наряду с торсионным и ван-дер-ваальсовым напряжением, появляется специфический вид напряжения — угловое или байеровское напряжение (по имени автора теории напряжения циклов А. Байера). Если бы циклы были плоскими, то в них валентные углы значительно бы отклонялись от нормального, соответствующего sp3-гибридизации (109,5º).
Напряжение, вызванное отклонением валентных углов между атомами углерода в цикле от нормального значения, называется угловым. Чем больше угол в цикле отклоняется от нормального валентного, тем выше угловое напряжение, тем цикл менее устойчив.
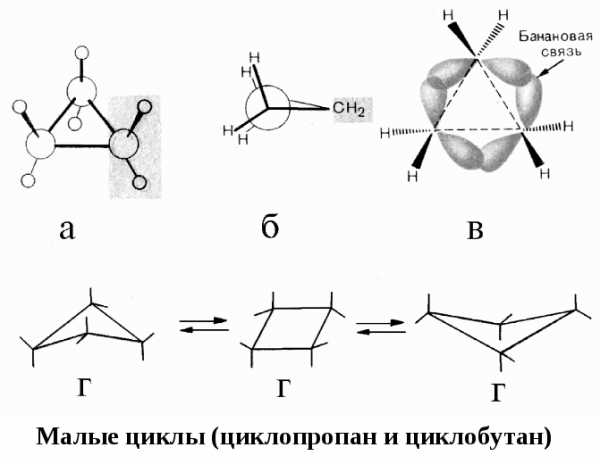
а б в
г
studfile.net
Бутан конформации — Справочник химика 21
То, что мы выяснили относительно конформаций молекулы этана, можно распространить и на конформации других соединений. Так, в бутане наиболее важные конформации получаются при вращении вокруг связи С(2)—С(з) из множества этих конформаций рассмотрим три. Первая, обозначаемая как анти [c.77]Конкретным примером соединения такого типа может служить бутан. Для него возможны две нечетные конформации с разным взаимным расположением групп СНз и соответственно с несколько различающейся энергией [c.72]
Барьер вращения в н-бутане немного выше, чем в этане тем не менее он достаточно низок для того, чтобы при обычных температурах легко и быстро происходило взаимопревращение конформеров. Существует равновесие, которое сдвинуто в сторону более устойчивого ан/лы-конформера содержание двух скошенных конформеров — зеркальных изомеров, имеющих одинаковую устойчивость, конечно, одинаково. Иначе говоря, любая молекула большую часть времени находится в ан/лы-конформации, а меньшую часть времени поровну находится в каждой из двух скошенных конформаций. Эти изомеры нельзя разделить вследствие их быстрого взаимопревращения. [c.99]
Несколько более сложный по сравнению с этаном случай представляют 1,2-дизамещенные этапы (УСНа—СНгУ или УСНа—СНгХ) [144]. Например, н-бутан имеет четыре крайние конформации полностью заторможенную, называемую анти-, или анти-перипланарной, конформацией (62), еще одну заторможенную, называемую гош-, или син-клинальной, конформа-цией (64), и две заслоненные конформации син-перипланарную (65) и анти-клинальную (63). Диаграмма потенциальной энер- [c.178]
Циклопентан. В плоском регулярно построенном циклопентане угол ССС составляет 108°, отклоняясь от нормального тетраэдрического угла всего на 1,5°. Однако для циклопентана, экспериментальная теплота образования которого достаточно хорошо согласуется со значениями, рассчитанными по схемам EAS 33 ММ1 [34] и ММ2 [76], значение ЭНЕК равно 30,1 кДж/моль. Такая энергия напряжения, очевидно, не может быть обусловлена угловым напряжением. Однако в циклопентане, как и в циклобутане, имеются отталкивания между несвязанными С—С- и С—Н-фрагментами и, хотя разницу в энергии заторможенной и заслоненной форм для включения в цикл СНг—СНг группы определить невозможно, все же можно Оценить ее в 10—11 кДж/моль, исходя из энергии напряжения плоского циклопентана, если принять, что единственным источником напряжения является торсионное напряжение. Соответствующий барьер в этане равен 12 кДж/моль, а в пропане 14 кДж/моль отметим, что значения барьера для бутана (20 кДж/моль) нельзя использовать для расчета циклической молекулы, так как в бутане присутствуют скошенные взаимодействия. При переходе от плоской к неплоской конформации напряжение в циклопентане не устраняется, а только ослабевает. [c.117]
В бутанах при вращении вокруг центральной С—С-связи реализуются все эти конформации. В силу неравноценности последних такое вращение не будет свободным. Энергетические барьеры, которые будет необходимо при этом преодолеть, отражает график зависимости энергии молекулы бутана от двугранного угла Хд между плоскостями, в которых расположены центральные атомы углерода и каждая из метильных групп (рис. 1.1). [c.19]
Как видно из табл. Х,5 и Х,6, термодинамические характеристики адсорбции гош-поворотных изомеров этих молекул заметно отличаются от таковых для транс-изомера, причем это различие растет в ряду и-бутан, к-пентан и к-гексан. Значения К1, 1 и —АС/ , для гош-изомеров всегда меньше, чем для транс-изомера, который может расположиться на поверхности плоско, т. е. энергетически наиболее выгодным образом. Термодинамические характеристики адсорбции для всех гош-изомеров сравнительно близки. Мольные доли транс-поворотных изомеров в адсорбированном состоянии значительно больше, чем в объеме газа, причем с понижением температуры они увеличиваются. Однако даже при самых низких рассмотренных температурах в адсорбированном состоянии еще содержится значительная доля молекул в гош-конформациях. [c.318]
В отличие от этана и пропана не все заторможенные конформации н-бутана эквивалентны и не все заслоненные конформации одинаковы. Распределение конформаций в н-бутане показано ниже (взаимные превращения осуществляются в направлении, указанном изогнутой стрелкой А, В и Д — заторможенные конформации, Б, Г и Е — заслоненные конформации) [c.78]
Основная особенность конформационных состояний насыщенных алифатических углеводородов заключена в наличии внешне свободного, но энергетически заторможенного вращения структурных фрагментов молекул вокруг ординарных С—С-связей. Физические причины этого торможения до сих нор окончательно не выяснены [6], хотя энергия этого торможения (т. е. количественная сторона данного явления) определена достаточно точно.. Одним из простейших соединений, на примере которого можно проиллюстрировать энергетическую разность различных конформационных состояний алифатических углеводородов, является н. бутан. На рис. 1 приведена энергетическая диаграмма различных конформаций бутана, возникающих при вращении одной из концевых метильных групп вокруг связи С-2—С-3. На том же рисунке приведены проекции Ньюмена для важнейших конформаций данной молекулы. Закономерности этой диаграммы весьма важны для понимания стереохимических особенностей конформационного состояния насыщенных алифатических углеводородов любого строения и молекулярного веса. Действительно, из рис. 1 хорошо видно, что два типа конформаций являются энергетически более устойчивыми состояниями, характерными для алифатических цепей вообще. [c.8]
Для простоты, мы считаем, что н.бутан существует только в трансоидной конформации, имеющей ось симметрии. В дальнейшем, для более высокомолекулярных алканов, основное конформационное состояние будет определяться главным образом скошенными формами, не имеющими, за редким исключением, осей симметрии. [c.71]
Таким образом, исходя из масс-спектров обычно можно построить достаточно разумную схему перемещения электронов в ионе при перегруппировке. Для перегруппировки обязательно нужно, чтобы атомы, образующие новую связь, находились достаточно близко друг от друга. Подходящая конформация обычно существует уже в исходной молекуле. Так, исходная молекула бутанала имеет следующую предпочтительную конформацию благодаря об- [c.15]
Упражнение 4-17. Определите степень искажения углов между связями С — С — С в бицикло-[1,1,0]-бутане в том случае, если молекула была бы плоской. Какую конформацию и химические свойства могли бы вы предсказать для это
www.chem21.info
Конформации ациклических углеводородов (этан, бутан); виды напряжений в молекуле; изображение конформаций; их энергетическая характеристика.
Конформация определяется как любое относительное положение атомных ядер в молекуле, при котором сохраняется ее целостность (т. е. конфигурация). Конформационные изомеры, или конформации, неотделимы друг от друга и сосуществуют в едином множестве геометрических форм, возникающих в результате перемещения ядер атомов в молекуле относительно друг друга. Одной из причин возникновения конформаций является вращение вокруг одинарных связей. Образующаяся в результате осевого перекрывания атомных орбиталей σ-связь симметрична относительно оси, проходящей через ядра связанных атомов, поэтому при повороте одного фрагмента относительно другого связь не нарушается:
Конформации имеют различное расположение атомов и атомных групп у двухатомного фрагмента. Важной характеристикой конформации является торсионный угол (φ) — диэдральный (двугранный) угол, образованный плоскостями, в которых лежат связи соседних атомов четырехатомного фрагмента:
Конформации ациклических соединений. Этан — одна из простейших молекул, для которой возможно существование конформаиий. В результате полного оборота, совершаемого одной метальной группой относительно другой, возникает бесконечное множество конформаций, шесть из них с торсионными углами, кратными 60°, — три заслоненных и три заторможенных — соответствуют максимумам и минимумам на энергетической кривой. Скорость вращения оценивается величиной 106 оборотов в секунду при 20 оС.
Заслоненные и заторможенные конформации отличаются уровнем потенциальной энергии. Заслоненные конформации этана неустойчивы, причиной этого является отталкивание электронных оболочек противостоящих связей, называемое торсионным напряжением. Торсионным напряжением объясняется неустойчивость отдельных конформаций более сложных молекул.
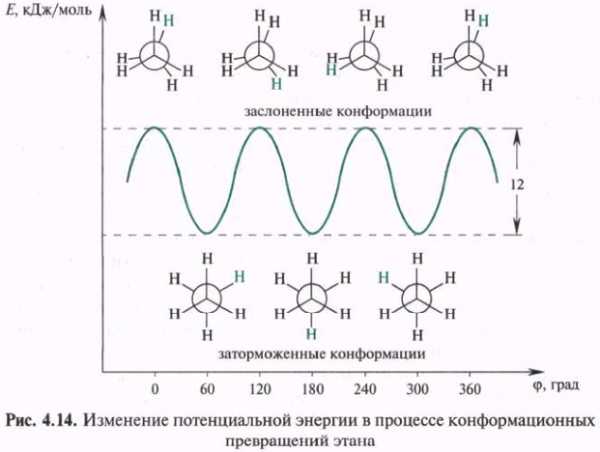
Конформации, имеющие одинаковый запас потенциальной энергии, называются вырожденными. В случае этана вырожденными являются все заслоненные и все заторможенные конформации, возникающие в процессе полного поворота одной метильной группы относительно другой. Разность потенциальных энергий двух крайних конформаций называется барьером вращения. Для этана барьер вращения имеет сравнительно небольшое значение.
В молекуле бутана при повороте вокруг связи С-2—С-3 возникает большее по сравнению с этаном число различающихся по энергии конформаций, что связано с различным взаимным расположением метильных групп. В наиболее энергетически выгодной антиперипланарной конформации метильные группы максимально удалены друг от друга. Наименее устойчива синперипланарная конформация, в ней кроме упоминавшегося ранее торсионного напряжения имеется взаимное отталкивание сближенных в пространстве метильных групп — Ван-дер-ваальсово напряжение. В синклинальной (скошенной, или гош-) конформации отсутствует торсионное напряжение, но сохраняется ван-дер-ваальсово напряжение. В антиклинальной конформации сохраняется торсионное напряжение, но отсутствует ван-дер-ваальсово. Барьер вращения для бутана составляет 25,5 кДж/моль.
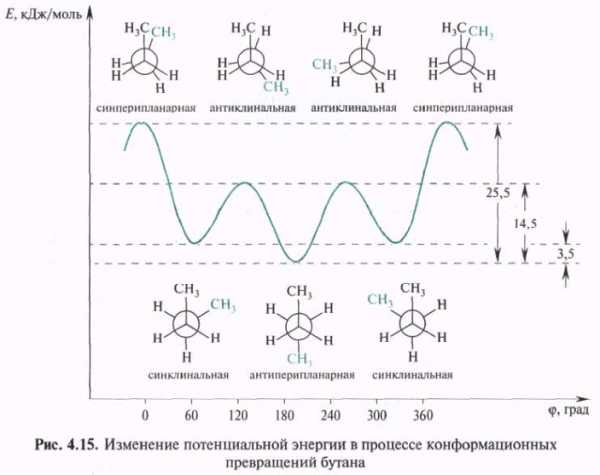
Отдельные, относительно устойчивые конформации называются конформерами. Например, для бутана таковыми являются антиперипланарная и синклинальные конформации. Конформерам соответствуют минимумы на энергетических кривых. Заслоненные конформации можно рассматривать как переходное состояние между относительно устойчивыми конформерами. Большую часть времени молекулы существуют в виде устойчивых заторможенных конформеров. Так, у бутана 69% молекул существуют в виде энергетически самой выгодной антиперипланарной конформации и 31%— в виде синклинальной (скошенной) конформации. Соотношение конформеров зависит от характера группировок, соединенных с фрагментом — СН2—СН2—. Например, у 1,2-дибромоэтана оно составляет 89% (антиперипланарная конформация) и 11% (синклинальная). В кристаллическом состоянии молекулы, как правило, находятся в какой-либо одной конформации.
Молекулы с длинными углеродными цепями принимают сложные конформации, которые можно рассматривать как сочетание конформаций простых двухуглеродных фрагментов. Термодинамически наиболее выгодны зигзагообразные конформации, в которых отсутствует как торсионное, так и ван-дер-ваальсово напряжение.
В зигзагообразных конформациях все объемные группировки атомов занимают друг относительно друга антиперипланарное положение, в такой конформации все связи С—С длинной углеродной цепи располагаются в одной плоскости. Например, молекулы высших жирных кислот в твердом состоянии и в жидкокристаллических структурах существуют в форме зигзагообразных конформаций.
В жидком состоянии и в растворах зигзагообразные конформации перестают преобладать в равновесной смеси, здесь уже начинает действовать кинетический фактор — за счет теплового движения молекул и их отдельных частей длинные молекулы могут принимать различные нерегулярные конформации.
Отдельные конформации в целом ахиральных молекул могут быть хиральными, так что понятия хиральности, энантиомерии и диастереомерии применимы и к конформерам. Например, скошенные конформации бутана с торсионными углами 60 и 300° по отношению друг к другу являются предметом и не совместимым с ним зеркальным изображением, т. е. парой энантиомеров. Однако в равновесной смеси конформеров эти две конформации содержатся в равных количествах и очень быстро переходят друг в друга, поэтому бутан оптической активностью не обладает.
Конформации циклогексана; виды напряжений, энергетическая характеристика конформаций; аксиальные и экваториальные связи; инверсия цикла у производных циклогексана (метилциклогексан).
Конформации циклических систем. Циклы, построенные только из тетраэдрических атомов углерода или содержащие гетероатомы, за исключением трехчленных, — неплоские и существуют в виде разнообразных конформаций. Своеобразие конформационных переходов циклических систем состоит в том, что они протекают синхронно и согласованно. Наиболее полно исследованы конформационные переходы циклогексана.
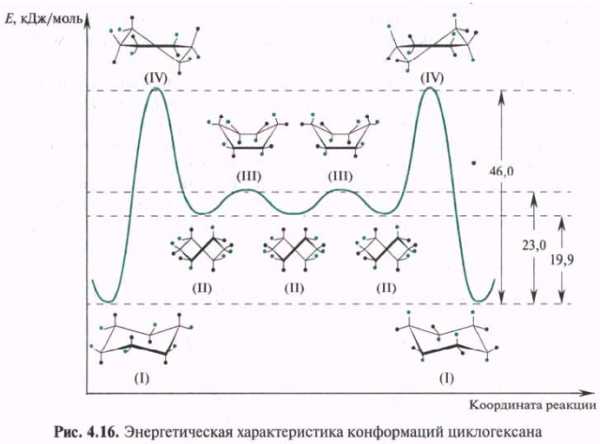
Из разных конформаций, принимаемых молекулой циклогексана, наиболее устойчивой является конформация кресла (I). Минимуму на энергетической кривой соответствует также конформация искаженной ванны — твист-конформация (II). Две другие конформации — ванна (III) и полукресло (IV)— соответствуют максимумам на энергетической кривой, и их следует рассматривать как переходные состояния между двумя относительно устойчивыми конформациями.
Циклогексан и большинство его производных и гетероциклических аналогов существуют в конформации кресла. Подтверждение этого получено с помощью рентгеноструктурного анализа при исследовании дифракции рентгеновских лучей в кристаллах гексабромо- и гексахлорозамещенных циклогексанов. Конформация кресла наиболее симметрична, каждый атом углерода имеет по две неэквивалентные связи С—Н. Связи, расположенные параллельно вертикальной оси симметрии третьего порядка, называют аксиальными (а), а связи, ориентированные под утлом 109,5° относительно упомянутой оси, называют экваториальными (е). В процессе конформационных превращений аксиальные заместители становятся экваториальными и соответственно экваториальные — аксиальными. С этой точки зрения конформационные переходы циклогексана называются инверсией.
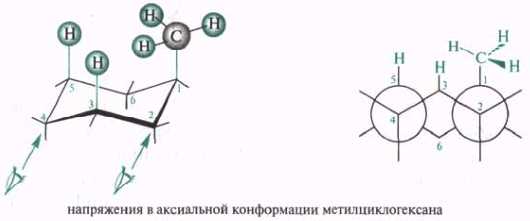
Молекулы монозамещеиных циклогексанов в процессе конформационных превращений могут принимать две неэквивалентные конформации кресла с аксиальным (аксиальный конформер) или экваториальным (экваториальный конформер) положением заместителя. Конформации замещенных циклогексанов энергетически неэквивалентны. Термодинамически более выгоден экваториальный конформер. Например, в равновесной смеси конформаций метилциклогексана 95% молекул находятся в экваториальной конформации и лишь 5% — в аксиальной. Причина относительной неустойчивости аксиальной конформации метил циклогексана заключается в 1,3-диаксиальном взаимодействии (разновидность ван-дер-ваальсова напряжения) метильной группы и аксиальных атомов водорода в положениях 3 и 5 циклогексанового кольца, при этом происходит взаимное отталкивание метильной группы и атомов водорода.
Еще одной причиной, обусловливающей предпочтительное нахождение объемных заместителей в экваториальном положении, является то, что аксиальная метильная группа находится в скошенном положении относительно группы СН2 алицикла, и в этом случае также возникает ван-дер-ваальсово напряжение:
Если в циклогексановом кольце имеется более одного заместителя, то при оценке стабильности конформации учитывают взаимное расположение заместителей в кольце и их строение. Так, в молекуле транс-1,2-диметилциклогексана оба заместителя могут занимать или аксиальное, или экваториальное положение; разумеется, более выгодной является диэкваториальная конформация. У циc-изомера в любой из двух конформаций кресла одна из –СН3 занимает аксиальное положение, другая — экваториальное; обе конформации в этом случае являются вырожденными.
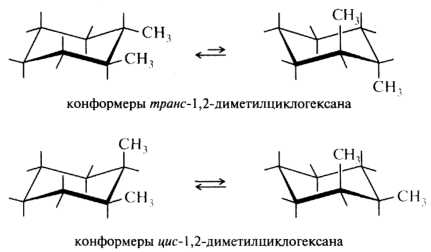
Если заместители разные, то экваториальное положение обычно занимает более объемный заместитель, как, например, у транс-1-трет-бутил-З-метил-циклогексана. Для этого углеводорода термодинамически более выгодна конформация с экваториальным положением объемного трет-бутильного радикала, у которого, кстати, одна из самых больших AG° конформационных переходов.
Похожие статьи:
poznayka.org
Конформации н-бутана
Для насыщенных углеводородов характерна структурная изомерия, связанная с разветвлением их углероднои̌ цепи. Структурные изомеры отличаются между собой только порядком размещения атомов углерода в молекуле.
Структурная изомерия насыщенных углеводородов начинается с бутана. Бутан существует в виде двух, пентан — в виде трех изомеров:
Гексан имеет пять структурных изомеров, гептан — девять, октан — 18 нонан — 35 , декан — 75 и т. д. Чем больше в молекуле насыщенного углеводорода атомов углерода, ᴛᴇᴍ больше изомеров он образует
Важно сказать, что для углеводорода C_{13}H_{28} возможно 802 изомеров, C_{14}H_{30} — у 1858 изомеров, C_{15}H_{32} — 4347 , C_{20}H_{42} возможные 366319 изомеров и т. д.
Конформационная изомерия бутана
Молекулу бутана удобно рассматривать как дизамещенный этан. В зависимости от угла поворота заместителей вокруг связи C2-C3 различают четыре характеристические конформации:
- полностью заслоненная (син-планарная) — связи C-H и C-C расположены одна за другой, торсионный угол varphi = 0^circ ;
- скошенная (гош- или син-клинальная) — торсионный угол varphi = 60^circ
- чно в заслоненная (анти-клинальная) — отличается от полностью заслоненнои̌ конформации C-C -связи не совпадают, торсионный угол varphi -120^circ ;
- заторможеная (анти-планарная) — торсионный угол varphi = 180^circ :
Рисунок 1.
Максимальную потенциальную энергию имеет син-планарная конформация, которой наряду с торсионным напряжением существует и вандерваальсовы напряжение, возникающее в результате отталкивания групп, в ϶том случае метильных, которые смещены на расстояние, меньше суммы их вандерваальсовы радиусов.
Минимальная внутренняя энергия характерна анти-планарнои̌ конформации, которая не имеет торсионных напряжений. Барьер ротации молекулы бутана составляет 26 кДж / моль, вследствие чᴇᴦο при комнатнои̌ температуре заслоненные конформации не возникают, а 69\% молекул вещества находятся в самой стабильнои̌ заторможеннои̌ анти-конформации и 31\% — в гош-конформации (рис. 2).
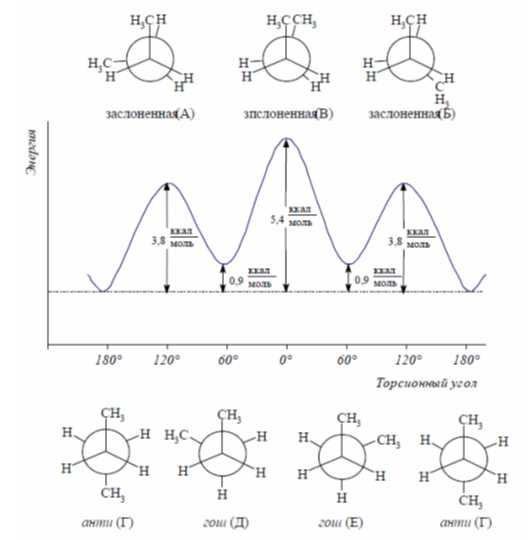
Рисунок 2. Зависимость потенциальнои̌ энергии н-бутана от угла varphi
Составы конформационных смесей насыщенных углеводородов
Точные составы конформационных смесей определяются разностями свободных энергий конформаций riangle G^circ (конф.) с помощью уравнения Гиббса. В табл. 1 указаны расчетные значения энергии взаимодействий различных групп в насыщенных углеводородах.
Рисунок 3. Расчетные значения энергии взаимодействий различных групп в насыщенных углеводородах
Характерными особенностями конформаций разветвленных насыщенных углеводородов обязательное наличие скошенного (гош-бутанового) взаимодействия электронных оболочек метильных или других алкильных заместителей и атомов водорода основных углеродных цепей. Следует отметить, что так моно-метилзамещенные алканы в наиболее стабильных конформационных формах имеют одно или два гош-взаимодействия. В 2-метилзамещенных углеводородах наблюдается лишь одно гош-взаимодействие. В 3-метил-, 4-метил- и более замещенных алканов в наиболее стабильных ᴎɜ гош-конформаций наблюдается два гош-взаимодействия метильных групп и атомов водорода основных углеродных цепей.
Энергия конформационых форм
Для оценки энергий конформационых форм разветвленных углеводородов пользуются принципом аддитивности энергий взаимодействий групп H-H , H-CH_3 и CH_3-CH_3 , которые приведенны в табл. 1. В качестве примера на рисунке 4 приведены зависимости потенциальных энергий различных конформационных форм 2-метилбутана от торсионного угла поворота вокруг центральнои̌ углерод-углероднои̌ связи.
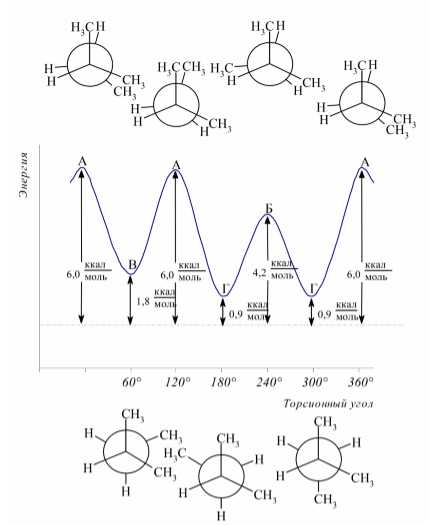
Рисунок 4.
Различия в энергиях между заслоненнои̌ конформацией и гош-конформером 2-метилбутана соответствуют принципу аддитивности энергии взаимодействий атомов и групп.
Подобный подход оказывается верным и при оценке стабильности других разветвленных алканов. Так, например, ᴎɜ двух гош-конформацонных форм 2,3-диметилбутана наиболее стабильнои̌ оказывается та, где имеются два гош-взаимодействия метильных групп:
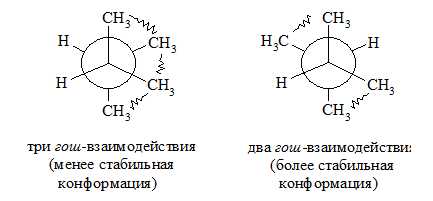
Рисунок 5.
referatwork.ru