мономер, строение и функции :: SYL.ru
Белки являются высокомолекулярными органическими соединениями. Состоят из остатков аминокислот. В их состав также входят другие вещества: сера, кислород, азот, водород и углерод. Некоторые белки способны образовывать комплексы с молекулами, если в их составе присутствует цинк, медь, железо и фосфор. У белков достаточно большая молекулярная масса, поэтому они носят название макромолекул. Например, у яичного альбумина — 36 тысяч, а у гемоглобина (белок крови) — 152 тысячи, а миозин имеет молекулярную массу 500 тысяч. Сравним: молекулярная масса бензола — 78, а уксусная кислота имеет показатель в 60.
Строение
Довольно часто, особенно среди школьников, можно встретить утверждение, что мономеры белков — нуклеотиды. Это заблуждение. Белки, или протеины, самые распространенные и многочисленные из органических соединений, — это разнообразные и необходимые для функционирования организма полимеры. От 50 до 80 % в сухой массе клетки приходится именно на белок. Мономеры, а точнее их количество и последовательность, отличают белки друг от друга.
Белки являются непериодическими полимерами, для их функционирования важно присутствие нескольких веществ. В общей формуле обязательно должны присутствовать карбоксильная группа (-COOH), аминогруппа (-Nh3) и радикал, или R-группа (это оставшаяся часть молекулы), карбоксильная и аминогруппы. Из чего состоит белок? Мономеры его — аминокислоты, и, хотя клетки и ткани содержат более ста семидесяти видов аминокислот, к мономерам биологи относят только два десятка видов.
Существует классификация аминокислот, согласно которой они подразделяются на две группы, в зависимости от того, могут ли синтезироваться организмами животных и человека. Заменимые аминокислоты организм может производить самостоятельно, незаменимые же можно получить только извне — с пищей, а вот растения способны синтезировать их все.

Классификация
Сами же белки классифицируются по аминокислотному составу. Они могут быть полноценными, если содержат полной набор аминокислот, и неполноценным, если одна или несколько аминокислот отсутствуют. Если белок состоит исключительно из аминокислот, его называют простым. В случае, когда присутствует простетическая группа, которая также называется неаминокислотным компонентом, их называют сложными. Неаминокислотная группа может быть представлена в виде металлопротеинов, углеводов (гликопротеинов), липидов (липопротеинов) и нуклеиновых кислот (нуклеопротеинов).
Элементарная часть
Сами аминокислоты состоят из трех обязательных частей. Таким образом, можно сказать, что мономером белка является радикал, различающий между собой виды аминокислот, а также неизменяемые карбоксильная и амино- группы. По количеству входящих в состав карбоксильных и аминогрупп аминокислоты подразделяют на нейтральные, основные и кислые. Нейтральные имеют по одной карбоксильной и аминогруппе. В формуле основных содержится более одной аминогруппы, а в кислых аминокислотах, наоборот, имеется более чем одна карбоксильная группа.
Аминокислоты — мономеры белков — амфотерные соединения, потому что из-за наличия карбоксо- и аминогрупп в растворе могут выступать и в качестве оснований, и в качестве кислот. В водном растворе представлены в качестве ионных форм.
Пептидная связь
Полипептид — так ученые называют белок: мономер его скрепляется с себе подобными с помощью пептидных связей. Пептиды являются продуктом реакции конденсации аминокислот. Взаимодействие карбоксильной и аминогрупп двух аминокислот характерно образованием ковалентной азот-углеродной связи, она и называется пептидной. Пептиды классифицируют по количеству остатков аминокислот, входящих в их состав: дипептиды, трипептиды, тетрапептиды и так далее. При многократном повторении образования ковалентной азот-углеродной связи образуются полипептиды. Один конец пептида содержит свободную аминогруппу и называется N-концом, второй — свободную карбоксильную группу и называется, соответственно, C-концом.

Еще одна классификация
Как уже упоминалось выше, мономеры белков состоят из амино- и карбоксильной групп и радикала, которые образуют между собой прочные связи. Также могут присутствовать и другие вещества, однако именно от R-группы в основном зависят свойства всей молекулы, и существует еще один тип классификации. Какой? Мономеру белка свойственно иметь различные радикалы, по их типу и можно разделить все аминокислоты на гетероциклические, ароматические и алифатические. Алифатический радикал может содержать функциональные группы, которые придают особые свойства. Это амино-, карбоксильная, тиольная (-SH), гидроксильная (-OH), амидная (-C0-Nh3) и гуанидиновая группы.
Разные радикалы
Мономер молекулы белка, содержащий аминогруппу, — это аминокислота пролин. Гетероциклические радикалы содержатся в составе триптофана и гистидина. Ароматический радикал присутствует в фенилаланине и тирозине. Дополнительная гидроксильная группа есть в серине и треонине; карбоксильная — в аспарагиновой и глутаминовой кислотах. Еще одна амидная группа в составе радикала имеется в аспарагине и глутамине (не путать с кислотами). Дополнительная аминогруппа есть у лизина, а гуанидиновая — в аргинине. Сера присутствует в радикалах цистеина и метионина.
Организация молекул белка в пространстве
Каждый белок имеет специфические функции, которые зависят от пространственной организации молекул. К тому же поддержка белков в виде цепочки, то есть в развернутом виде, в энергетическом плане невыгодна для клетки, поэтому, так же как молекулы ДНК, цепи полипептидов подвергаются компактизации, за счет чего приобретают конформацию — трехмерную структуру.
Пространственная организация белковых молекул имеет четыре уровня.
Так как мономерами молекул белков являются аминокислоты, то первичная структура представлена в виде полипептидной цепи, состоящей из аминокислотных остатков, которые объединены пептидной связью. Несмотря на кажущуюся простоту, именно первичная структура определяет, какую функцию сможет выполнять белок. Мономер в составе цепи должен быть на своем месте, замена даже одного из них изменит назначение всей молекулы. Например, если шестую глутаминовую кислоту в гемоглобине заменить на валин, вся молекула в целом перестанет функционировать, и транспорт кислорода будет нарушен. Такая замена приводит к развитию у человека серповидноклеточной анемии.
Если в составе полипротеина содержится десять аминокислотных остатков, то вариантов чередования мономеров будет очень много — 1020, если же будут присутствовать все 20, комбинаций, которые можно составить, станет еще больше. Организм человека синтезирует более десяти тысяч белков, которые отличаются не только по сравнению друг с другом, но и с белками других живых организмов.
Вторичная структура характерна упорядоченным свертыванием цепи в спираль, по внешнему виду напоминающую растянутую пружину. Связи, возникающие между мономерами белков, являются водородными и укрепляют структуру. Эти связи появляются между амино- и карбоксильными группами. Водородные связи слабее пептидных, но делают всю конфигурацию более жесткой и устойчивой за счет многократного повторения. Для некоторых белков, например фиброина (паутина, шелк), кератина (ногти и волосы) и коллагена, дальнейшей компактизации не происходит.
Третий уровень
На следующем уровне полипептидные цепи укладываются в глобулы, которые возникают из-за установки новых химических связей — дисульфидных, ионных, водородных. Также важным фактором является установка гидрофобного взаимодействия между R-группами аминокислотных остатков, именно гидрофильно-гидрофобным взаимодействиям отводится основная роль в факторе образования третичной структуры белковой молекулы.
При попадании в водный раствор радикалы-гидрофобы стараются скрыться от воды путем группировки внутри глобул, а гидрофильные R-группы взаимодействуют с диполями воды (гидратация), напротив, оказываются на поверхности. Некоторые белки имеют дополнительную стабилизацию третичной структуры за счет дисульфидных ковалентных связей, которые возникают между двумя остатками цистеина за счет наличия атомов серы. На третичной структуре заканчивается компактизация белков-ферментов, антител и некоторых гормонов.

Четвертичная структура
Последняя степень компактизации присутствует в сложных белках, в составе которых имеется две и более глобул. Удерживание субъединиц происходит за счет ионных, гидрофобных и электростатических взаимодействий. Также возможно образование дисульфидных связей. Четвертичную структуру имеет белок гемоглобин, образованный двумя альфа-субъединицами, содержащими 141 аминокислотный остаток, и бета-субъединицами, в составе которых насчитывается 146 остатков. Каждая субъединица связана также с молекулой гема, в которой содержится железо.
Свойства белков
Так как мономером молекулы белка является аминокислота, то именно от них, наряду со структурной организацией, зависят и свойства. Белки проявляют как кислотные, так и основные свойства, которые определяется R-группами аминокислот: если в составе больше основных аминокислот, то и основные свойства выражены ярче. Буферные свойства белков определяется способностью присоединять и отдавать протон (H+). Гемоглобин, содержащийся в эритроцитах, является одним из мощнейших буферов, помимо связывания кислорода он исполняет функции регуляции уровня pH крови.
Существуют растворимые белки, например фибриноген, и нерастворимые, которые выполняют механические функции (например, коллаген, кератин, фиброин). Ферменты — это химически активные белки, и, в противовес им, есть и инертные полипептиды. Также выделяют белки, которые устойчивы или неустойчивы к воздействию внешних условий.
Денатурация
Такие внешние факторы, как ультрафиолетовое излучение, соли тяжелых металлов и сами металлы, обезвоживание, радиация, нагревание и изменение pH, могут привести к частичному или полному разрушению структурной организации белковой молекулы. Утрата трехмерной конструкции называется денатурацией. Ее причиной становится разрыв связей, которые придавали стабильность структуре молекулы. Первыми разрушаются слабые связи, а затем, в случае еще более жестких условий, рвутся даже сильные, именно поэтому сначала рушится четвертичная структура, и только после этого — третичная и вторичная.
Когда пространственная конфигурация меняется, белок меняет и свои свойства, в результате чего больше не может выполнять свойственную ему биологическую задачу. Если при денатурации не произошло разрушение базовой, первичной структуры, то она обратима, и белок сможет провести процедуру самовосстановления — ренатурацию. В остальных же случаях денатурация необратима.

Защита и обмен веществ
Без участия белков в организме не происходит ни одного процесса. Их строительная функция заключается в участии в формировании внеклеточных и клеточных структур, они присутствуют в составе мембран клеток, волос, ногтей и сухожилий. Также выполняют и транспортную функцию: гемоглобин осуществляет перенос кислорода и углекислого газа, а белки мембран клеток активно и избирательно проводят перенос нужных веществ в клетку и из нее во внешнюю среду.
Некоторые гормоны имеют белковую природу и участвуют в регуляции обмена веществ. К примеру, инсулин производит регулировку в крови уровня глюкозы, а наряду с этим способствует образованию гликогена и оптимизирует синтез жиров из углеводов.
Защитная функция белков состоит в образовании антител в случае, если организм атакован чужеродными белками и микроорганизмами. Антитела способны находить и обезвреживать их. При ранах и порезах из фибриногена образуется фибрин, который помогает остановить кровотечение.
Другие функции
Без белков невозможно движение: миозин и актин — сократительные белки, за счет которых обеспечивается работа мышц у животных.
На белках лежит также и сигнальная функция. В клеточных мембранах содержатся белки, которые могут менять свою третичную структуру в зависимости от воздействия внешней среды. Это является основой приема и передачи в клетку сигналов из внешней среды.
Ни человек, ни животные не могут запасать белки (исключением является казеин молока и альбумин яиц), но белки способствуют накоплению в организме некоторых веществ. К примеру, во время распада гемоглобина железо не покидает организм, а образует комплекс с ферритином. Распад одного грамма белка дает организму и 17,6 кДж энергии, в этом заключается их энергетическая функция. Однако, как правило, организм «старается» не расходовать для этого такой важный материал, и сначала распадаются жиры и углеводы.
Одна из самых важных функций — каталитическая. Она обеспечивается ферментами, которые способны ускорять биохимические реакции в клетках.
www.syl.ru
Мономерами белков являются какие вещества? Что такое мономеры белков?
Белки являются биологическими полимерами со сложнейшей структурой. Они имеют высокий молекулярный вес и состоят из аминокислот, простетических групп, представленных витаминами, липидных и углеводных включений. Белки, содержащие углеводы, витамины, металлы или липиды, называются сложными. Простые белки состоят только из аминокислот, соединенных между собой пептидной связью.
Пептиды
Независимо от того, какую структуру имеет вещество, мономерами белков являются аминокислоты. Они образуют базовую полипептидную цепочку, из которой затем формируется фибриллярная или глобулярная структура белка. При этом белок может синтезироваться только в живой ткани — в растительных, бактериальных, грибковых, животных и прочих клетках.
Единственными организмами, которые не могут соединять мономеры белков, являются вирусы и простейшие бактерии. Все остальные способны образовывать структурные белки. Но какие вещества являются мономерами белков, и как они образуются? Об этом и о биосинтезе белка, о полипептидах и образовании сложной белковой структуры, об аминокислотах и их свойствах читайте ниже.
Единственным мономером молекулы белка служит любая альфа-аминокислота. При этом белок — это полипептид, цепочка из соединенных аминокислот. В зависимости от количества аминокислот, участвующих в его образовании, выделяют дипептиды (2 остатка), трипептиды (3), олигопептиды (содержит от 2-10 аминокислот) и полипептиды (множество аминокислот).
Обзор структуры белков
Структура белка может быть первичной, чуть более сложной — вторичной, еще более сложной — третичной, и самой сложной — четвертичной.
Первичная структура — это простая цепь, в которую посредством пептидной связи (CO-NH) соединены мономеры белков (аминокислоты). Вторичная структура — это альфа-спираль или бета-складки. Третичная — это еще более усложненная трехмерная структура белка, которая образовалась из вторичной вследствие образования ковалентных, ионных и водородных связей, а также гидрофобных взаимодействий.
Четвертичная структура является самой сложной и свойственна рецепторным белкам, расположенным на клеточных мембранах. Это надмолекулярная (доменная) структура, образованная вследствие объединения нескольких молекул с третичной структурой, дополненных углеводными, липидными или витаминными группами. В данном случае, как и при первичной, вторичной и третичной структурах, мономерами белков являются альфа-аминокислоты. Они также соединены пептидными связями. Отличие состоит лишь в сложности структуры.
Аминокислоты
Единственными мономерами молекул белков являются альфа-аминокислоты. Их всего 20, и они являются чуть ли не основой жизни. Благодаря появлению пептидной связи, синтез белка стал возможным. А сам белок после этого начал выполнять структурообразующую, рецепторную, ферментативную, транспортную, медиаторную и прочие функции. Благодаря этому живой организм функционирует и способен воспроизводиться.
Сама альфа-аминокислота представляет собой органическую карбоновую кислоту с аминогруппой, соединенной с альфа-углеродным атомом. Последний расположен рядом с карбоксильной группой. При этом мономеры белков рассматриваются как органические вещества, у которых концевой углеродный атом несет и аминную, и карбоксильную группу.
Соединение аминокислот в пептидах и белках
Аминокислоты соединяются в димеры, тримеры и полимеры посредством пептидной связи. Она образуется путем отщепления гидроксильной (-ОН) группы от карбоксильного участка одной альфа-аминокислоты и водорода (-Н) — от аминогруппы другой альфа-аминокислоты. В результате взаимодействия отщепляется вода, а на карбоксильном конце остается участок С=О со свободным электроном около углерода карбоксильного остатка. В аминогруппе другой кислоты имеется остаток (NH) с имеющимся свободным радикалом у азотного атома. Это позволяет соединить два радикала с образованием связи (CONH). Она называется пептидной.
Варианты альфа-аминокислот
Всего известно 23 альфа-аминокислоты. Они представлены в виде списка: глицин, валин, аланин, изолецин, лейцин, глутамат, аспарагинат, орнитин, треонин, серин, лизин, цистин, цистеин, фенилаланин, метионин, тирозин, пролин, триптофан, оксипролин, аргинин, гистидин, аспарагин и глутамин. В зависимости от того, могут ли они синтезироваться организмом человека, эти аминокислоты делятся на заменимые и незаменимые.
Понятие о заменимых и незаменимых аминокислотах
Заменимые организм человека может синтезировать, тогда как незаменимые должны поступать только с пищей. При этом и незаменимые, и заменимые кислоты важны для биосинтеза белка, потому как без них синтез не может быть завершен. Без одной аминокислоты, даже если все остальные присутствуют, невозможно построить именно тот белок, который требуется клетке для выполнения своих функций.
Одна ошибка на любом из этапов биосинтеза — и белок уже непригоден, потому как не сможет собраться в нужную структуру из-за нарушения электронных плотностей и межатомных взаимодействий. Потому человеку (и прочим организмам) важно потреблять белковые продукты, в которых имеются незаменимые аминокислоты. Их отсутствие в пище приводит к ряду нарушений белкового обмена.
Процесс образования пептидной связи
Единственными мономерами белков являются альфа-аминокислоты. Они постепенно соединяются в цепочку полипетида, структура которой заранее сохранена в генетическом коде ДНК (или РНК, если рассматривается бактериальный биосинтез). При этом белок — это строгая последовательность аминокислотных остатков. Это цепочка, упорядоченная в определенную структуру, выполняющая в клетке заранее запрограммированную функцию.
Этапная последовательность белкового биосинтеза
Процесс образования белка состоит из цепи этапов: репликация участка ДНК (или РНК), синтез РНК информационного типа, ее выход в цитоплазму клетки из ядра, соединение с рибосомой и постепенное прикрепление аминокислотных остатков, которые поставляются транспортной РНК. Вещество, что является мономером белка, участвует в ферментативной реакции отщепления гидроксильной группы и протона водорода, а затем присоединяется к наращиваемой полипетидной цепочке.
Таким образом получается полипептидная цепочка, которая уже в клеточном эндоплазматическом ретикулуме упорядочивается в некую заранее заданную структуру и дополняется углеводным или липидным остатком, если это требуется. Это называется процессом «созревания» белка, после чего тот направляется транспортной клеточной системой к месту назначения.
Функции синтезированных белков
Мономерами белков являются аминокислоты, необходимые для построения их первичной структуры. Вторичная, третичная и четвертичная структура уже образуется сама, хотя иногда также требует участия ферментов и прочих веществ. Однако они уже не являются основными, хотя и крайне необходимы, чтобы белки выполняли свою функцию.
Аминокислота, что является мономером белка, может иметь места прикрепления углеводов, металлов или витаминов. Образование третичной или четвертичной структуры дает возможность найти еще больше мест для расположения вставочных групп. Это позволяет создать из белка производное, которое играет роль фермента, рецептора, переносчика веществ в клетку или из нее, иммуноглобулина, структурного компонента мембраны или клеточной органеллы, мышечного белка.
Белки, образованные из аминокислот, являются единственной основой жизни. И сегодня считается, что жизнь как раз зародилась после появления аминокислоты и вследствие ее полимеризации. Ведь именно межмолекулярное взаимодействие белков и есть начало жизни, в том числе и разумной. Все остальные биохимические процессы, включая энергетические, нужны для реализации белкового биосинтеза, и как результат, дальнейшего продолжения жизни.
fb.ru
Мономерами белков являются какие вещества? Что такое мономеры белков?
Образование 31 мая 2015Белки являются биологическими полимерами со сложнейшей структурой. Они имеют высокий молекулярный вес и состоят из аминокислот, простетических групп, представленных витаминами, липидных и углеводных включений. Белки, содержащие углеводы, витамины, металлы или липиды, называются сложными. Простые белки состоят только из аминокислот, соединенных между собой пептидной связью.
Пептиды
Независимо от того, какую структуру имеет вещество, мономерами белков являются аминокислоты. Они образуют базовую полипептидную цепочку, из которой затем формируется фибриллярная или глобулярная структура белка. При этом белок может синтезироваться только в живой ткани — в растительных, бактериальных, грибковых, животных и прочих клетках.
Единственными организмами, которые не могут соединять мономеры белков, являются вирусы и простейшие бактерии. Все остальные способны образовывать структурные белки. Но какие вещества являются мономерами белков, и как они образуются? Об этом и о биосинтезе белка, о полипептидах и образовании сложной белковой структуры, об аминокислотах и их свойствах читайте ниже.
Единственным мономером молекулы белка служит любая альфа-аминокислота. При этом белок — это полипептид, цепочка из соединенных аминокислот. В зависимости от количества аминокислот, участвующих в его образовании, выделяют дипептиды (2 остатка), трипептиды (3), олигопептиды (содержит от 2-10 аминокислот) и полипептиды (множество аминокислот).
Обзор структуры белков
Структура белка может быть первичной, чуть более сложной — вторичной, еще более сложной — третичной, и самой сложной — четвертичной.
Первичная структура — это простая цепь, в которую посредством пептидной связи (CO-NH) соединены мономеры белков (аминокислоты). Вторичная структура — это альфа-спираль или бета-складки. Третичная — это еще более усложненная трехмерная структура белка, которая образовалась из вторичной вследствие образования ковалентных, ионных и водородных связей, а также гидрофобных взаимодействий.
Четвертичная структура является самой сложной и свойственна рецепторным белкам, расположенным на клеточных мембранах. Это надмолекулярная (доменная) структура, образованная вследствие объединения нескольких молекул с третичной структурой, дополненных углеводными, липидными или витаминными группами. В данном случае, как и при первичной, вторичной и третичной структурах, мономерами белков являются альфа-аминокислоты. Они также соединены пептидными связями. Отличие состоит лишь в сложности структуры.
Аминокислоты
Единственными мономерами молекул белков являются альфа-аминокислоты. Их всего 20, и они являются чуть ли не основой жизни. Благодаря появлению пептидной связи, синтез белка стал возможным. А сам белок после этого начал выполнять структурообразующую, рецепторную, ферментативную, транспортную, медиаторную и прочие функции. Благодаря этому живой организм функционирует и способен воспроизводиться.
Сама альфа-аминокислота представляет собой органическую карбоновую кислоту с аминогруппой, соединенной с альфа-углеродным атомом. Последний расположен рядом с карбоксильной группой. При этом мономеры белков рассматриваются как органические вещества, у которых концевой углеродный атом несет и аминную, и карбоксильную группу.
Соединение аминокислот в пептидах и белках
Аминокислоты соединяются в димеры, тримеры и полимеры посредством пептидной связи. Она образуется путем отщепления гидроксильной (-ОН) группы от карбоксильного участка одной альфа-аминокислоты и водорода (-Н) — от аминогруппы другой альфа-аминокислоты. В результате взаимодействия отщепляется вода, а на карбоксильном конце остается участок С=О со свободным электроном около углерода карбоксильного остатка. В аминогруппе другой кислоты имеется остаток (NH) с имеющимся свободным радикалом у азотного атома. Это позволяет соединить два радикала с образованием связи (CONH). Она называется пептидной.
Варианты альфа-аминокислот
Всего известно 23 альфа-аминокислоты. Они представлены в виде списка: глицин, валин, аланин, изолецин, лейцин, глутамат, аспарагинат, орнитин, треонин, серин, лизин, цистин, цистеин, фенилаланин, метионин, тирозин, пролин, триптофан, оксипролин, аргинин, гистидин, аспарагин и глутамин. В зависимости от того, могут ли они синтезироваться организмом человека, эти аминокислоты делятся на заменимые и незаменимые.
Понятие о заменимых и незаменимых аминокислотах
Заменимые организм человека может синтезировать, тогда как незаменимые должны поступать только с пищей. При этом и незаменимые, и заменимые кислоты важны для биосинтеза белка, потому как без них синтез не может быть завершен. Без одной аминокислоты, даже если все остальные присутствуют, невозможно построить именно тот белок, который требуется клетке для выполнения своих функций.
Одна ошибка на любом из этапов биосинтеза — и белок уже непригоден, потому как не сможет собраться в нужную структуру из-за нарушения электронных плотностей и межатомных взаимодействий. Потому человеку (и прочим организмам) важно потреблять белковые продукты, в которых имеются незаменимые аминокислоты. Их отсутствие в пище приводит к ряду нарушений белкового обмена.
Процесс образования пептидной связи
Единственными мономерами белков являются альфа-аминокислоты. Они постепенно соединяются в цепочку полипетида, структура которой заранее сохранена в генетическом коде ДНК (или РНК, если рассматривается бактериальный биосинтез). При этом белок — это строгая последовательность аминокислотных остатков. Это цепочка, упорядоченная в определенную структуру, выполняющая в клетке заранее запрограммированную функцию.
Этапная последовательность белкового биосинтеза
Процесс образования белка состоит из цепи этапов: репликация участка ДНК (или РНК), синтез РНК информационного типа, ее выход в цитоплазму клетки из ядра, соединение с рибосомой и постепенное прикрепление аминокислотных остатков, которые поставляются транспортной РНК. Вещество, что является мономером белка, участвует в ферментативной реакции отщепления гидроксильной группы и протона водорода, а затем присоединяется к наращиваемой полипетидной цепочке.
Таким образом получается полипептидная цепочка, которая уже в клеточном эндоплазматическом ретикулуме упорядочивается в некую заранее заданную структуру и дополняется углеводным или липидным остатком, если это требуется. Это называется процессом «созревания» белка, после чего тот направляется транспортной клеточной системой к месту назначения.
Функции синтезированных белков
Мономерами белков являются аминокислоты, необходимые для построения их первичной структуры. Вторичная, третичная и четвертичная структура уже образуется сама, хотя иногда также требует участия ферментов и прочих веществ. Однако они уже не являются основными, хотя и крайне необходимы, чтобы белки выполняли свою функцию.
Аминокислота, что является мономером белка, может иметь места прикрепления углеводов, металлов или витаминов. Образование третичной или четвертичной структуры дает возможность найти еще больше мест для расположения вставочных групп. Это позволяет создать из белка производное, которое играет роль фермента, рецептора, переносчика веществ в клетку или из нее, иммуноглобулина, структурного компонента мембраны или клеточной органеллы, мышечного белка.
Белки, образованные из аминокислот, являются единственной основой жизни. И сегодня считается, что жизнь как раз зародилась после появления аминокислоты и вследствие ее полимеризации. Ведь именно межмолекулярное взаимодействие белков и есть начало жизни, в том числе и разумной. Все остальные биохимические процессы, включая энергетические, нужны для реализации белкового биосинтеза, и как результат, дальнейшего продолжения жизни.
Источник: fb.ru
monateka.com
Белок: мономер, строение и функции
Белки являются высокомолекулярными органическими соединениями. Состоят из остатков аминокислот. В их состав также входят другие вещества: сера, кислород, азот, водород и углерод. Некоторые белки способны образовывать комплексы с молекулами, если в их составе присутствует цинк, медь, железо и фосфор. У белков достаточно большая молекулярная масса, поэтому они носят название макромолекул. Например, у яичного альбумина — 36 тысяч, а у гемоглобина (белок крови) — 152 тысячи, а миозин имеет молекулярную массу 500 тысяч. Сравним: молекулярная масса бензола — 78, а уксусная кислота имеет показатель в 60.

Строение
Довольно часто, особенно среди школьников, можно встретить утверждение, что мономеры белков — нуклеотиды. Это заблуждение. Белки, или протеины, самые распространенные и многочисленные из органических соединений, — это разнообразные и необходимые для функционирования организма полимеры. От 50 до 80 % в сухой массе клетки приходится именно на белок. Мономеры, а точнее их количество и последовательность, отличают белки друг от друга.Белки являются непериодическими полимерами, для их функционирования важно присутствие нескольких веществ. В общей формуле обязательно должны присутствовать карбоксильная группа (-COOH), аминогруппа (-Nh3) и радикал, или R-группа (это оставшаяся часть молекулы), карбоксильная и аминогруппы. Из чего состоит белок? Мономеры его — аминокислоты, и, хотя клетки и ткани содержат более ста семидесяти видов аминокислот, к мономерам биологи относят только два десятка видов.
Существует классификация аминокислот, согласно которой они подразделяются на две группы, в зависимости от того, могут ли синтезироваться организмами животных и человека. Заменимые аминокислоты организм может производить самостоятельно, незаменимые же можно получить только извне — с пищей, а вот растения способны синтезировать их все.

Классификация
Сами же белки классифицируются по аминокислотному составу. Они могут быть полноценными, если содержат полной набор аминокислот, и неполноценным, если одна или несколько аминокислот отсутствуют. Если белок состоит исключительно из аминокислот, его называют простым. В случае, когда присутствует простетическая группа, которая также называется неаминокислотным компонентом, их называют сложными. Неаминокислотная группа может быть представлена в виде металлопротеинов, углеводов (гликопротеинов), липидов (липопротеинов) и нуклеиновых кислот (нуклеопротеинов).
Элементарная часть
Сами аминокислоты состоят из трех обязательных частей. Таким образом, можно сказать, что мономером белка является радикал, различающий между собой виды аминокислот, а также неизменяемые карбоксильная и амино- группы. По количеству входящих в состав карбоксильных и аминогрупп аминокислоты подразделяют на нейтральные, основные и кислые. Нейтральные имеют по одной карбоксильной и аминогруппе. В формуле основных содержится более одной аминогруппы, а в кислых аминокислотах, наоборот, имеется более чем одна карбоксильная группа.Аминокислоты — мономеры белков — амфотерные соединения, потому что из-за наличия карбоксо- и аминогрупп в растворе могут выступать и в качестве оснований, и в качестве кислот. В водном растворе представлены в качестве ионных форм.
Пептидная связь
Полипептид — так ученые называют белок: мономер его скрепляется с себе подобными с помощью пептидных связей. Пептиды являются продуктом реакции конденсации аминокислот. Взаимодействие карбоксильной и аминогрупп двух аминокислот характерно образованием ковалентной азот-углеродной связи, она и называется пептидной. Пептиды классифицируют по количеству остатков аминокислот, входящих в их состав: дипептиды, трипептиды, тетрапептиды и так далее. При многократном повторении образования ковалентной азот-углеродной связи образуются полипептиды. Один конец пептида содержит свободную аминогруппу и называется N-концом, второй — свободную карбоксильную группу и называется, соответственно, C-концом.Еще одна классификация
Как уже упоминалось выше, мономеры белков состоят из амино- и карбоксильной групп и радикала, которые образуют между собой прочные связи. Также могут присутствовать и другие вещества, однако именно от R-группы в основном зависят свойства всей молекулы, и существует еще один тип классификации. Какой? Мономеру белка свойственно иметь различные радикалы, по их типу и можно разделить все аминокислоты на гетероциклические, ароматические и алифатические. Алифатический радикал может содержать функциональные группы, которые придают особые свойства. Это амино-, карбоксильная, тиольная (-SH), гидроксильная (-OH), амидная (-C0-Nh3) и гуанидиновая группы.Разные радикалы
Мономер молекулы белка, содержащий аминогруппу, — это аминокислота пролин. Гетероциклические радикалы содержатся в составе триптофана и гистидина. Ароматический радикал присутствует в фенилаланине и тирозине. Дополнительная гидроксильная группа есть в серине и треонине; карбоксильная — в аспарагиновой и глутаминовой кислотах. Еще одна амидная группа в составе радикала имеется в аспарагине и глутамине (не путать с кислотами). Дополнительная аминогруппа есть у лизина, а гуанидиновая — в аргинине. Сера присутствует в радикалах цистеина и метионина.Организация молекул белка в пространстве
Каждый белок имеет специфические функции, которые зависят от пространственной организации молекул. К тому же поддержка белков в виде цепочки, то есть в развернутом виде, в энергетическом плане невыгодна для клетки, поэтому, так же как молекулы ДНК, цепи полипептидов подвергаются компактизации, за счет чего приобретают конформацию — трехмерную структуру.Пространственная организация белковых молекул имеет четыре уровня.
Так как мономерами молекул белков являются аминокислоты, то первичная структура представлена в виде полипептидной цепи, состоящей из аминокислотных остатков, которые объединены пептидной связью. Несмотря на кажущуюся простоту, именно первичная структура определяет, какую функцию сможет выполнять белок. Мономер в составе цепи должен быть на своем месте, замена даже одного из них изменит назначение всей молекулы. Например, если шестую глутаминовую кислоту в гемоглобине заменить на валин, вся молекула в целом перестанет функционировать, и транспорт кислорода будет нарушен. Такая замена приводит к развитию у человека серповидноклеточной анемии.
Если в составе полипротеина содержится десять аминокислотных остатков, то вариантов чередования мономеров будет очень много — 1020, если же будут присутствовать все 20, комбинаций, которые можно составить, станет еще больше. Организм человека синтезирует более десяти тысяч белков, которые отличаются не только по сравнению друг с другом, но и с белками других живых организмов.
 Вторичная структура характерна упорядоченным свертыванием цепи в спираль, по внешнему виду напоминающую растянутую пружину. Связи, возникающие между мономерами белков, являются водородными и укрепляют структуру. Эти связи появляются между амино- и карбоксильными группами. Водородные связи слабее пептидных, но делают всю конфигурацию более жесткой и устойчивой за счет многократного повторения. Для некоторых белков, например фиброина (паутина, шелк), кератина (ногти и волосы) и коллагена, дальнейшей компактизации не происходит.
Вторичная структура характерна упорядоченным свертыванием цепи в спираль, по внешнему виду напоминающую растянутую пружину. Связи, возникающие между мономерами белков, являются водородными и укрепляют структуру. Эти связи появляются между амино- и карбоксильными группами. Водородные связи слабее пептидных, но делают всю конфигурацию более жесткой и устойчивой за счет многократного повторения. Для некоторых белков, например фиброина (паутина, шелк), кератина (ногти и волосы) и коллагена, дальнейшей компактизации не происходит.
Третий уровень
На следующем уровне полипептидные цепи укладываются в глобулы, которые возникают из-за установки новых химических связей — дисульфидных, ионных, водородных. Также важным фактором является установка гидрофобного взаимодействия между R-группами аминокислотных остатков, именно гидрофильно-гидрофобным взаимодействиям отводится основная роль в факторе образования третичной структуры белковой молекулы.При попадании в водный раствор радикалы-гидрофобы стараются скрыться от воды путем группировки внутри глобул, а гидрофильные R-группы взаимодействуют с диполями воды (гидратация), напротив, оказываются на поверхности. Некоторые белки имеют дополнительную стабилизацию третичной структуры за счет дисульфидных ковалентных связей, которые возникают между двумя остатками цистеина за счет наличия атомов серы. На третичной структуре заканчивается компактизация белков-ферментов, антител и некоторых гормонов.

Четвертичная структура
Последняя степень компактизации присутствует в сложных белках, в составе которых имеется две и более глобул. Удерживание субъединиц происходит за счет ионных, гидрофобных и электростатических взаимодействий. Также возможно образование дисульфидных связей. Четвертичную структуру имеет белок гемоглобин, образованный двумя альфа-субъединицами, содержащими 141 аминокислотный остаток, и бета-субъединицами, в составе которых насчитывается 146 остатков. Каждая субъединица связана также с молекулой гема, в которой содержится железо.Свойства белков
Так как мономером молекулы белка является аминокислота, то именно от них, наряду со структурной организацией, зависят и свойства. Белки проявляют как кислотные, так и основные свойства, которые определяется R-группами аминокислот: если в составе больше основных аминокислот, то и основные свойства выражены ярче. Буферные свойства белков определяется способностью присоединять и отдавать протон (H+). Гемоглобин, содержащийся в эритроцитах, является одним из мощнейших буферов, помимо связывания кислорода он исполняет функции регуляции уровня pH крови.Существуют растворимые белки, например фибриноген, и нерастворимые, которые выполняют механические функции (например, коллаген, кератин, фиброин). Ферменты — это химически активные белки, и, в противовес им, есть и инертные полипептиды. Также выделяют белки, которые устойчивы или неустойчивы к воздействию внешних условий.
Денатурация
Такие внешние факторы, как ультрафиолетовое излучение, соли тяжелых металлов и сами металлы, обезвоживание, радиация, нагревание и изменение pH, могут привести к частичному или полному разрушению структурной организации белковой молекулы. Утрата трехмерной конструкции называется денатурацией. Ее причиной становится разрыв связей, которые придавали стабильность структуре молекулы. Первыми разрушаются слабые связи, а затем, в случае еще более жестких условий, рвутся даже сильные, именно поэтому сначала рушится четвертичная структура, и только после этого — третичная и вторичная.Когда пространственная конфигурация меняется, белок меняет и свои свойства, в результате чего больше не может выполнять свойственную ему биологическую задачу. Если при денатурации не произошло разрушение базовой, первичной структуры, то она обратима, и белок сможет провести процедуру самовосстановления — ренатурацию. В остальных же случаях денатурация необратима.

Защита и обмен веществ
Без участия белков в организме не происходит ни одного процесса. Их строительная функция заключается в участии в формировании внеклеточных и клеточных структур, они присутствуют в составе мембран клеток, волос, ногтей и сухожилий. Также выполняют и транспортную функцию: гемоглобин осуществляет перенос кислорода и углекислого газа, а белки мембран клеток активно и избирательно проводят перенос нужных веществ в клетку и из нее во внешнюю среду.Некоторые гормоны имеют белковую природу и участвуют в регуляции обмена веществ. К примеру, инсулин производит регулировку в крови уровня глюкозы, а наряду с этим способствует образованию гликогена и оптимизирует синтез жиров из углеводов.
Защитная функция белков состоит в образовании антител в случае, если организм атакован чужеродными белками и микроорганизмами. Антитела способны находить и обезвреживать их. При ранах и порезах из фибриногена образуется фибрин, который помогает остановить кровотечение.
Другие функции
Без белков невозможно движение: миозин и актин — сократительные белки, за счет которых обеспечивается работа мышц у животных.На белках лежит также и сигнальная функция. В клеточных мембранах содержатся белки, которые могут менять свою третичную структуру в зависимости от воздействия внешней среды. Это является основой приема и передачи в клетку сигналов из внешней среды.
Ни человек, ни животные не могут запасать белки (исключением является казеин молока и альбумин яиц), но белки способствуют накоплению в организме некоторых веществ. К примеру, во время распада гемоглобина железо не покидает организм, а образует комплекс с ферритином. Распад одного грамма белка дает организму и 17,6 кДж энергии, в этом заключается их энергетическая функция. Однако, как правило, организм «старается» не расходовать для этого такой важный материал, и сначала распадаются жиры и углеводы.
Одна из самых важных функций — каталитическая. Она обеспечивается ферментами, которые способны ускорять биохимические реакции в клетках.
www.nastroy.net
Мономером белка является нуклеотид аминокислота глюкоза. Белок: мономер, строение и функции
morefaqs.ru- Органические вещества
- Минералы
- Здоровье
- Системы организма
- Полезное питание
- Полезные напитки
- Женское здоровье
- Глаза
- Ягоды и травы
- Кожа, волосы и ногти
- Для мышц
- Витамины
- Витамин В
- Препараты для Детей
- Органические вещества
- Минералы
- Здоровье
- Системы организма
- Полезное питание
- Полезные напитки
- Женское здоровье
- Глаза
- Ягоды и травы
- Кожа, волосы и ногти
- Для мышц
- Витамины
- Витамин В
- Препараты для Детей
morefaqs.ru
Белок: мономер, строение и функции
Белок: мономер, строение и функции
От Masterweb
25.01.2018 11:48Белки являются высокомолекулярными органическими соединениями. Состоят из остатков аминокислот. В их состав также входят другие вещества: сера, кислород, азот, водород и углерод. Некоторые белки способны образовывать комплексы с молекулами, если в их составе присутствует цинк, медь, железо и фосфор. У белков достаточно большая молекулярная масса, поэтому они носят название макромолекул. Например, у яичного альбумина — 36 тысяч, а у гемоглобина (белок крови) — 152 тысячи, а миозин имеет молекулярную массу 500 тысяч. Сравним: молекулярная масса бензола — 78, а уксусная кислота имеет показатель в 60.
Строение
Довольно часто, особенно среди школьников, можно встретить утверждение, что мономеры белков — нуклеотиды. Это заблуждение. Белки, или протеины, самые распространенные и многочисленные из органических соединений, — это разнообразные и необходимые для функционирования организма полимеры. От 50 до 80 % в сухой массе клетки приходится именно на белок. Мономеры, а точнее их количество и последовательность, отличают белки друг от друга.Белки являются непериодическими полимерами, для их функционирования важно присутствие нескольких веществ. В общей формуле обязательно должны присутствовать карбоксильная группа (-COOH), аминогруппа (-Nh3) и радикал, или R-группа (это оставшаяся часть молекулы), карбоксильная и аминогруппы. Из чего состоит белок? Мономеры его — аминокислоты, и, хотя клетки и ткани содержат более ста семидесяти видов аминокислот, к мономерам биологи относят только два десятка видов.
Существует классификация аминокислот, согласно которой они подразделяются на две группы, в зависимости от того, могут ли синтезироваться организмами животных и человека. Заменимые аминокислоты организм может производить самостоятельно, незаменимые же можно получить только извне — с пищей, а вот растения способны синтезировать их все.
Классификация
Сами же белки классифицируются по аминокислотному составу. Они могут быть полноценными, если содержат полной набор аминокислот, и неполноценным, если одна или несколько аминокислот отсутствуют. Если белок состоит исключительно из аминокислот, его называют простым. В случае, когда присутствует простетическая группа, которая также называется неаминокислотным компонентом, их называют сложными. Неаминокислотная группа может быть представлена в виде металлопротеинов, углеводов (гликопротеинов), липидов (липопротеинов) и нуклеиновых кислот (нуклеопротеинов).Элементарная часть
Сами аминокислоты состоят из трех обязательных частей. Таким образом, можно сказать, что мономером белка является радикал, различающий между собой виды аминокислот, а также неизменяемые карбоксильная и амино- группы. По количеству входящих в состав карбоксильных и аминогрупп аминокислоты подразделяют на нейтральные, основные и кислые. Нейтральные имеют по одной карбоксильной и аминогруппе. В формуле основных содержится более одной аминогруппы, а в кислых аминокислотах, наоборот, имеется более чем одна карбоксильная группа.Аминокислоты — мономеры белков — амфотерные соединения, потому что из-за наличия карбоксо- и аминогрупп в растворе могут выступать и в качестве оснований, и в качестве кислот. В водном растворе представлены в качестве ионных форм.
Пептидная связь
Полипептид — так ученые называют белок: мономер его скрепляется с себе подобными с помощью пептидных связей. Пептиды являются продуктом реакции конденсации аминокислот. Взаимодействие карбоксильной и аминогрупп двух аминокислот характерно образованием ковалентной азот-углеродной связи, она и называется пептидной. Пептиды классифицируют по количеству остатков аминокислот, входящих в их состав: дипептиды, трипептиды, тетрапептиды и так далее. При многократном повторении образования ковалентной азот-углеродной связи образуются полипептиды. Один конец пептида содержит свободную аминогруппу и называется N-концом, второй — свободную карбоксильную группу и называется, соответственно, C-концом.Еще одна классификация
Как уже упоминалось выше, мономеры белков состоят из амино- и карбоксильной групп и радикала, которые образуют между собой прочные связи. Также могут присутствовать и другие вещества, однако именно от R-группы в основном зависят свойства всей молекулы, и существует еще один тип классификации. Какой? Мономеру белка свойственно иметь различные радикалы, по их типу и можно разделить все аминокислоты на гетероциклические, ароматические и алифатические. Алифатический радикал может содержать функциональные группы, которые придают особые свойства. Это амино-, карбоксильная, тиольная (-SH), гидроксильная (-OH), амидная (-C0-Nh3) и гуанидиновая группы.Разные радикалы
Мономер молекулы белка, содержащий аминогруппу, — это аминокислота пролин. Гетероциклические радикалы содержатся в составе триптофана и гистидина. Ароматический радикал присутствует в фенилаланине и тирозине. Дополнительная гидроксильная группа есть в серине и треонине; карбоксильная — в аспарагиновой и глутаминовой кислотах. Еще одна амидная группа в составе радикала имеется в аспарагине и глутамине (не путать с кислотами). Дополнительная аминогруппа есть у лизина, а гуанидиновая — в аргинине. Сера присутствует в радикалах цистеина и метионина.Организация молекул белка в пространстве
Каждый белок имеет специфические функции, которые зависят от пространственной организации молекул. К тому же поддержка белков в виде цепочки, то есть в развернутом виде, в энергетическом плане невыгодна для клетки, поэтому, так же как молекулы ДНК, цепи полипептидов подвергаются компактизации, за счет чего приобретают конформацию — трехмерную структуру.Пространственная организация белковых молекул имеет четыре уровня.
Так как мономерами молекул белков являются аминокислоты, то первичная структура представлена в виде полипептидной цепи, состоящей из аминокислотных остатков, которые объединены пептидной связью. Несмотря на кажущуюся простоту, именно первичная структура определяет, какую функцию сможет выполнять белок. Мономер в составе цепи должен быть на своем месте, замена даже одного из них изменит назначение всей молекулы. Например, если шестую глутаминовую кислоту в гемоглобине заменить на валин, вся молекула в целом перестанет функционировать, и транспорт кислорода будет нарушен. Такая замена приводит к развитию у человека серповидноклеточной анемии.
Если в составе полипротеина содержится десять аминокислотных остатков, то вариантов чередования мономеров будет очень много — 1020, если же будут присутствовать все 20, комбинаций, которые можно составить, станет еще больше. Организм человека синтезирует более десяти тысяч белков, которые отличаются не только по сравнению друг с другом, но и с белками других живых организмов.
Вторичная структура характерна упорядоченным свертыванием цепи в спираль, по внешнему виду напоминающую растянутую пружину. Связи, возникающие между мономерами белков, являются водородными и укрепляют структуру. Эти связи появляются между амино- и карбоксильными группами. Водородные связи слабее пептидных, но делают всю конфигурацию более жесткой и устойчивой за счет многократного повторения. Для некоторых белков, например фиброина (паутина, шелк), кератина (ногти и волосы) и коллагена, дальнейшей компактизации не происходит.
Третий уровень
На следующем уровне полипептидные цепи укладываются в глобулы, которые возникают из-за установки новых химических связей — дисульфидных, ионных, водородных. Также важным фактором является установка гидрофобного взаимодействия между R-группами аминокислотных остатков, именно гидрофильно-гидрофобным взаимодействиям отводится основная роль в факторе образования третичной структуры белковой молекулы.При попадании в водный раствор радикалы-гидрофобы стараются скрыться от воды путем группировки внутри глобул, а гидрофильные R-группы взаимодействуют с диполями воды (гидратация), напротив, оказываются на поверхности. Некоторые белки имеют дополнительную стабилизацию третичной структуры за счет дисульфидных ковалентных связей, которые возникают между двумя остатками цистеина за счет наличия атомов серы. На третичной структуре заканчивается компактизация белков-ферментов, антител и некоторых гормонов.
Четвертичная структура
Последняя степень компактизации присутствует в сложных белках, в составе которых имеется две и более глобул. Удерживание субъединиц происходит за счет ионных, гидрофобных и электростатических взаимодействий. Также возможно образование дисульфидных связей. Четвертичную структуру имеет белок гемоглобин, образованный двумя альфа-субъединицами, содержащими 141 аминокислотный остаток, и бета-субъединицами, в составе которых насчитывается 146 остатков. Каждая субъединица связана также с молекулой гема, в которой содержится железо.Свойства белков
Так как мономером молекулы белка является аминокислота, то именно от них, наряду со структурной организацией, зависят и свойства. Белки проявляют как кислотные, так и основные свойства, которые определяется R-группами аминокислот: если в составе больше основных аминокислот, то и основные свойства выражены ярче. Буферные свойства белков определяется способностью присоединять и отдавать протон (H+). Гемоглобин, содержащийся в эритроцитах, является одним из мощнейших буферов, помимо связывания кислорода он исполняет функции регуляции уровня pH крови.Существуют растворимые белки, например фибриноген, и нерастворимые, которые выполняют механические функции (например, коллаген, кератин, фиброин). Ферменты — это химически активные белки, и, в противовес им, есть и инертные полипептиды. Также выделяют белки, которые устойчивы или неустойчивы к воздействию внешних условий.
Денатурация
Такие внешние факторы, как ультрафиолетовое излучение, соли тяжелых металлов и сами металлы, обезвоживание, радиация, нагревание и изменение pH, могут привести к частичному или полному разрушению структурной организации белковой молекулы. Утрата трехмерной конструкции называется денатурацией. Ее причиной становится разрыв связей, которые придавали стабильность структуре молекулы. Первыми разрушаются слабые связи, а затем, в случае еще более жестких условий, рвутся даже сильные, именно поэтому сначала рушится четвертичная структура, и только после этого — третичная и вторичная.Когда пространственная конфигурация меняется, белок меняет и свои свойства, в результате чего больше не может выполнять свойственную ему биологическую задачу. Если при денатурации не произошло разрушение базовой, первичной структуры, то она обратима, и белок сможет провести процедуру самовосстановления — ренатурацию. В остальных же случаях денатурация необратима.
Защита и обмен веществ
Без участия белков в организме не происходит ни одного процесса. Их строительная функция заключается в участии в формировании внеклеточных и клеточных структур, они присутствуют в составе мембран клеток, волос, ногтей и сухожилий. Также выполняют и транспортную функцию: гемоглобин осуществляет перенос кислорода и углекислого газа, а белки мембран клеток активно и избирательно проводят перенос нужных веществ в клетку и из нее во внешнюю среду.Некоторые гормоны имеют белковую природу и участвуют в регуляции обмена веществ. К примеру, инсулин производит регулировку в крови уровня глюкозы, а наряду с этим способствует образованию гликогена и оптимизирует синтез жиров из углеводов.
Защитная функция белков состоит в образовании антител в случае, если организм атакован чужеродными белками и микроорганизмами. Антитела способны находить и обезвреживать их. При ранах и порезах из фибриногена образуется фибрин, который помогает остановить кровотечение.
Другие функции
Без белков невозможно движение: миозин и актин — сократительные белки, за счет которых обеспечивается работа мышц у животных.На белках лежит также и сигнальная функция. В клеточных мембранах содержатся белки, которые могут менять свою третичную структуру в зависимости от воздействия внешней среды. Это является основой приема и передачи в клетку сигналов из внешней среды.
Ни человек, ни животные не могут запасать белки (исключением является казеин молока и альбумин яиц), но белки способствуют накоплению в организме некоторых веществ. К примеру, во время распада гемоглобина железо не покидает организм, а образует комплекс с ферритином. Распад одного грамма белка дает организму и 17,6 кДж энергии, в этом заключается их энергетическая функция. Однако, как правило, организм «старается» не расходовать для этого такой важный материал, и сначала распадаются жиры и углеводы.
Одна из самых важных функций — каталитическая. Она обеспечивается ферментами, которые способны ускорять биохимические реакции в клетках.
www.nastroy.info
Сайт учителей биологии МБОУ Лицей № 2 города Воронежа
Органические вещества клетки. Белки
Белки — обязательная составная часть всех клеток. Они состоят из многих тысяч атомов.
Белки — это биополимеры, мономерами которых являются аминокислоты.
В клетках и тканях встречается свыше 170 различных аминокислот. В составе белков обнаруживается лишь 26 из них; обычными же компонентами белка можно считать лишь 20 аминокислот.
Молекула любой аминокислоты состоит из двух функциональных групп: аминогруппы (-NH2) и карбоксильной группы (-СООН), присоединённых к атому углерода, таким образом, аминокислоты обладают свойствами и кислот, и оснований. Вторая часть у всех аминокислот разная. Она называется радикалом (R).
Аминокислоты — это бесцветные кристаллические твердые вещества. Чистые аминокислоты, выделенные из белков, имеют сладкий вкус. Они растворяются в воде, а в органических растворителях нет. В нейтральных водных растворах проявляют свойства и кислот, и оснований. Прочие химические свойства зависят от радикала.
Белки всех живых организмов на Земле содержат одни и те же аминокислоты.
Биологическая роль аминокислот
| Функция | Пояснение |
|---|---|
| Структурная | Аминокислоты являются структурными звеньями пептидов и полипептидов. Белки всех живых организмов на Земле построены из 20 видов аминокислот. Некоторые аминокислоты и их производные входят в состав пуриновых и пиримидиновых оснований, коферментов, желчных кислот, антибиотиков и др. |
| Сигнальная | Некоторые из аминокислот являются нейромедиаторами или предшественниками медиаторов. |
Различают заменимые, незаменимые и условно заменимые аминокислоты.
Незаменимые аминокислоты — кислоты, которые не синтезируются клетками животных и человека и поступают в организм в составе белков пищи. Для разных животных набор незаменимых аминокислот неодинаков. Отсутствие или недостаток незаменимых аминокислот приводит к остановке роста, падению массы, нарушениям обмена веществ и к гибели организма. Для человека это изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Условно заменимые аминокислоты могут синтезироваться в организме из других аминокислот, например тирозин из фенилаланина, цистеин из метионина.
Заменимые аминокислоты способны синтезироваться в организме в достаточном количестве.
Стереохимия аминокислот. Для вcех молекул аминокислот, кpoмe глицина, характерно наличие оптических изомеров, то есть зеркально подобных форм молекул. Их называют L-аминокислотами и D-аминокислотами.
Руки человека — наиболее удобная модель для объяснения явления оптической изомерии: левая рука подобна правой, но не может быть совмещена с ней в пространстве путем перемещений и поворотов. Эта разница становится особенно заметной, если кто-то попытается надеть левую перчатку на правую руку.
Все аминoкиcлoты, составляющие природные белки, oтноcятcя к L-ряду.
Белки, или протеины (греч. protos — первый) — высокомолекулярные органические вещества, полимерные молекулы которых состоят из соединенных в цепочку аминокислот.
Молекулы белка — гетерополимеры линейного строения, мономерами которых являются 20 видов аминокислот. Если молекулы белка содержат весь набор аминокислот, то такой белок называется полноценным; если какие-то аминокислоты отсутствуют в составе белковых молекул, то неполноценным.
Если белки состоят только из аминокислот, то их называют простыми; если они содержат еще и неаминокислотный компонент (простетическую группу), то их называют сложными.
Белковые молекулы могут сворачиваться, образуя клубок (глобулу), или формировать вытянутую нитевидную структуру (фибриллу).
Структуры белковых молекул
Для молекул белков характерно существование нескольких структурных уровней, которые зависят как от химического состава аминокислот, их числа и порядка соединения друг с другом, типа связи, обеспечивающей образование определённого уровня, так и от состава окружающей среды.
Первичную структуру белков определяет последовательность аминокислот. Она образована очень прочными ковалентными связями, названными пептидными. Отсюда и название белков — пептиды. Эти связи образуются в результате выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой.
Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая связь — пептидной связью. Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид. На одном конце его молекулы находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединить к себе другие аминокислоты.
Аминокислотная последовательность белка определяет его биологическую функцию. Замена одной кислоты в молекулах данного белка может резко изменить его функцию.
Замена одной-единственной аминокислоты может резко изменить эту функцию. Например, замена в β-субъединице гемоглобина шестой аминокислоты — глутаминовой кислоты — на валин приводит к тому, что молекула гемоглобина не может выполнять свою основную функцию — транспорт кислорода. Такой патологический гемоглобин содержится в крови больных серповидноклеточной анемией.
Первой была открыта первичная структура гормона поджелудочной железы инсулина Ф. Сэнгером в 1949 — 1954 годах. К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков.
Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется особая форма записи аминокислотной последовательности в полипептидных цепях: с помощью сокращенных трехбуквенных символов — названий аминокислот. Например,
Ала-Тре-Цис-Ала-Ала-Вал-Иле-Глу-Вал-Глн-Про-Арг-Про-Вал-Гли.
При этом предполагается, что аминогруппа находится слева, а карбоксильная группа — справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки — соответственно N-концевым и С-концевым остатками.
Вторичная структура поддерживается водородными связями между группами СО и NH и может быть представлена α-спиралью и β-слоем.
Во вторичной структуре NH-группа находится на одном витке, а СО — на соседнем. Аминокислотные радикалы остаются при этом снаружи спирали.
В образовании 5 витков спирали участвуют 18 аминокислотных остатков; таким образом, на один виток спирали приходится 3,6 аминокислотных остатка.
Такая регулярная спиральная структура возникает благодаря периодически чередующимся карбоксильным группам и аминогруппам в аминокислотной последовательности, которые образуют между собой водородные связи.
Практически все СО- и NH-группы полипептидной цепочки принимают участие в образовании водородных связей, и, благодаря тому, что связи повторяются многократно, они придают данной конфигурации стабильность.
Полностью α-спиральную вторичную структуру имеет нитевидный белок кератин. Это структурный белок волос, шерсти, ногтей, когтей, клюва, перьев, копыт и рогов, входящий также в состав кожи позвоночных.
Другой тип вторичной структуры (β-слой) — складчатый у белка фиброина, выделяемого шелкоотделительными железами гусениц шелкопряда при завивке коконов, — представлен целиком именно этой формой. Благодаря этому фиброин обладает высокой прочностью и не поддаётся растяжению, но делает шёлк очень гибким.
Третий тип вторичной структуры имеет белок коллаген. Здесь три полипептидные цепи свиты вместе. Такой белок тоже невозможно растянуть, что очень важно, так как он образует сухожилия, костную ткань и другие виды соединительных тканей.
Все эти белки представляют собой исключение среди прочих белков. Если рядом окажутся две молекулы цистеина, содержащие серу, то между ними образуется дисульфидный мостик (S-S связи).
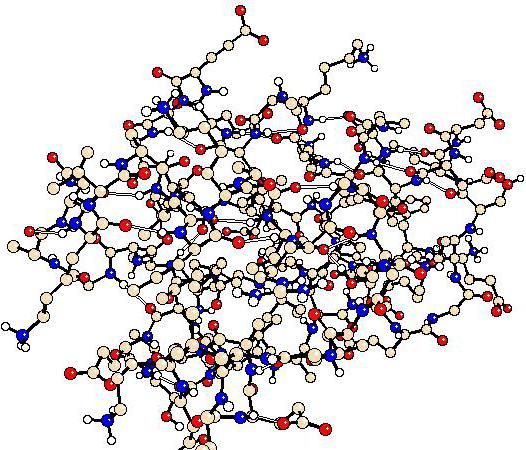
Третичная структура формируется у большинства белков за счёт свёртывания особым образом полипептидной спирали белка в компактную глобулу, т. е. шарообразную структуру. Третичную структуру поддерживают пептидные, водородные, дисульфидные связи, а также гидрофобные.
Гидрофобные связи возникают между радикалами гидрофобных аминокислот. Эти связи слабее водородных. В водной среде в клетке гидрофобные радикалы отталкиваются от воды и слипаются друг с другом. Водная среда как бы принуждает белковую молекулу принять определённую упорядоченную структуру, и она становится биологически активной. Третичная структура не является высшей формой структурной организации белка.
В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков:
1. Глобулярные белки. Пространственная структура этих белков в грубом приближении может быть представлена в виде шара — глобулы. Глобулярную форму молекулы имеют иммуноглобулины, гормоны (например, инсулин), компоненты мембран и рибосом. К глобулярным белкам относятся почти все из более чем 2000 известных ферментов. Некоторые глобулярные белки выполняют транспортные функции: вместе с током крови они переносят кислород, питательные вещества и неорганические ионы.
2. Фибриллярные белки. Эти белки имеют вытянутую нитевидную форму. Они, как правило, выполняют в организме структурную или двигательную функции. Например, кератин, который построен из протяженных спиралей, уложенных параллельно друг другу и стабилизированных водородными связями, или коллаген, молекула которого состоит из трех полипептидных цепей.
В живой клетке обнаружено много белков, имеющих ещё более сложную структуру, например четвертичную.
Четвертичная структура белковой молекулы — это объединение нескольких (двух и более) глобул в единый комплекс за счет гидрофильно-гидрофобных взаимодействий, а также при помощи водородных и ионных связей.
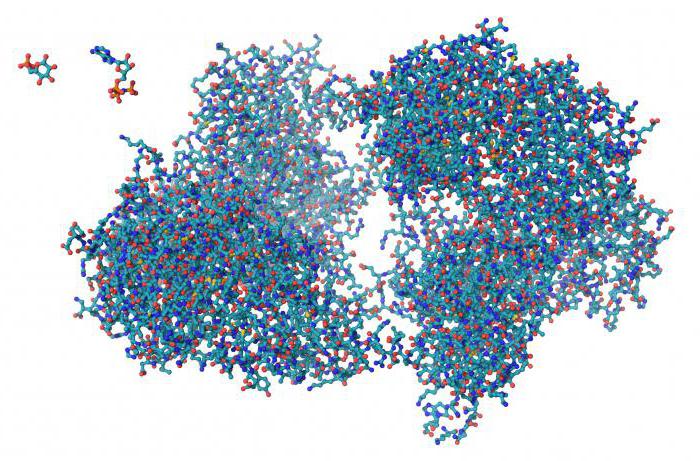
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, различающихся по первичной структуре. Объединяясь, они создают сложный белок. Например, молекула гемоглобина состоит из четырёх отдельных полипептидных цепей разных типов.
Отдельные глобулы называются субъединицами и обозначаются буквами греческого алфавита. У гемоглобина, например, имеется по две α и β субъединицы. Наличие нескольких субъединиц важно в функциональном отношении — это увеличивает степень насыщения кислородом. Четвертичную структуру гемоглобина обозначают как α2 β2.
Белки, состоящие из нескольких субъединиц, широко распространены в природе. Четвертичная структура молекулы свойственна, например, большинству ферментов.
У животных, растений, микроорганизмов были извлечены и изучены тысячи разных белков. Поражает разнообразие физических и химических свойств белков, что обусловлено их различным аминокислотным составом.
< Предыдущая страница «Углеводы»
Следующая страница «Основные свойства и функции белков» >
biolicey2vrn.ru

