Получение металлов. Нахождение их в природе
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки. Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг. Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.

А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.

Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na+, K+, Mg2+, Ca2+ в организме человека приходится 99% всех ионов металлов.

К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.

В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
|
Название |
Химический состав |
|
Красный железняк (гематит) |
Fe2O3 |
|
Магнитный железняк (магнетит) |
Fe3O4 |
|
Бурый железняк |
2Fe2O3 · 3H2O |
|
Железный колчедан (пирит) |
FeS2 |
|
Сильвин |
KCl |
|
Криолит |
Na3AlF6 |
|
Кальцит |
CaCO3 |
|
Корунд |
Al2O3 |
|
Малахит |
(CuOH)2CO3 |
|
|
CuFeS2 |
|
Киноварь |
HgS |
|
Гипс |
CaSO4 · 2H2 |
|
Свинцовый блеск (галенит) |
PbS |
|
Цинковая обманка |
ZnS |













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки, густо усеивающие дно. Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой». В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.
Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской,
магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.

При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
2Fe2O3 + 3C = 4Fe + 3CO2
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
Fe2O3 + 3CO = 2Fe + 3CO2
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м3. Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.
C + O2 = CO2

доменная печь
Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
CO2 + C = 2CO
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.

Конвертер
Для получения некоторых металлов в качестве восстановителя используют водород.
WO3 + 3H2 = W + 3H2O

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:
Fe2O3 + 2Al = 2Fe + Al2O3

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.

Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.

При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
videouroki.net
Металлы в природе. Видеоурок. Химия 8 Класс
Тема: Вещества и их превращения
Урок: Металлы в природе
Некоторые металлы могут встречаться в природе в самородном состоянии (т.е. в виде простых веществ). Таких металлов очень немного. Вы, наверное, уже догадались, что в виде простых веществ в природе встречаются золото, серебро, медь, платина, ртуть и некоторые другие металлы. Самым большим в России из найденных самородков золота был «Большой треугольник», масса которого составляла 36 кг. Но серебро, медь и ртуть могут встречаться в природе как в самородном состоянии, так и в виде соединений.




Рис. 1. Самородные металлы: золото, платина, медь, серебро
Многие химические элементы, образующие простые вещества металлы, находятся в природе в виде соединений. Такие вещества называют минералами. Минералы, пригодные для получения металлов, называют рудами. Если состав руды входит железо, то она называются железной рудой, если медь – медной и т.д.
Наиболее распространены в природе оксиды и сульфиды металлов (соединения металлов с кислородом и серой).
Самым распространенным в земной коре элементом, образующим простое вещество металл, является алюминий. Его массовая доля составляет 8,2%. Одним из минералов, содержащим алюминий, является корунд. Он очень твердый, поэтому используется для изготовления наждачной бумаги. Химическая формула корунда Al2O3.
Оксид алюминия входит в состав некоторых драгоценных камней, например, рубина и сапфира. Алюминий также содержатся в глине.


Рис. 2. Минералы, содержащие алюминий: боксит, корунд
Железо – второй по распространенности металл. В самородном виде встречается крайне редко: только в составе метеоритных камней. Важнейшие природные соединения железа:
Fe3O4 – магнитный железняк
Fe2O3 – красный железняк
Fe2O3·H2O – бурый железняк
(Точка между двумя частями формулы означает, что оксид железа (III) и вода образуют сложное кристаллическое вещество и разделить их физическими методами невозможно.)
FeS2 – пирит



Рис. 3. Железные руды: магнитный железняк, красный железняк, бурый железняк
Кальций, натрий, калий, магний – следующие по распространенности металлы в земной коре.
Кальций и магний образуют карбонатные минералы (например, кальцит CaCO3, магнезит MgCO3). Кальций входит в состав гипса. Его формула СаSO4·2H2O.
Натрий и калий образуют растворимые в воде минералы. Например, поваренную соль (галит) NaCl, сильвин – KCl, сильвинит KCl·NaCl (Рис. 4 )

Рис. 4. Растворимые в воде минералы (слева направо): галит, сильвин, сильвинит
Растворимые в воде соединения натрия, калия, кальция и магния входят в состав морской воды.
Список рекомендованной литературы
1. Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: Часть I. – М.: Школьная Пресса, 2002. (с.40-42)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 50-53)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2012. (§19)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§20)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Тесты по химии (он-лайн) (Источник).
Домашнее задание
с. 52 №№ 3,7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Нахождение металлов в природе общие способы их получения
Класс: 9
Предмет: Химия
Тема: Нахождение металлов в природе общие способы их получения
Цели: познакомить учащихся с распространением металлических элементов и их соединений в природе; охарактеризовать основные способы получение металлов; продолжить у учащихся умение составлять уравнения УВР.
Ход урока
Организационный момент
Приветствие, настрой на активную работу.
Проверка д/з. Актуализация опорных знаний.
Проходит в виде беседы.
Какие вещества называются металлами?
Раскройте особенности строения атомов металла и природу химической связи между ними в соединении.
Почему металлы имеют такие свойства, как ковкость и пластичность?
Изучение нового материала
Нахождение металлов в природе
В земной коре содержатся такие металлы: Al –8,2%, Fe – 4,1%, Ca – 4,1%, Na – 2,3%, Mg— 2,3%, K – 2,1%, Ti – 0,56%.
В морской воде содержится большое количество Na(1,05%) и Mg(0,12%).
В природе встречаются металлы, как в свободном виде, так и в связанном.
— в свободном виде: золото, серебро, платина, медь, ртуть.
— в виде оксидов: магнетит — Fe3O4, гематит — Fe2O3
— в виде смешанных оксидов: каомин Al2O3*2SiO2*2H2O
— в виде разных солей: сильвин — KCl, сильвинит — KCl*NaCl , барит — BaSO4, мрамор — CaCO3, апатит — Ca3(PO4)2
Общие способы получения металлов
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для их получения в виде простого вещества, необходимо провести процесс восстановления.
Но прежде, чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для восстановления. Например, оксидную форму.
На этом основан пирометаллургический способ.
Пирометаллургический способ – это восстановление металлов из их руд при высоких температурах.
Водородотермия – получение меди с оксида с помощью водорода:
Cu2+O + H2 = Cu0 + H2O
Алюмотермия – получение железа с оксида при помощи алюминия:
Fe23+O3 + 2Al = 2Fe0 + Al2O3
Гидрометаллургический способ основан на растворении природного вещества с целью получения соли этого металла и вытеснения этого металла более активным. Этим способом получают серебро, золото, цинк и др.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
Электрометаллургический способ – это способ получения металлов с помощью электрического тока (электролиз). Этим способом получают алюминий, щелочные и щелочноземельные металлы.
NaCl →Na+ + Cl—
K(-): Na+ +1ē →Na0 │2
A(+): 2Cl — 2ē → Cl02 │1
Общее уравнение: 2NaCl = 2Na + Cl2
Закрепление полученных знаний
Расставьте коэффициенты методом электронного баланса
FeCl2 + O2 + HCl → FeCl3 + H2O
В раствор хлорида меди (11) поместили цинковую пластинку. В реакцию вступил цинк массой 26 г. Вычислите, сколько грамм меди осело на пластинку.
Домашнее задание
Подведение итогов урока. Рефлексия.
Учитель предлагает учащимся внимательно прочитать слова, приготовленные на доске (раздражительность, злость, безразличие, удовольствие, вдохновение, скука, тревожность, спокойствие, уверенность, наслаждение), и выбрать из них три слова, которые более точно передают их состояние на этом уроке.
infourok.ru
Нахождение металлов в природе — Студопедия.Нет
В природе металлы находятся, как правило, в виде различных соединений (солей, оксидов, гидроксидов), но встречаются и в самородном состоянии (золото, платина). Встречаются руды сульфидные, карбонатные, оксидные и др., содержащие соответствующее соединение металла или, чаще, их смесь.
Например, встречаются следующие минералы:
Оксиды: TiO2 – рутил, Fe2O3 ·2H2O – железняк, Al2O3∙ 2H2O – бокситы.
Сульфиды: Fe2S – железный колчедан, ZnS – сфалерит, PbS – галенит.
Сульфаты: CaSO4 ·2H2O – гипс (строительный материал).
Карбонаты: CaCO3·Mg CO3 – доломит.
Физические свойства металлов
Все металлы, за исключением ртути, – твердые кристаллические вещества с характерным металлическим блеском. Металлы обладают различной твердостью: одни металлы очень мягкие и легко режутся ножом (натрий, калий), другие — очень твердые и приближаются по твердости к алмазу (хром).
Металлы хорошо проводят тепло, электричество, они упруги, пластичны. Все эти свойства металлов объясняются наличием определенного строения их кристаллических решеток, наличием обобществленных валентных электронов, осуществляющих прочную (металлическую связь) в металлических решетках.
Наличие свободных электронов во всех металлических структурах обуславливает существование общих свойств металлов и объясняет их.
1. Электропроводность. Поскольку обобществленные валентные электроны не связаны с определенными катионами, то под действием уже небольшой разности потенциалов электроны начинают перемещаться от + к – , поэтому возникает электрический ток.
С увеличением температуры электропроводность уменьшается, так как с повышением температуры возрастает амплитуда колебаний катионов, что затрудняет перемещение электронов между ними. С уменьшением температуры электропроводность резко возрастает (сверхпроводимость при абсолютном нуле).
2. Теплопроводность металлов высокая, что объясняется наличием свободных электронов (аналогично электропроводности).
3. Прекрасная ковкость (пластичность) металлов объясняется легкостью скольжения одних слоев катионов относительно других. Вместе с ними перераспределяются и связывающие их электроны, поэтому разрыва металлической связи не происходит. Если взять неметалл, например серу кристаллическую, ударить ее молотком, то кристалл будет крошиться на мелкие кусочки, так как в сере электроны закреплены за конкретными атомами и если произойдет их сдвиг, то получается разрыв связи (ковалентной).
На пластичность металлов большое влияние оказывают примеси, которые уменьшают свободу перемещения электронов и уменьшают пластичность.
4. Температура кипения и температура плавления зависят от структуры металла. Чем прочнее металлическая решетка (металлическая связь), тем прочнее металл, выше температура кипения и плавления.
Химические свойства металлов
7.5.1. Восстановительные свойства металлов
В химических реакциях металлы в большинстве случаев являются восстановителями, т. е. отдают свои валентные электроны. Но по своей восстановительной способности металлы различны.
А. Щелочные металлы являются самыми сильными восстановителями, они легко отдают свой единственный валентный электрон.
Б. Благородные металлы очень трудно отдают свои электроны, их восстановительная способность очень мала и очень низка химическая активность. Их ионы легко присоединяют к себе электроны от более активных металлов, т. е. являются окислителями.
В. Остальные металлы по восстановительной способности лежат между вышеуказанными группами металлов.
7.5.2. Взаимодействие металлов с водой
Щелочные металлы легко взаимодействуют с водой при обычных условиях, вытесняя водород из Н2О:
Li + 2Н2О = 2LiOН + H2,
Li0 —  ® Li+ – восстановитель Li,
® Li+ – восстановитель Li,
2H+ + 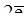 ® H2 – окислитель Н+.
® H2 – окислитель Н+.
Щелочно-земельные металлы менее химически активны и взаимодействуют с водой при нагревании, при повышенном давлении.
Остальные металлы с водой практически не взаимодействуют.
7.5.3. Взаимодействие металлов с кислотами
Характер взаимодействия металлов с кислотами зависит от следующих факторов:
1. От типа кислоты.
2. От концентрации кислоты.
3. От активности металла.
Взаимодействие металлов с бескислородными кислотами
При действии бескислородных кислот (HCl, HF, H2S, HBr), независимо от концентрации, происходит образование соли данного металла и выделение водорода. Ионы водорода выступают в качестве окислителя:
Mg + 2HCl = MgCl2 + H2,
Mg0 — 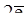 ® Mg+2 – восстановитель Mg0,
® Mg+2 – восстановитель Mg0,
2H+ + 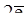 ® H2 – окислитель Н+.
® H2 – окислитель Н+.
Взаимодействие металлов c серной кислотой
А. Разбавленная серная кислота. Происходит образование соли металла и выделяется водород. В качестве окислителя в разбавленной серной кислоте выступают ионы водорода:
Fe + H2SO4(разб.) = Fe SO4 + H2,
Fe — 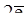 ® Fe+2 – восстановитель Fe0,
® Fe+2 – восстановитель Fe0,
2H+ + 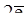 ® H2 – окислитель Н+.
® H2 – окислитель Н+.
Б. Концентрированная серная кислота. Происходит образование соли данного металла, воды и выделяется газообразный диоксид серы SO2. В качестве окислителя выступают ионы кислотного остатка SO42— (S+6):
Cu + 2 H2SO4 = CuSO4 + H2O + SO2,
Cu0 — 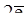 ® Cu+2 – восстановитель Cu,
® Cu+2 – восстановитель Cu,
S+6 + 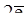 = S+4 – окислитель S+6.
= S+4 – окислитель S+6.
Взаимодействие металлов с азотной кислотой
Происходит образование соли данного металла, воды, а также одного из соединений: NH3, NH4NO3, N2O, NO, N2. Это зависит от концентрации кислоты и активности металла:
4Mg + 10HN+5O3(разб.) = 4Mg(NO3)2 + N-3H4NO3 + 3H2O,
Mg0 — 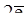 ® Mg+2 – восстановитель Mg0,
® Mg+2 – восстановитель Mg0,
N+5 + ® N—3 – окислитель N+5.
Концентрированная азотная кислота. Происходит образование соли данного металла, воды и выделяется газообразный диоксид азота NO2:
Ag + 2HNO3(конц.) = Ag+NO3 + H2O + NO2,
Ag0 —  ®Ag+ – восстановитель Ag0,
®Ag+ – восстановитель Ag0,
N+5 +  ® N+4 – окислитель N+5.
® N+4 – окислитель N+5.
Концентрированная азотная кислота и концентрированная серная кислота пассивируют при комнатной температуре железо, хром, алюминий и другие малоактивные металлы (за исключением меди). При этом на поверхности металла образуется защитная пленка, препятствующая его дальнейшему разрушению.
Взаимодействие металлов со щелочами
Со щелочами взаимодействуют только те металлы, оксиды и гидроксиды которых обладают амфотерными свойствами. Происходит образование комплексной соли металла и выделяется газообразный водород из щелочи:
2NaOH + Zn0 + 2H2O = Na2[Zn+2(OH)4] + H20,
или
2NaOH + Zn0 Na2ZnO2 + H20,
Na2ZnO2 + H20,
Zn0 — 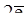 ® Zn+2,
® Zn+2,
2H+ + 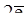 ® H20.
® H20.
7.5.4. Взаимодействие металлов с неметаллами
В результате возможно образование следующих типов соединений:
MexOy – оксиды. Все металлы, за исключением благородных, непосредственно соединяются с кислородом (при различных температурах).
MexCy – карбиды. Их получают нагреванием порошкообразных металлов с углеродом или парами углеводородов. Карбиды имеют очень высокую температуру плавления и большую твердость (8-9 ед.). Самую высокую твердость, равную 10 ед., имеет алмаз.
MexNy – нитриды. Образуются при нагревании металлов с азотом или аммиаком, обладают высокой твердостью, высокими температурами плавления, проявляют огнеупорные свойства.
MexHy – гидриды. Получаются при нагревании металлов с водородом. Гидриды металлов III группы имеют полимерную структуру. Гидриды d-металлов имеют нестехиометрический состав (гидриды внедрения).
Возможно образование и других соединений металлов с другими неметаллами.
Получение металлов из руд
Различные виды встречающегося в природе минерального сырья, пригодного для получения металлов в промышленном масштабе, называются рудами.
В основе всех методов выделения металлов из руд лежит восстановление их по схеме:
Me+n +  ® Me0,
® Me0,
где n – валентность металла.
В качестве восстановителя применяют графит, оксид углерода СО, водород, активные металлы, электрический ток и др.
7.6.1. Способы получения металлов
Существуют следующие способы получения металлов из руд.
1. Пирометаллургические:
а) карботермический;
б) металлотермический.
2. Электрометаллургические.
3. Гидрометаллургические.
1. Пирометаллургический способ заключается в применении высоких температур в процессе восстановления металла.
Карботермический способ – восстановление оксидов металлов углеродом или оксидом углерода СО при высоких температурах:
 .
.
В доменных печах в качестве восстановителя применяют оксид углерода (II)СО:
 .
.
Металлотермический – в качестве восстановителей применяют более активные металлы при высоких температурах (Al, Mg, Ca и др.). Этим методом получают титан, уран, ванадий:
 .
.
Если в качестве восстановителя применяют алюминий, то этот метод получил название алюмотермии:
 .
.
Электрометаллургия – технология, основанная на применении электрической энергии для восстановления металлов.
Такие активные металлы, как K, Na, Са, Mg, Al и др., получают электролизом расплавов их соединений. Например, при электролизе расплава хлорида натрия получают металлический натрий и газообразный хлор. Расплав соли NaCl, анод С (графит):
(-) К Na+ + 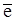 ® Na0, восстановление,
® Na0, восстановление,
(+) А 2Cl— —  ® Cl2, окисление.
® Cl2, окисление.
Гидрометаллургия – технология, осуществляющая получение металлов из руд с помощью водных растворов специальных реагентов (кислот, щелочей, солей), которые переводят металлы из нерастворимого в руде состояния в водорастворимое. Далее металл из водных растворов выделяют либо восстановлением его более активным металлом, либо электролизом (если металл неактивный), либо экстракцией органическими соединениями.
Например, рассмотрим получение меди:
CuO¯ (т) + H2SO4(ж) = CuSO4(ж) + H2O(ж).
Из полученного раствора медь можно выделить восстановлением железом:
CuSO4 + Fe = Cu + FeSO4.
7.6.2. Получение металлов высокой степени чистоты
С повышением чистоты металлов значительно улучшаются их характеристики. Они становятся более пластичными, тепло- и электропроводными, труднее подвергаются коррозии и т. д.
Получение металлов высокой чистоты представляет собой очень сложную задачу, решенную далеко не для всех металлов. Существует ряд методов очистки, рассмотрим некоторые из них.
1. Вакуумная плавка – металл расплавляют в вакууме, что позволяет избавиться от ряда легколетучих и легкоплавких примесей различных металлов, неметаллов, газов.
Этот метод дает не очень большую степень чистоты металлов.
2. Термическое разложение йодидов металлов.
Метод применяют для очистки очень тугоплавких металлов, образующих летучие соединения с йодом, таких, как цирконий, титан, хром и др. Очищаемый металл помещают в тигель и добавляют йод. При нагревании происходит взаимодействие металла с йодом. При этом образуется летучий йодид металла (например, TiJ4). Под действием высокой температуры он разлагается по уравнению
TiJ4 ® Ti + 2J2.
В реакции выделяется чистый металл, а йод улавливается и снова возвращается в процесс.
Данный метод позволяет селективно выделять отдельные металлы из их смесей, получать металлы достаточно высокой степени чистоты.
3. Зонная плавка. Метод позволяет получать металлы очень высокой степени чистоты.
Слиток металла в виде стержня, помещенного в тигель, передвигают с малой скоростью (5-10 мм/ч) через электропечь. При этом расплавляется очень небольшой участок слитка, находящийся в зоне нагрева в данный момент. По мере передвижения тигля со слитком расплавленная зона перемещается от одного конца слитка к другому.
Процесс очистки основан на том, что растворимость примесей в жидкой фазе значительно выше, чем в твердой. При медленном перемещении слитка, а следовательно, зоны расплава вдоль слитка, примеси извлекаются расплавленной зоной и перемещаются в конец слитка.
При многократном повторении описанного процесса получают металл высокой степени чистоты. Примеси, собравшиеся в одном конце слитка, отрезают и подвергают дальнейшей очистке.
Вопросы для самоподготовки
Каковы особенности электронной структуры металлов?
К каким электронным семействам элементов они относятся?
Как изменяются металлические свойства элементов по периодам и группам?
Предскажите возможные степени окисления металлов, исходя из положения их в таблице Д. И. Менделеева.
Какие металлы входят в восьмерку самых распространенных химических элементов?
В каком виде встречаются металлы в природе?
Какие вы знаете способы получения металлов?
Как связать уникальные физические свойства металлов с их электронной структурой?
Из каких процессов складывается химическое поведение металлов?
В чем особенности взаимодействия металлов с кислотами-окислителями типа азотной и серной?
studopedia.net
«Металлы в природе. Общие способы их получения»
Цель урока. Познакомить учащихся с природными соединениями металлов и с самородными металлами. Сформировать понятие о минералах, рудах и металлургии и ее разновидностях – пиро-, гидро- и электрометаллургии.
Образовательные задачи:
- применение обобщения знаний, умений и навыков в новых условиях – создание проблемной ситуации;
- контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
- уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
- уметь устанавливать причинно-следственные связи между «составом», «химическими свойствами», «получением металла».
Развивающие задачи:
- развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
- развитие логического мышления, внимания и умения работать в проблемной ситуации.
Воспитательные задачи:
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Оборудование: коллекция руд железа, алюминия, мел, железо, раствор сульфата меди, таблицы «Доменный процесс», « Доменная печь», «Процессы выплавки стали в конвертере, в дуговой печи», «Электрохимическое получение алюминия», фарфоровая ступка, компас.
Оформление и наглядность: таблица размещается на доске.
План урока
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Изучение новой темы.
4. Закрепление.
5. Домашнее задание.
ХОД УРОКА
I. Организационный момент
Проверяется готовность к уроку, раздаются листы с тестом (Приложение 2), инструкции для выполнения лабораторной работы (Приложение 4), лотки с демонстрационным материалом – коллекция оксидных руд железа, план урока (Приложение 1), лист наблюдений (Приложение 4), объявляются этапы урока.
Вступительное слово учителя. На этом уроке мы будем рассматривать новую тему «Металлы в природе. Общие способы их получения». Для этого нам нужно вспомнить материал, который мы уже прошли в темах «Химические свойства металлов», «Сплавы». Сейчас мы выполним тест по этим темам.
II. Промежуточный контроль знаний по темам «Химические свойства металлов», «Сплавы»
Учащиеся выполняют тест – 5 минут (Приложение 2). После того, как учащиеся выполнят тест, необходимо обменяться вариантами, проверить работу соседа и поставить оценку, затем тесты передать на проверку учителю. Учитель просит класс поднять руки, кто написал тест на 5 или 4 балла. На закрытой доске открывают заранее подготовленные ответы теста для самопроверки.
III. Изучение новой темы
Объяснение учителя с опорой на знания учеников. Весь материал разбит на три блока, каждый включает актуализацию темы, объяснение нового материала, закрепление.
Объяснение учителя. В повседневной жизни нас окружает множество металлических изделий. Мы с вами познакомились с физическими, химическими свойствами металлов, а также со сплавами, которые образуют эти металлы, но до сих пор нам ничего неизвестно в каком виде встречаются металлы в природе, как их получают и как это связано с химическими свойствами металлов. На этом уроке мы рассмотрим эти увлекательные вопросы. Для того чтобы изучать материал было легче, мы разделим тему на несколько составляющих тем.
1. Металлы в природе
Актуализация знаний.
1.Что такое электрохимический ряд напряжений? (Это
ряд металлов, расположенных в зависимости от их
восстановительной способности.)
2. Что такое восстановительная способность
металлов? (Это способность атомов металлов
отдавать электроны в химических реакциях.)
3. Как изменяется восстановительная способность
металлов в электрохимическом ряду напряжений? (В
электрохимическом ряду напряжений слева направо
восстановительная способность атомов
металлов уменьшается).
Новый материал
Сегодня мы рассмотрим не только нахождение
металлов в природе, но и, как связаны между собой
химическая активность металлов и нахождение
металлов в природе.
Объяснение учителя, заполнение таблицы на доске,
сопровождающееся объяснением учителя с опорой
на знания учеников, и в тетрадях. Демонстрация
слайдов №1, №3-10 (тема «Получение металлов»)
Таблица № 1
Природные соединения алюминия
| Форма, в которой металлы встречаются в природе | В свободном виде | В самородном виде, и в форме соединений | В виде соединений |
| Примеры металлов | Золото Au | Серебро Ag | Литий Li |
| Платина Pt | Медь Cu | Натрий Na | |
| Ртуть Hg | Кальций Ca | ||
| Олово Sn | Алюминий Al |
*Место металла в 2-й, 3-й, или 4-й колонках определяется учениками, после рассмотрения образцов на слайдах коллекции.
Коллективное устное обсуждение таблицы с классом
Природные химические соединения металлов
называют минералами. минералы, содержащие в
количествах. пригодных для получения в
промышленности, называют рудами.
На основании вышесказанного можно составить
следующий логический ряд, указывая ключевые
слова. Один ученик работает у доски с помощью
учителя, класс записывает в тетради
«Формы существования металлов в природе»
Металл ––> минерал
––> руды
Природное Природное
химическое
химическое соединение, содержащее
металл в количествах,
соединение
пригодных
Составим еще одну классификацию природных соединений металлов по признаку принадлежности минералов к одному из классов неорганических соединений
Минералы, руды
| Оксиды | |
| Соли |
Таблица заполняется учениками по учебнику [2], работа в парах. Затем проверяется – вызванный ученик зачитывает свой вариант, и учитель предлагает классу составить третью классификацию природных соединений металлов по кислотному остатку минералов, заполнить вторую колонку таблицы № 2, работа в парах. Затем учитель вызывает пару учеников, которые зачитывают свой вариант, и обсуждают его с классом. (Приложение 3)
Закрепление темы
1. Назовите, в каком виде встречаются металлы в
природе? (Металлы встречаются в природе как
в чистом виде. так и виде соединений)
2. Как это связано с химической активностью
металлов? (Малоактивные металлы
встречаются в свободном виде: золото, платина;
более активные металлы встречаются как в
самородном виде, так и в соединениях – серебро –
олово; активные металлы – от олова до лития
встречаются только в виде соединений)
3. Какая таблица отражает эти закономерности
нахождения металлов в природе?
(Электрохимический ряд напряжения металлов.)
2. Металлургия – наука и отрасль промышленности, изучающая получение металлов из руд
Актуализация знаний
1. Что такое руды? (Руды – это минералы,
содержащие металл в количествах, достаточных для
получения его в промышленности.)
2. Какие руды вам известны? (Руды бывают
оксидные, сульфидные, карбонаты, сульфаты,
хлориды, нитраты.)
Новый материал
Объяснения учителя с опорой на знания учеников
– Ребята, как вы думаете, из каких руд легче
всего получить металл в чистом виде и почему?
Наиболее пригодны для получения металлов
оксидные руды, затем сульфидные, следующие
карбонатные руды и сульфаты. Например, железо
получают именно из оксидных руд, поэтому такие
руды имеют наибольшее значение. Следующими
считаются сульфидные руды железа. Среди
оксидных руд железа наиболее удобен для
переработки магнитный железняк Fe3O4, так как там
наибольший процент содержания железа по
сравнению с другими образцами.
Учащиеся рассматривают коллекцию руд железа
(работа в группах), выполняют по инструкции (Приложение 4)
исследование физических свойств руд железа,
записывают результаты в лист наблюдений,
предварительно обсудив в группе. Работа в
группах, с распределением функций участников:
руководитель, выполняющий эксперименты, ученик,
который ведет протокол, то есть пишет уравнения
реакций и наблюдения. В процессе выполнения
работы в группе коллективно выставляют каждому
оценку. Результаты обсуждаются в классе
Лабораторная работа «Исследование физических свойств оксидных руд железа»
| Наименование руды, формула рудообразующего оксида железа | Окраска и блеск | Цвет черты на фарфоре | Магнитные свойства |
| 1. Магнитный железняк Fe3O4 | Темно-серый металлический блеск | Черная | Магнитные свойства |
| 2. Красный железняк Fe2O3 | Красный | Красная или красно-бурая | Слабомагнитные свойства |
| 3. Бурый железняк Fe2O3*nH2O | Бурый | Бурая | Не обладает магнитными свойствами |
*Текст, выделенный темным шрифтом, заполняется учащимися
Закрепление темы
1. Какие руды наиболее пригодны для получения
металлов? (Наиболее удобны для получения
металлов оксидные руды, затем сульфидные,
карбонатные, сульфатные)
2. Какая руда железа и почему, из рассмотренных
в лабораторной работе, наиболее пригодна для
промышленной обработки? (Магнитный железняк,
так как в нем в нем самый высокий процент
содержания железа)
3. Общие способы получения металлов, сопровождающие их химические процессы
Актуализация знаний
1. Написать схему восстановления металлов из
ионов. (Me+n + ne ––> Me0)
2. Что такое чугун? (Чугун – сплав на основе
железа, содержащий от 2 – 4,5 %% углерода, а также
марганец, кремний, фосфор и серу)
3. Что такое сталь? (Сталь – сплав на основе
железа, содержащий не менее 2% углерода)
Новый материал
Объяснение учителя, демонстрация
химических реакций, параллельно запись реакций в
тетрадь, на доске учениками с помощью учителя.
В зависимости от способа извлечения металла из
руды выделяют следующие виды металлургических
процессов
Схема
1. Электрометаллургия – выделение металлов из их солей и оксидов плд действием электрического тока
NaCl электролиз ––> 2Na + Cl2
Демонстрация слайда №2 (тема «Получение металлов»)
2. Гидрометаллургия – методы получения металлов, основанные на химических реакциях, протекающих в растворах
CuSO4 + Fe ––> FeSO4 + Cu
Демонстрация опыта
3. П
urok.1sept.ru
Нахождение металлов в природе и общие способы их получения.
Урок 47. Нахождение металлов в природе и общие способы их получения.
Цель урока. Познакомить учащихся с природными соединениями металлов и с самородными металлами. Сформировать понятие о минералах, рудах и металлургии и ее разновидностях – пиро-, гидро- и электрометаллургии.
Образовательные задачи:
применение обобщения знаний, умений и навыков в новых условиях – создание проблемной ситуации;
контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
уметь устанавливать причинно-следственные связи между «составом», «химическими свойствами», «получением металла».
Развивающие задачи:
развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
развитие логического мышления, внимания и умения работать в проблемной ситуации.
Воспитательные задачи:
формирование у учащихся познавательного интереса к химии;
воспитание таких качеств характера, как настойчивость в достижении цели;
воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Оборудование: коллекция руд железа, алюминия, мел, железо, раствор сульфата меди, таблицы «Доменный процесс», « Доменная печь», «Процессы выплавки стали в конвертере, в дуговой печи», «Электрохимическое получение алюминия», фарфоровая ступка, компас.
Ход урок
I. Организационный момент.
II. Актуализация знаний.
Фронтальный опрос
1. Расскажите, как располагаются в ПС металлы и неметаллы.
2. Сколько электронов обычно имеют металлы на внешнем энергетическом уровне?
3. Как изменяются металлические свойства в периоде и группе?
4. Опишите физические свойства металлов.
III. Изучение новой темы:
Природные соединения металлов
В природе металлы встречаются чаще всего в виде соединений (металлических руд). Объясняется это высокой химической активностью металлов. Вопрос обучающимся: «Могут ли металлы находиться в природе в свободном (или самородном) состоянии, т. е. в виде М°? Если могут, то, какие это металлы?» Ответ очевиден, что это металлы низкой химической активности. Обобщаем, что металлы могут встречаться в природе или в виде простого вещества (самородки) или в виде сложного вещества. Запись в тетрадях:
Благородные металлы — Аи, Pt, встречаются в природе только в свободном виде.
в самородном виде и в форме соединений могут находиться в природе серебро, медь, ртуть и олово;
Некоторые металлы встречаются и в свободном виде и в виде соединений (Sn, Cu, Hg, Ag).
Чаще всего металлы в природе встречаются в виде солей неорганических кислот: хлоридов, нитратов, сульфатов, сульфидов, карбонатов, а также оксидов.
Природные соединения алюминия
Форма, в которой металлы встречаются в природе | В свободном виде | В самородном виде, и в форме соединений | В виде соединений |
Примеры металлов | Золото Au | Серебро Ag | Литий Li |
Платина Pt | Медь Cu | Натрий Na | |
| Ртуть Hg | Кальций Ca | |
| Олово Sn | Алюминий Al |
Природные химические соединения металлов называют минералами. минералы, содержащие в количествах. пригодных для получения в промышленности, называют рудами.
На основании вышесказанного можно составить следующий логический ряд, указывая ключевые слова. Один ученик работает у доски с помощью учителя, класс записывает в тетради
Формы существования металлов в природе
Металл –– минерал –– руды
Природное Природное химическое соединение, содержащее
химическое металл в количествах, пригодных
соединение
Получение металлов
Вопрос обучающимся: Как вы думаете, ребята, какой основной химический процесс лежит в основе получения металлов?
• Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления М+п, значит для того чтобы их получить в виде М°, необходимо провести процесс восстановления.
Сообщаем, что получением металлов из их соединений занимается важнейшая отрасль промышленности, называемая металлургией. Но прежде чем восстановить природное соединение металла необходимо перевести его в форму доступную для обработки. Это может быть обжиг руд для перевода металла в оксид его или растворение нерастворимых соединений: обработка кислотами, содой и др. Катионы металлов М+п в металлургических процессах являются окислителями. Восстановителями выступают следующие вещества: С (уголь), Н2, СО, Al, Mg, активные металлы — ЩМ, ЩЗМ, электрический ток.
Знакомим ребят с общими способами получения металлов:
Пирометаллургия — это восстановление металлов из их руд, происходящее при высоких температурах. Примеры:
Обжиг (окисление): 2PbS + ЗО2 = 2РЬО + 3SO2↑
Плавка (восстановление): РЬО + Н2 = Pb + Н2О
Восстановление металлов из их оксидов более активным металлом – алюминием (алюмотерапия).
3MnO2 + 4Al = 2Al2O3 + 3Mn
Гидрометаллургия — это методы восстановления металлов из растворов
их солей другими более активными металлами:
CuO + H2SO4 = CuSO4 + Н2О
CuSO4 + Fe = FeSO4 + Сu
Этим способом получают следующие металлы: Ag, Au, Zn, Zn, Mo.
Электрометаллургия — это методы восстановления металлов с помощью электрического тока. Данный метод основан на электролизе растворов или расплавов соединений металлов. Наиболее активные металлы получают электролизом расплавов их соединений:
2КС1(расплав) →2K° + С12↑
Таким способом получают активные металлы (ЩМ, ЩЗМ, алюминий).
IV. Закрепление темы
1. Назовите, в каком виде встречаются металлы в природе? (Металлы встречаются в природе как в чистом виде. так и виде соединений)
2. Как это связано с химической активностью металлов? (Малоактивные металлы встречаются в свободном виде: золото, платина; более активные металлы встречаются как в самородном виде, так и в соединениях – серебро – олово; активные металлы – от олова до лития встречаются только в виде соединений)
3. Какая таблица отражает эти закономерности нахождения металлов в природе? (Электрохимический ряд напряжения металлов.)
V. Домашнее задание.
§ 40, зад. 1,2
3
multiurok.ru
Нахождение металлов в природе — схема, таблица — Схемо.РФ
- Войти
- Регистрация
- Схемы
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
- Социология
- Физика
- Философия
- Химия
- Экономика
- Прочее
- Книги
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
xn--e1aogju.xn--p1ai

