|
|
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Поскольку ни первичная структура, ни типы спиралей или сочетания спиральных и линейных участков полипептидной цепи не дают представления об объеме, форме полипептидной цепи, перед исследователем всегда стоит необходимость определения трехмерной или пространственной конфигурации белка. Основную роль в решении этих задач сыграл рентгеноструктурный анализ с высокой разрешающей способностью. Как было отмечено, метод успешно решает две главные проблемы химии белков: закономерность последовательностей аминокислотных остатков в полипептиде и закономерность конфигурации молекулы белка. Межатомные расстояния в молекулах органических веществ составляют 0,1–0,2 нм, а максимальная разрешающая способность современных аппаратов равна 0,2 нм. Это не позволяет установить местоположение каждого атома, хотя вполне могут быть различимы отдельные сочетания атомов, особенно при введении в молекулу белков атомов тяжелых металлов (последние благодаря своей высокой электронной плотности используются в качестве точек отсчета при математической обработке рентгенограмм). Рис. 1.19. Доменное строение глобулярных белков (по А. А. Болдыреву). а - β-субъединица гемоглобина; б - константный домен иммуноглобулина; в — флаводоксин; г — лизоцим куриного яйца. Рис. 1.20. Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем. Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, оказался мио-глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина (рис. 1.20) представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо; см. главу 2). На протяжении последних десятилетий в связи с повышением разрешающей способности рентгеноструктурного метода была расшифрована третичная структура более 1000 белков, в том числе гемоглобина, пепсина, химотрипсина, рибонуклеазы, лизоцима, трипсина и его ингибитора, ряда фрагментов иммуноглобулинов человека, цитохрома С, карбоангидразы человека, аспартатаминотрансферазы, инсулина и др. Примеры трехмерной структуры некоторых из них представлены на рис. 1.21. Рентгеноструктурный анализ позволяет определить конформацию и ход полипептидной цепи в пространстве, поэтому для каждого белка может быть построена объемная модель, отражающая местоположение линейных и спирализованных участков. При изучении глобулярных белков было показано, что пространственная структура белков в сильной степени зависит от ряда факторов, в частности от ионной силы и рН раствора, температуры и т.д. Новейшие методы дифракции рентгеновских лучей позволили расшифровать кристаллическую структуру более 100 ферментов. Для выяснения трехмерной структуры белков в последнее время успешно применяются также методы низкотемпературной вычислительной техники, а также математические и компьютерные методы определения объемной структуры на основании данных последовательностей аминокислот. Рис. 1.21. Пространственная конфигурация карбоксипептидазы (а) и рибонуклеазы (б). В настоящее время получены бесспорные доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи (рис. 1.22). К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д. По современным представлениям, третичная структура белка после завершения его синтеза в рибосомах (см. главу 14) формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы. В такой форме белковая молекула характеризуется минимальной свободной энергией. Молекулы белков в водных растворах обычно принимают ряд стабильных конформаций, индуцируемых не только изменениями рН и температуры, но и низкомолекулярными соединениями. Различают две основные формы конформаций: Т-форму (от англ. tensed – напряженная) и R-форму (от англ. relaxed – расслабленная). Между этими формами осуществляются переходы, соответственно отражающиеся в биологических свойствах. Рис. 1.22. Типы нековалентных связей, стабилизирующих третичную структуру белка. а - электростатическое взаимодействие; б — водородная связь; в — гидрофобные взаимодействия неполярных групп; г — диполь-дипольные взаимодействия; д - дисульфидная (ковалентная) связь. В процессе укладки синтезированной полипептидной цепи, получившем название фолдинга – формирование нативной пространственной структуры, в клетках происходит отбор из множества стерически возможных состояний одной-единственной стабильной и биологически активной кон-формации, определяемой, вероятнее всего, первичной структурой. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.). Поэтому в настоящее время пристальное внимание исследователей приковано к выяснению зависимости между аминокислотной последовательностью синтезированной в клетке полипептидной цепи (первичная структура) и формированием пространственной трехмерной структуры, обеспечивающей белковой молекуле ее нативные свойства. Имеется немало экспериментальных доказательств, что этот процесс не является автоматическим, как предполагалось ранее, и, вероятнее всего, регулируется и контролируется также внутриклеточными молекулярными механизмами, детали которых пока полностью не раскрыты. Из клеток выделено несколько классов белков, названных шаперонами, или белками теплового шока, которые располагаются между N-концевым сигнальным пептидом и матричным белком. Предполагается, что основными функциями шаперонов являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, или агрегатов белков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы. Эти результаты наводят на мысль о возможности существования «второй половины генетического кода», определяя тем самым повышенный интерес исследователей к проблеме свертывания полипептидной цепи и формирования ее нативной пространственной конформации. Таким образом, линейная одномерная структура полипептидной цепи (т.е. последовательность аминокислотных остатков, обусловленная кодом белкового синтеза) наделена информацией другого типа – конформацион-ной, которая представляет собой образование белковой молекулы строго заданной формы с определенным пространственным расположением отдельных ее частей. Другими словами, третичная – объемная – структура белковой молекулы детерминирована аминокислотной последовательностью полипептидной цепи, а более конкретно – размером, формой и полярностью радикалов аминокислотных остатков. Эти представления могут служить основой для предсказания конформации белковой молекулы на основании аминокислотной последовательности. Следует указать, однако, что до сих пор представляется интригующей загадкой механизм этой тесной и тонкой связи между аминокислотной последовательностью и трехмерной структурой белковой молекулы. Оказывается, иногда полипептиды почти с одинаковыми последовательностями образуют разные структуры и, наоборот, полипептиды с разными последовательностями формируют одинаковую трехмерную структуру. В свою очередь трехмерная структура белковой молекулы также содержит информацию, но уже совершенно нового типа, а именно функциональную, которую акад. В.А. Энгельгардт назвал интрамолекулярной информацией. Как будет показано далее, все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физические, химические), приводящие к нарушению этой конформации молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств. Предыдущая страница | Следующая страница СОДЕРЖАНИЕ Еще по теме: |

|
www.xumuk.ru
Третичная структура — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 апреля 2018; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 апреля 2018; проверки требуют 4 правки. Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы: α-спирали и β-листы. Справа изображена контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участковТретичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Связь с первичной структурой[править | править код]
Третичная структура в значительной степени определяется первичной структурой. Усилия по предсказанию третичной структуры белка, основываясь на его первичной структуре, известны как задача предсказания структуры белка. Окружающая среда, в которой белок сворачивается, существенно влияет на его конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом учитывают влияние окружающей среды косвенно.
Стабилизирующие взаимодействия[править | править код]
В стабилизации третичной структуры белка принимают участие:
Третичную структуру имеют также многие молекулы нуклеиновых кислот; в частности, универсальную третичную структуру имеют молекулы тРНК[4].
ru.wikipedia.org
Третичная структура белков
Третичной структурой белков назвали расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют свою локальную конформацию, то есть сохраняют спиральные или -структурные формы. Большая часть белков на уровне третичной структуры принимает глобулярную (шаровидную) форму. Это связано, в первую очередь, с тем, что многие неполярные группы радикалов аминокислот под влиянием полярного растворителя, воды, объединяются между собой в кластеры, исключающие воду. При этом они разрывают водородные связи между диполями воды, уменьшая энтропию, и сближаются на расстояния, доступные для электростатического взаимодействия между ними. Такое взаимодействие получило название «сил гидрофобного взаимодействия». Эти силы, требующие небольших усилий для разрыва, тем не менее приобретают важнейшее значение для стабилизации пространственной структуры белка. Аналогичным образом формируются липидные мицеллы. Поэтому при складывании полипептидной цепи гидрофобные радикалы оказываются внутри белковой молекулы, а гидрофильные — наружи, тем самым снижение энтропии становится минимальным.
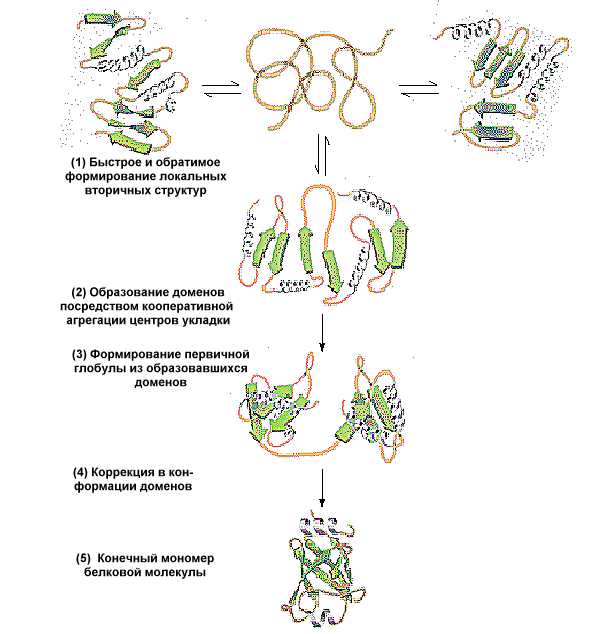
Рис.1.30. Этапы пространственной укладки полипептидной цепи и приобретения ею третичной структуры
Важную роль в стабилизации третичной структуры белка играют водородные связи и ионное взаимодействие (рис.1.31). Указанные силы успешно сочетают прочность структуры белка и ее довольно значительную подвижность, что чрезвычайно важно для выполнения функций. В ряде белков прочность структуры укрепляется дополнительно и ковалентными дисульфидными связями.
Рис.1.31. Связи, стабилизирующие третичную структуру белка. А. Ионная связь. Б. Водородная связь (три типа показаны). В. Гидрофобное взаимодействие (две формы — нижнее кластерного типа, а верхнее типа -связи). Г. Дисульфидная связь.
В фибриллярных (нитевидных) белках третичная структура формируется или путем многослойной укладки плоских -структур, или параллельной укладкой нескольких спиральных структур. В любом случае возникают ориентированные в длину волокнистые структуры. Такие волокна имеют высокую прочность. Примером такого белка может служить белок соединительной ткани — коллаген. Его молекула представляет своеобразную суперспираль, состоящую из 3-х спирально свернутых полипептидных цепей. Такие суперспирали, в свою очередь, укладываются в форме более толстых протофибрилл, объединяемых затем в коллагеновое волокно.
В заключение надо отметить, что для уникальному пространственному расположению атомов в молекуле белка (укладка полипептидной цепи в пространстве), которое «запрограммированно» самой аминокислотной последовательностью полипептидной цепи и поэтому образуется самопроизвольно, тем не менее нужны помощники. Эти помощники также являются белками и получили название «чапероны» (см.гл.10). Впервые они были открыты как «белки теплового шока» (hsp 60 и hsp 70). Их функция заключается в защите складывающейся полипептидной цепи от взаимодействия с другими многочисленными клеточными белками и, возможно, в ускорении этого процесса.
studfile.net
Структура белков — Википедия
Материал из Википедии — свободной энциклопедии
Структура белков — расположение атомов молекулы белка в трёхмерном пространстве. Белки являются полимерами — полипептидами, последовательностями, составленными из мономеров — различных L-α-аминокислот. Обычно белок, состоящий менее чем из 40 аминокислот, называют пептидом[1]. Для того, чтобы осуществлять свои биологические функции, белки сворачиваются в одну или несколько особых пространственных конфигураций, обусловленных рядом нековалентных взаимодействий, таких, как водородные связи, ионные связи, силы Ван-дер-Ваальса. Для понимания того, как функционируют белки на молекулярном уровне, необходимо определить их трёхмерную структуру.
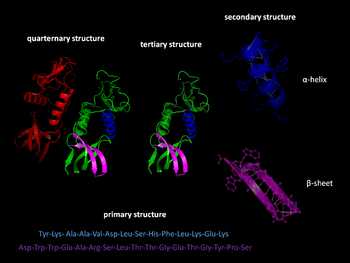
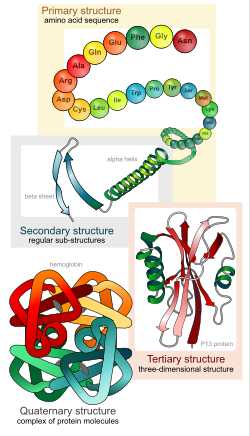 Структура белков, от первичной к четвертичной.
Структура белков, от первичной к четвертичной.Существуют четыре уровня структуры белков.
Аминокислотные остатки[править | править код]
Первичная структура[править | править код]
Вторичная структура[править | править код]
An alpha-helix with hydrogen bonds (yellow dots)Третичная структура белков[править | править код]
Четвертичная структура белков[править | править код]
Домены, мотивы и свёртки в структурах белков[править | править код]
Структурный домен[править | править код]
Структурные мотивы и последовательности[править | править код]
Супервторичная структура[править | править код]
Белковые свёртки[править | править код]
 Примеры структур белков из PDB
Примеры структур белков из PDBru.wikipedia.org
12.Третичная структура белка. Характеристика связей, стабилизирующих третичную структуру. Денатурация белков.
определяется взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков трудно выделить общие закономерности в образовании третичных структур. Что касается глобулярных белков, то такие закономерности существуют, и мы их рассмотрим. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей -структуры, -спирали и нерегулярные участки, так , что гидрофильные боковые группы аминокислотных остатков оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны вглубь глобулы, иногда образуют гидрофобный карман.
Силы, стабилизирующие третичную структуру белка.
Электростатическое взаимодействие между разно заряженными группами, крайний случай — ионные взаимодействия.
Водородные связи, возникающие между боковыми группами полипептидной цепи.
Гидрофобные взаимодействия.
Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с образованием цистина). Образование дисульфидных связей приводит к тому, что удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями.
Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре. Небольшие изменения конформации белковых молекул происходят при взаимодействии с другими молекулами. Эти изменения порой играют огромную роль при функционировании белковых молекул. Так, при присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного взаимодействия при присоединении остальных трех молекул кислорода. Такое изменение конформации в лежит в основе теории индуцирующего соответствия при объяснении групповой специфичности некоторых ферментов.
Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией.
Способность к специфическим взаимодействиям как основа биологической активности белков. Ингибиторы функции белков.
В основе функционирования белка лежит его способность к взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе и другой белок. Лиганд присоединяется к определенному участку глобулярной молекулы — активному центру. Активный центр формируется в ходе образования третичной структуры белка, поэтому при денатурации белка (когда разрушается его третичная структура) белки теряют свою активность. Специфичность взаимодействия белка и лиганда объясняется комплиментарностью пространственной структуры активного центра и молекулы лиганда. Взаимодействие между белком P и лигандом L описывается уравнениями:
P + L PL
Ксв определяет сродство белка к данному лиганда, чем больше Ксв, тем больше сродство. На специфичности взаимодействия белков и лигандов основан методов разделения белков — аффинная хроматография.
Ингибиторы функций белков
Учитывая, что различные лиганды отличаются Ксв, всегда можно подобрать вещество, похожее по структуре на природный лиганд, но имеющий большее значение Ксв с данным белком. Например, СО имеет Ксв в 100 раз больше, чем О2 с гемоглобином, поэтому достаточно 0,1% СО в воздухе, чтобы заблокировать большое количество молекул гемоглобина. По такому же принципу действуют многие лекарства. Например, дитилин.
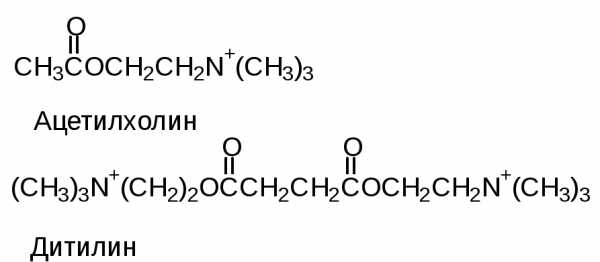 Ацетилхолин
— медиатор передачи нервных импульсов
на мышцу. Дитилин блокирует белок-рецептор,
с которым связывается ацетилхолин и
создает эффект парализации.
Ацетилхолин
— медиатор передачи нервных импульсов
на мышцу. Дитилин блокирует белок-рецептор,
с которым связывается ацетилхолин и
создает эффект парализации.
Строение олигомерных белков на примере гемоглобина. Характеристика связей, стабилизирующих четвертичную структуру
Под четвертичной структурой белка подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих первичной, вторичной и третичной структурой и формирование единого в структурном и функциональном отношении макромолекулярного образования. Каждая отдельная полипептидная (протомер или субъединица) не обладают биологической активностью, а образовавшаяся молекула — олигомер обладает биологической активностью. Четвертичная структура белка уникальна, как и другие уровни организации. Четвертичная структура поддерживается нековалентными взаимодействиями между контактными площадками протомеров.
Четвертичная структура белков — еще один пример удивительной мудрости природы. Докажем это на примере функционирования двух белков: миоглобина, обладающего только третичной структурой и гемоглобина, обладающего четвертичной структурой. Гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей (, , , , S). В состав молекулы входит по две цепи двух разных видов. Длина - и -цепей примерно одинакова (- 141 а.к., - 146 а.к.). Наиболее распространенные гемоглобины имеют следующую тетрамерную структуру: HbA (нормальный гемоглобин взрослого человека) — 22,; HbF (фетальный гемоглобин) -22; HbS (гемоглобин при серповидноклеточной анемии) — 2S2; HbA2 (минорный гемоглобин человека) — 22.
Четвертичная структура наделяет гемоглобин дополнительными важными особенностями, которые способствуют выполнению гемоглобином уникальной биологической функцией и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от греч. — аллос — другой, стерос — пространство). На его примере можно лучше понять свойства других аллостерических белков, поэтому рассмотрим работу гемоглобина подробнее.
Миоглобин способен запасать кислород, а гемоглобин обеспечивает его транспорт. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Простетической группой этих белков является гем. Гем расположен в гидрофобном кармане пептидной цепи каждого протомера, т.е. окружен неполярными остатками, за исключением 2-х остатков гистидина, расположенных по обе стороны плоскости гема. С одним из них (проксимальным гистидином) Fe2+ связано координационно по 5 координационному положению. Второй (дистальный) гистидин расположен почти напротив проксимального, но несколько дальше, поэтому 6-ое координационное положение Fe2+ остается свободным. В неоксигенированном миоглобине или протомере гемоглобина атом железа выступает из плоскости кольца в направлении проксимального гистидина на 0,03 нм. В оксигенированном миоглобине (протомере гемоглобина) кислород занимает 6-ое координационное положение атома железа, при этом Fe2+ не меняет степени окисления. Такого эффекта позволяет достичь гидрофобное белковое окружение гема, которое не позволяет кислороду слишком сблизиться с железом, чтобы его окислить. Железо, координируя О2, выступает из плоскости кольца лишь на 0,01 нм. Т.о., оксигенирование миоглобина сопровождается смещением атома железа и, следовательно, проксимального гистидина и ковалентно связанных с ним аминокислотных остатков в направлении плоскости кольца. В результате белковая глобула меняет конформацию. Эти изменения приводят в гемоглобине сопровождаются разрывом солевых связей между протомерами, что облегчает связывание следующих молекул О2. Тем самым проявляется эффект кооперативного связывания.
Особенности функционирования олигомерных белков (кооперативное взаимодействие субъединиц, аллостерическая регуляция) на примере гемоглобина,
Четвертичная структура наделяет гемоглобин дополнительными важными особенностями, которые способствуют выполнению гемоглобином уникальной биологической функцией и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическими свойствами (от греч. — аллос — другой, стерос — пространство). На его примере можно лучше понять свойства других аллостерических белков, поэтому рассмотрим работу гемоглобина подробнее.
Миоглобин способен запасать кислород, а гемоглобин обеспечивает его транспорт. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Простетической группой этих белков является гем. Гем расположен в гидрофобном кармане пептидной цепи каждого протомера, т.е. окружен неполярными остатками, за исключением 2-х остатков гистидина, расположенных по обе стороны плоскости гема. С одним из них (проксимальным гистидином) Fe2+ связано координационно по 5 координационному положению. Второй (дистальный) гистидин расположен почти напротив проксимального, но несколько дальше, поэтому 6-ое координационное положение Fe2+ остается свободным. В неоксигенированном миоглобине или протомере гемоглобина атом железа выступает из плоскости кольца в направлении проксимального гистидина на 0,03 нм. В оксигенированном миоглобине (протомере гемоглобина) кислород занимает 6-ое координационное положение атома железа, при этом Fe2+ не меняет степени окисления. Такого эффекта позволяет достичь гидрофобное белковое окружение гема, которое не позволяет кислороду слишком сблизиться с железом, чтобы его окислить. Железо, координируя О2, выступает из плоскости кольца лишь на 0,01 нм. Т.о., оксигенирование миоглобина сопровождается смещением атома железа и, следовательно, проксимального гистидина и ковалентно связанных с ним аминокислотных остатков в направлении плоскости кольца. В результате белковая глобула меняет конформацию. Эти изменения приводят в гемоглобине сопровождаются разрывом солевых связей между протомерами, что облегчает связывание следующих молекул О2. Тем самым проявляется эффект кооперативного связывания.
Изофункциональные белки. Изменение белкового состава организма. Протеинопатии.
Изофункциональные белки
Белок, выполняющий определенную функцию в клетке, может быть представлен несколькими формами — изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются, константой связывания, что приводит к некоторым различиям в функциональном отношении. Например, в эритроцитах человека обнаружено несколько форм гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все гемоглобины представляют собой тетрамеры, построенные из протомеров , , , (HbA -22, HbF — 22, HbA2 — 22). Все протомеры сходны между собой по первичной структуре, и очень большое сходство наблюдается по вторичной и третичной структурам. Все формы гемоглобинов предназначены для переноса кислорода в клетки тканей, но HbF, например, имеет большее сродство к кислороду, чем HbA. HbF характерен для эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение кислородом плода.
Изобелки — это результат наличия более чем одного структурного гена в генофонде вида.
Изменения белкового состава организма
Белковый состав взрослого человека более или менее постоянен, однако возможны некоторые изменения содержания некоторых белков в зависимости от физиологической активности, состава пищи, циклические изменения (биоритмы). При болезнях белковый состав тканей изменяется. Эти проявления болезней называют протеинпатиями. Различают протеинпатии двух типов — наследственные и приобретенные. Наследственные — результат повреждения в генетическом аппарате организма (например, HbS). Приобретенные сопровождают любую болезнь. При приобретенных первичная структура белка не изменяется, изменяется количество белка и его распределение в тканях. Нарушение этих параметров в тканях и жидкостях организма позволяют поставить правильный диагноз.
studfile.net
Структура белков четвертичной структуры, особенности синтеза и генетики
Белки – одни из важных органических элементов любой живой клетки организма. Они выполняют множество функций: опорную, сигнальную, ферментативную, транспортную, структурную, рецепторную и т. д. Важным эволюционным приспособлением стали первичная, вторичная, третичная и четвертичная структуры белков. Из чего состоят эти молекулы? Почему так важна правильная конформация протеинов в клетках организма?
Структурные компоненты белков
Мономерами любой полипептидной цепи являются аминокислоты (АК). Эти низкомолекулярные органические соединения достаточно распространены в природе и могут существовать как самостоятельные молекулы, выполняющие свойственные им функции. Среди них транспорт веществ, рецепция, ингибирование или активация ферментов.
Всего насчитывается около 200 биогенных аминокислот, однако только 20 из них могут быть мономерами белков. Они легко растворяются в воде, имеют кристаллическую структуру и многие из них сладкие на вкус.
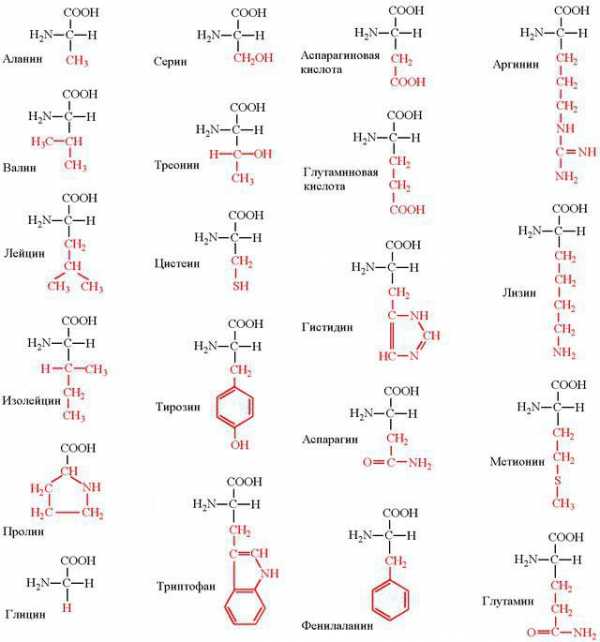
С химической точки зрения АК – это молекулы, в составе которых обязательно присутствуют две функциональные группы: -СООН и –Nh3. С помощью этих групп аминокислоты образуют цепочки, соединяясь друг с другом пептидной связью.
Каждая из 20 протеиногенных аминокислот имеет свой радикал, в зависимости от которого разнятся химические свойства. По составу таких радикалов все АК классифицируются на несколько групп.
- Неполярные: изолейцин, глицин, лейцин, валин, пролин, аланин.
- Полярные и незаряженные: треонин, метионин, цистеин, серин, глутамин, аспарагин.
- Ароматические: тирозин, фенилаланин, триптофан.
- Полярные и заряженные отрицательно: глутамат, аспартат.
- Полярные и заряженные положительно: аргинин, гистидин, лизин.
Любой уровень организации структуры белка (первичный, вторичный, третичный, четвертичный) в основе имеет полипептидную цепь, состоящую из АК. Разница лишь в том, как эта последовательность складывается в пространстве и с помощью каких химических связей такая конформация поддерживается.
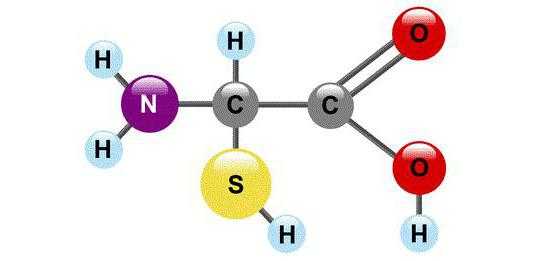
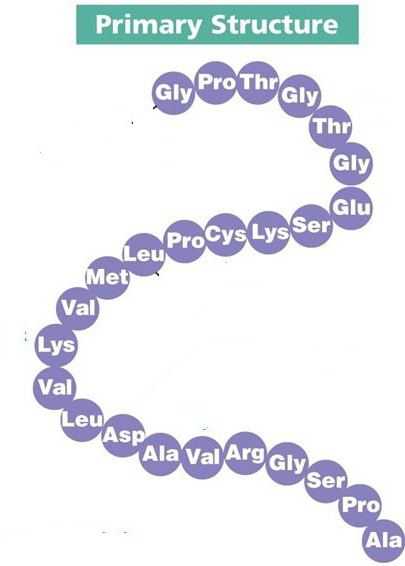
Первичная структура белка
Любой протеин образуется на рибосомах – немембранных органеллах клетки, которые участвуют в синтезе полипептидной цепочки. Здесь аминокислоты соединяются друг с другом с помощью прочной пептидной связи, образуя первичную структуру. Однако такая первичная структура белка от четвертичной крайне отличается, поэтому необходимо дальнейшее созревание молекулы.
Такие белки, как эластин, гистоны, глутатион, уже с такой простейшей структурой способны выполнять свои функции в организме. Для подавляющего же числа протеинов следующим этапом становится образование более сложной вторичной конформации.
Вторичная структура белка
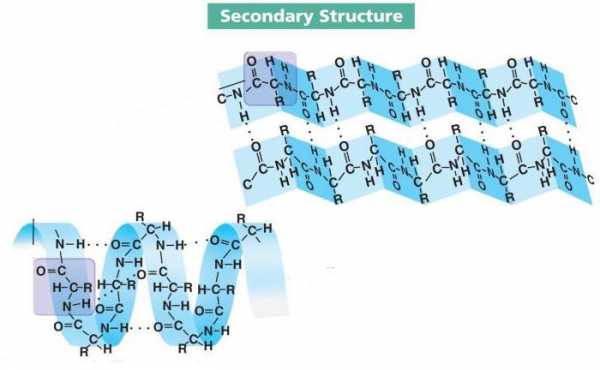
Образование пептидных связей – это первый этап созревания большинства белков. Чтобы они могли выполнять свои функции, их локальная конформация должна претерпеть некоторые изменения. Достигается это с помощью водородных связей – непрочных, но в то же время многочисленных соединений между основным и кислотным центрами молекул аминокислот.
Так формируется вторичная структура белка, от четвертичной отличающаяся простотой комплектации и локальной конформацией. Последнее означает, что не вся цепь подвергается преобразованию. Водородные связи могут образовываться на нескольких участках разной отдаленности друг от друга, причем их форма также зависит от типа аминокислот и способа комплектации.
Лизоцим и пепсин – это представители белков, имеющих вторичную структуру. Пепсин участвует в процессах пищеварения, а лизоцим выполняет защитную функцию в организме, разрушая клеточные стенки бактерий.
Особенности вторичной структуры
Локальные конформации пептидной цепи могут отличаться друг от друга. Их уже изучено несколько десятков, и три из них являются наиболее распространенными. Среди них альфа-спираль, бета-слои и бета-поворот.
- Альфа-спираль – одна из часто встречающихся конформаций вторичной структуры большинства белков. Представляет собой жесткий стержневой каркас с ходом в 0,54 нм. Радикалы аминокислот направлены наружу.
Наиболее распространены правозакрученные спирали, и иногда можно найти левозакрученные аналоги. Формообразующую функцию выполняют водородные связи, которые стабилизируют завитки. Цепь, которая образует альфа-спираль, содержит очень мало пролина и полярных заряженных аминокислот.
- Бета-поворот выделяют в отдельную конформацию, хотя это можно назвать частью бета-слоя. Суть заключается в изгибе пептидной цепочки, который поддерживается водородными связями. Обычно само место изгиба состоит из 4-5 аминокислот, среди которых обязательно наличие пролина. Эта АК единственная имеет жесткий и короткий скелет, что позволяет образовать сам поворот.
- Бета-слой представляет собой цепочку аминокислот, которая образует несколько изгибов и стабилизирует их водородными связями. Такая конформация очень напоминает сложенный в гармошку лист бумаги. Чаще всего такую форму имеют агрессивные белки, однако встречается немало исключений.
Различают параллельный и антипараллельный бета-слой. В первом случае С- и N- концы в местах изгиба и на концах цепи совпадают, а во втором случае нет.
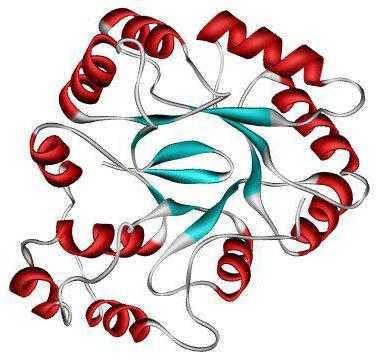
Третичная структура
Дальнейшая упаковка белка приводит к формированию третичной структуры. Стабилизируется такая конформация с помощью водородных, дисульфидных, гидрофобных и ионных связей. Их большое количество позволяет скрутить вторичную структуру в более сложную форму и стабилизировать ее.
Разделяют глобулярные и фибриллярные белки. Молекула глобулярных пептидов представляет собой шаровидную структуру. Примеры: альбумин, глобулин, гистоны в третичной структуре.
Фибриллярные белки формируют прочные тяжи, длина которых превышает их ширину. Такие протеины чаще всего выполняют структурную и формообразующую функции. Примерами служат фиброин, кератин, коллаген, эластин.
Структура белков в четвертичной структуре молекулы
Если несколько глобул объединяются в один комплекс, формируется так называемая четвертичная структура. Такая конформация характерна не для всех пептидов, и она образуется при необходимости выполнения важных и специфических функций.
Каждая глобула в составе сложного белка представляет собой отдельный домен или протомер. В совокупности структура белков четвертичной структуры молекулы называется олигомером.
Обычно такой белок имеет несколько устойчивых конформаций, которые постоянно сменяют друг друга либо в зависимости от воздействия каких-либо внешних факторов, либо при необходимости выполнения разных функций.
Важным отличием третичной структуры белка от четвертичной являются межмолекулярные связи, которые и отвечают за соединение нескольких глобул. В центре всей молекулы часто располагается ион металла, который напрямую влияет на образование межмолекулярных связей.
Дополнительные структуры белка
Не всегда цепочки аминокислот достаточно для выполнения функций белка. В большинстве случаев к таким молекулам присоединяются другие вещества органической и неорганической природы. Т. к. эта особенность характерна для подавляющего числа ферментов, состав сложных протеидов принято делить на три части:
- Апофермент – это белковая часть молекулы, представляющая собой аминокислотную последовательность.
- Кофермент – не белковая, но органическая часть. В ее состав могут входить различные типы липидов, углеводов или даже нуклеиновых кислот. Сюда относятся и представители биологически активных соединений, среди которых встречаются витамины.
- Кофактор – неорганическая часть, представленная в подавляющем большинстве случаев ионами металлов.
Структура белков в четвертичной структуре молекулы требует участия нескольких молекул разного происхождения, поэтому многие ферменты имеют сразу три составляющие. Примером служит фосфокиназа – фермент, обеспечивающий перенос фосфатной группы от молекулы АТФ.
Где образуется четвертичная структура молекулы белка?
Полипептидная цепь начинает синтезироваться на рибосомах клетки, однако дальнейшее созревание протеина происходит уже в других органеллах. Новообразованная молекула должна попасть в транспортную систему, которая состоит из ядерной мембраны, ЭПС, аппарата Гольджи и лизосом.
Усложнение пространственного строения белка происходит в эндоплазматической сети, где не только формируются различные виды связей (водородные, дисульфидные, гидрофобные, межмолекулярные, ионные), но и присоединяются кофермент и кофактор. Так образуется четвертичная структура белка.
Когда молекула полностью готова к работе, она попадает либо в цитоплазму клетки, либо в аппарат Гольджи. В последнем случае эти пептиды упаковываются в лизосомы и транспортируются к другим компартментам клетки.
Примеры олигомерных белков
Четвертичная структура – это структура белков, которая призвана способствовать выполнению жизненно важных функций в живом организме. Сложная конформация органических молекул позволяет, прежде всего, влиять на работу многих метаболических процессов (ферменты).
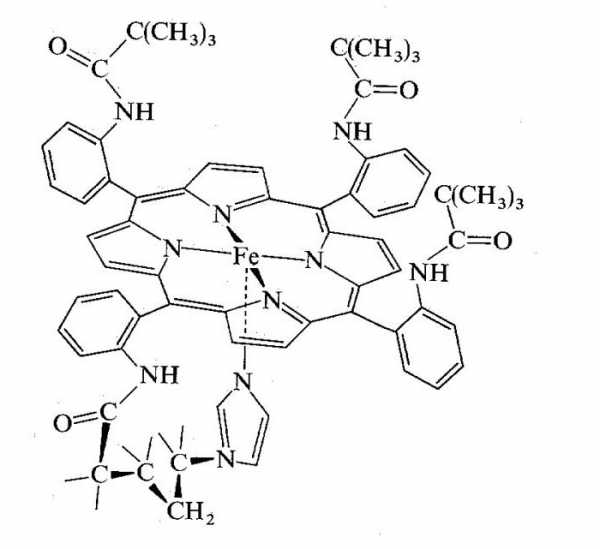
Биологически важными белками являются гемоглобин, хлорофилл и гемоцианин. Порфириновое кольцо является основой этих молекул, в центре которых – ион металла.
Гемоглобин
Четвертичная структура молекулы белка гемоглобина представляет собой 4 глобулы, соединенных межмолекулярными связями. В центре – порфин с ионом двухвалентного железа. Белок переносится в цитоплазме эритроцитов, где занимают около 80 % всего объема цитоплазмы.
Основой молекулы является гем, который имеет больше неорганическую природу и окрашен в красный цвет. Также это первичный продукт распада гемоглобина в печени.
Все мы знаем, что гемоглобин выполняет важную транспортную функцию – перенос кислорода и углекислого газа по организму человека. Сложная конформация молекулы белка формирует специальные активные центры, которые и способны связывать соответствующие газы с гемоглобином.
Когда образуется комплекс «белок-газ», формируются так называемые оксигемоглобин и карбогемоглобин. Однако есть еще одна разновидность таких объединений, которая достаточно устойчива: карбоксигемоглобин. Представляет собой комплекс из белка и угарного газа, устойчивость которого объясняет приступы удушья при чрезмерной токсикации.
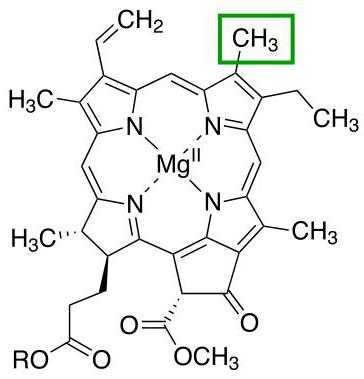
Хлорофилл
Еще один представитель белков с четвертичной структурой, связи доменов которого поддерживает уже ион магния. Главная функция всей молекулы – участие в процессах фотосинтеза у растений.
Существуют различные типы хлорофиллов, которые отличаются друг от друга радикалами порфиринового кольца. Каждая из этих разновидностей отмечается отдельной буквой латинского алфавита. Например, для наземных растений характерно наличие хлорофилла а или хлорофилла b, а у водорослей встречаются и другие типы этого белка.
Гемоцианин
Эта молекула – аналог гемоглобина у многих низших животных (членистоногие, моллюски и т. д.). Основным отличием структуры белка с четвертичной структурой молекулы является наличие иона цинка вместо иона железа. Гемоцианин имеет голубоватый цвет.
Иногда люди задаются вопросом о том, что было бы, если заменить гемоглобин человека гемоцианином. В таком случае нарушается привычное содержание веществ в крови, а в частности аминокислот. Также гемоцианин нестабильно образует комплекс с углекислым газом, поэтому «голубая кровь» имела бы склонность к образованию тромбов.
fb.ru
В Третичная структура белка
Третичная структура глобулярных белков представляет собой глобулу (или клубок). Большинство глобулярных белков растворимы в клетке. Как правило, ядро глобулярного белка содержит много неполярных аминокислотных остатков (валин, лейцин, изолейцин, фенилаланин, метионин), которые изолированы от водной среды и образуют гидрофобное ядро (гидрофобный эффект). Это ядро плотно упаковано, внутри него действуют слабые силы ван-дер-Ваальса
(обуславливающие гидрофобные взаимодействия). Могут воз-
никать водородные связи между полярными незаряженными радикалами (серин, треонин, аспарагин, глутамин, тирозин и триптофан). Заряженные полярные аминокислотные радикалы часто расположены на поверхности белка и формируют ионные пары (ионные связи) между собой (таким образом сближаются удаленные участки полипептидной цепи) или вступают в контакт с растворителем — молекулами воды (см. Рис. 13 ▼). Кроме того, заряженные радикалы часто связываются с неорганическими ионами (в т.ч. ионами металлов с образованием координационных связей), что снижает силы отталкивания между фрагментами цепи. Внутри полипептидной цепи и между цепями могут образовываться дисульфидные мостики (в их образовании участвуют сульфгидрильные группы цистеина, –S—S–).
В рамках третичной структуры можно выделить неко-
торые надвторичные структуры: спираль-поворот-спираль,
переплетённая спираль, β αβ , шпилька, β -меандр и др. (см. Рис. 14 и Рис. 15 ▼).
Многие белки состоят из отдельных фрагментов, имеющих свою индивидуальную укладку, функцию и стабильность — доме́нов. Длина аминокислотной цепочки одного домена может составлять от 25 до 300 и более аминокислотных остатков.
Домены белков по своему составу и структуре классифицируют на 4 группы:
—«α»-белки содержат только α-спирали.
—«β»-белки — только β -структуры.
—«α/β»-белки состоят из параллельных β -структур
ипараллельных α -спиралей, которые антипараллельны друг другу.
—«α+β»-белки подразделяют на две класса:
Белки первого класса напоминают «α/β »- белки тем, что в них слой α-спиралей лежит на β -листе. Их α и β участки в цепи и в пространстве регулярно чередуются.
Рис. 12. Третичная структура цитохрома
b562 кишечной па-
лочки E. coli (ленточ-
ная модель).
Рис. 13. Компьютерная визуализация молекулы протеинкиназы CK2 (белок-фермент): синим цветом обозначены положительно заряженные радикалы, красным цветом — отрицательно заряженные, а серым — нейтрально заряженные.
studfile.net

