Химические связи, подготовка к ЕГЭ по химии
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
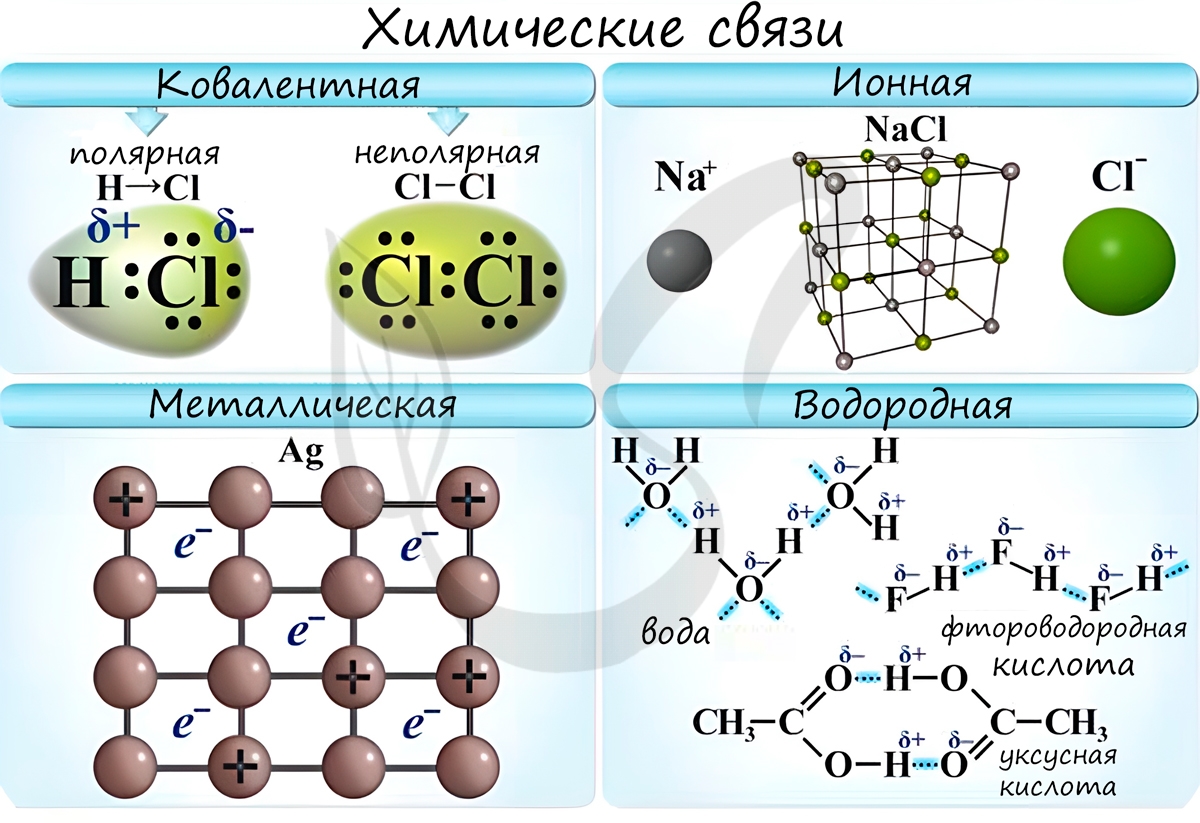
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2),
а также, в общем случае, между атомами неметалла и другого неметалла (NH
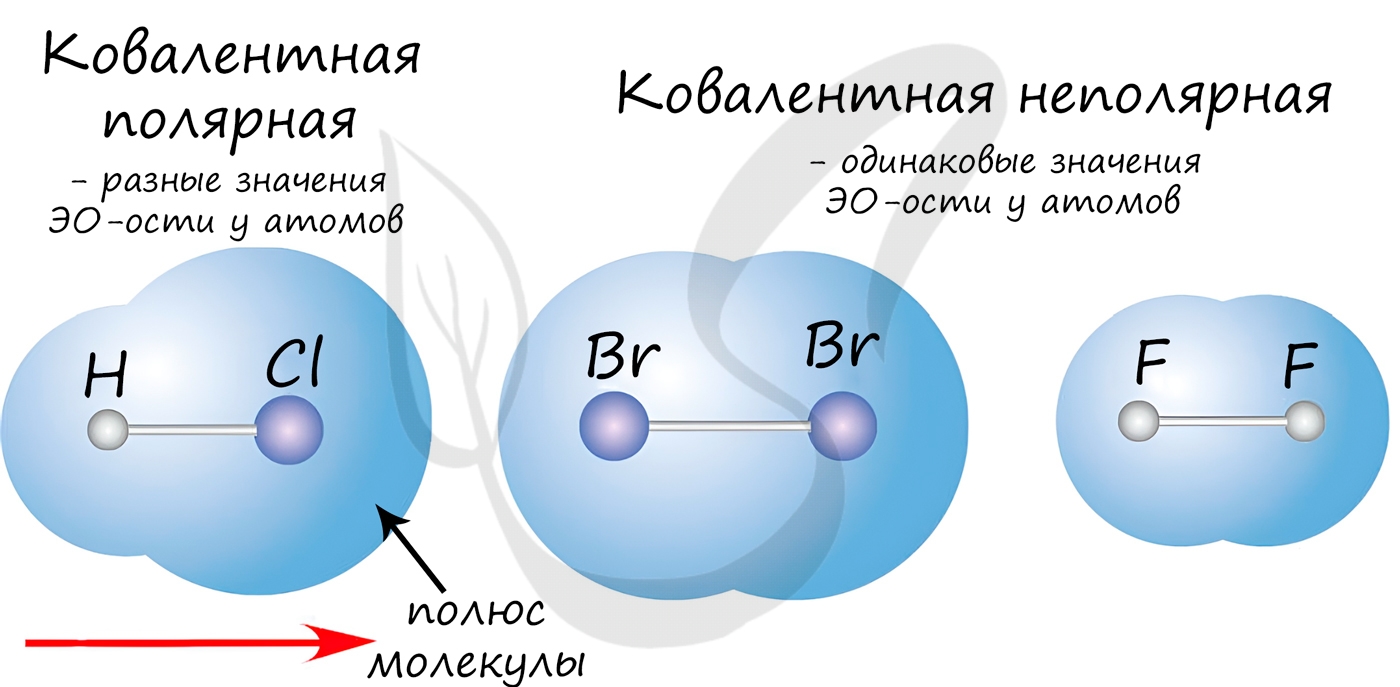
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
 Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково»
вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для
создания связи.
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково»
вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для
создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ — в ионе аммония
- NH4+Cl, NH4+Br — внутри иона аммония во всех его солях
- NO3— — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O+ — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму

Ионная связь
Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
NaF, CaCl2, MgF2, Li2S, BaO, RbI.
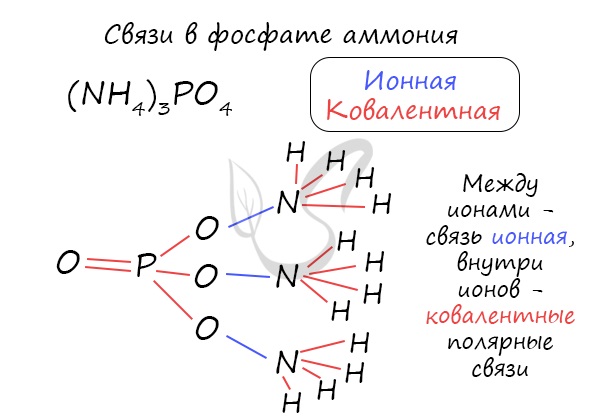
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
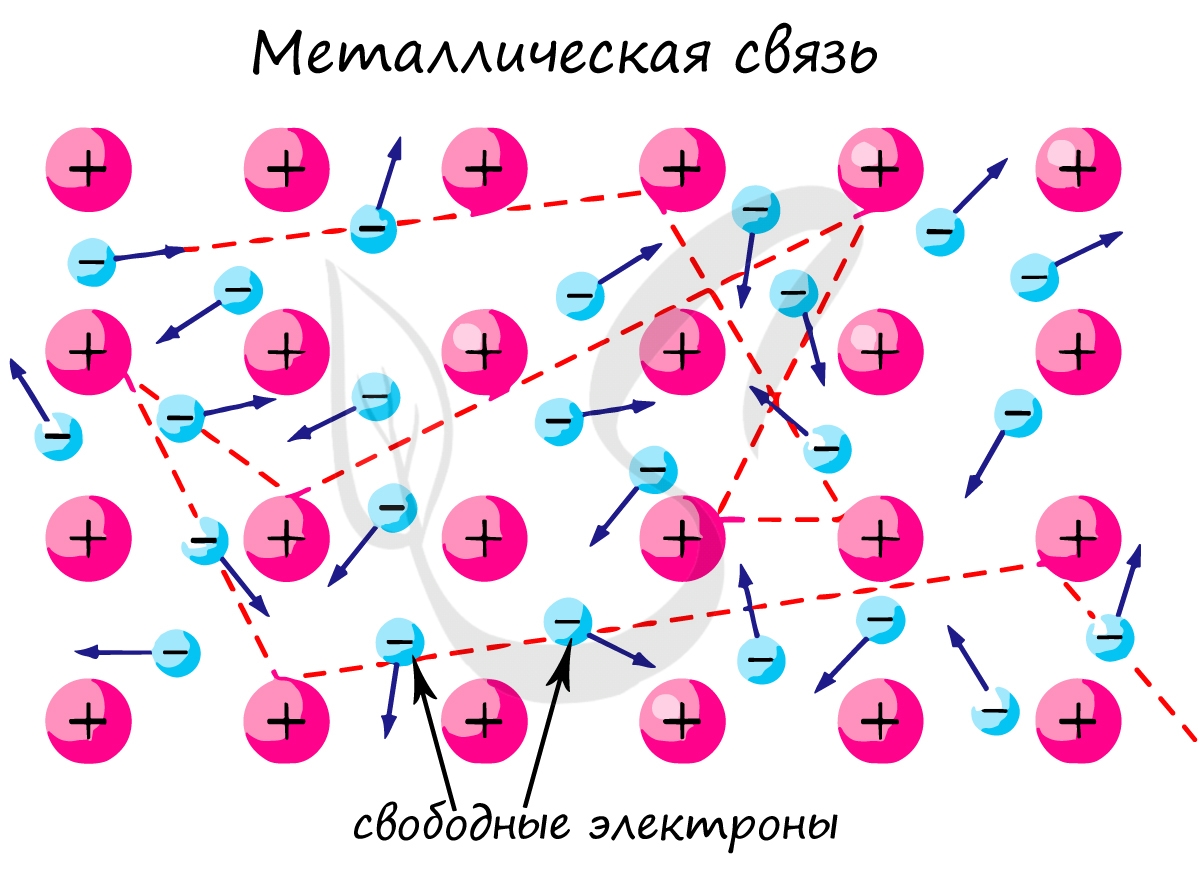
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Типы химических связей
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами. Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
Типы химических связей
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная связь
Ковалентная неполярная связь
Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.
Рассмотри образование ковалентной неполярной связи, на примере водорода:
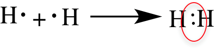
Ковалентная полярная связь
Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
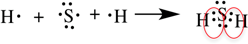
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из элементов отдает свои электроны и он заряжается положительно. Элемент, который принимает электроны заряжается отрицательно.
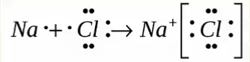
Металлическая связь
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3
ОСН3, не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С2Н6О).| Тип связи | Примеры |
| Ковалентная неполярная | Cl2, O2, Br2, I2, N2 и др. |
| Ковалентная полярная | HCl, H2S, HBr, H2O, SO2, SO3 и др. |
| Ионная | NaCl, KCl, CaBr2, Na2O и др. |
| Металлическая | Na, Ca, Zn, Al и др. |
| Водородная | Между молекулами:
|
Примеры решения задач по химии в ЕГЭ на типы химических связей
Задача 1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- Ca(ClO2)
- HClO3
- NH4Cl
- HClO4
- Cl2O7
Решение: Ионная химическая связь характерна для оксидов, гидроксидов и солей металлов (+соли аммония и гидроксид аммония). Соли —это вариант 1 и 3.
Задача 2. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
- Cl2
- С2S
- NaBr
- K2S
- Al2O3
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная связь характерна для простых веществ-неметаллов и соединений типа неметалл-неметалл. Это простое вещество хлор и сульфид углерода. Таким образом ответ будет 1 и 2.
Задача 3. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
- NH4OH
- He
- HCl
- P2O5
- PbO
Решение: Ковалентная полярная связь образуется между двумя разными неметаллами. Ответ 34.
Задача 4. Из предложенного перечня выберите два соединения, в которых присутствует водородная химическая связь.
- H2O
- C2H6
- CH3OCH3
- С2H5OH
- H2
Решение: Водородная химическая связь возникает между молекулами воды и одноатомных спиртов. Ответ 14.
Задача 5. Из предложенного перечня выберите два соединения, в которых ковалентная связь образована по донорно-акцепторному механизму.
- Карбид кальция
- Сульфат аммония
- Оксид фосфора (V)
- Криптон
- Угарный газ
Решение: Донорно-акцепторный механизм образования связи характерен для иона аммония и угарного газа в связи с наличием неподеленной электронной пары на азоте и углероде соответственно. Ответ: 25.
Задача 6. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
- CO2
- K2O
- F2
- H2O
- O2
Запишите в поле ответа номера выбранных соединений.
Решение: ковалентная неполярная связь образуется между одинаковыми атомами. Это фтор и кислород.
Ответ 35.
Задача 7. Из предложенного перечня выберите два вещества, с каждым из которых сера образует ионные связи.
- Фтор
- Натрий
- Кислород
- Кальций
- Углерод
Запишите в поле ответа номера выбранных соединений.
Решение: Ионные связи образуются между металлом и неметаллом. Сера-неметалл, значит, нужно выбрать металлы. Это натрий и кальций.
Ответ: 24.
Задача 8. Из предложенного перечня выберите два вещества, в молекулах которых имеются как полярные, так и неполярные ковалентные связи.
- CCl4
- C6H6
- HNO3
- N2O4
- CO2
Решение: В молекуле под номером 1 есть 4 связи C-Cl, все они полярные, но в задании нужно найти молекулу как с полярными, так и с неполярными связями.
В молекуле бензола (под номером 2) содержится 2 вида связей: C-C неполярная и C-H полярная.
В молекуле HNO3 хоть и 3 кислорода, но между собой они не связаны, поэтому наблюдается 2 вида только полярных связей H-N, N-O.
В молекуле N2O4 2 типа связей: N-N неполярная и N-O полярная.
В молекуле углекислого газа оба кислорода связаны только с углеродом, образуя только полярные связи.
Ответ 24.
Задача 9. Из предложенного перечня выберите два вещества, в которых присутствует металлическая связь.
- Na2O
- Cu(OH)2
- Fe
- B
- Zn
Решение: металлическая связь характерная для металлов и сплавов. Металлы здесь — железо и цинк. Ответ 35.
Задача 10. Из предложенного перечня выберите два вещества, с которыми соединения хлора имеют ковалентную полярную связь.
- Водород
- Калий
- Магний
- Натрий
- Фосфор
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому ковалентную полярную связь имеет соединение хлора с водородом и фосфором. С остальными — связь ионная.
Ответ: 15.
Задача 11. Из предложенного перечня выберите два соединения, в которых имеются только ионные связи.
- KI
- BaCl2
- KClO3
- BaSO4
- (NH4)2S
Решение: Ковалентная не полярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ионные связи присутствуют в KI и BaCl2.
Ответ: 12.
Задача 12. Из предложенного перечня выберите два соединения, между молекулами которых образуются водородные связи.
- Фтороводород
- Бутанол
- Хлорметан
- Диметиловый эфир
- Этилен
Решение: Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы.
Среди предложенных веществ водородная связь образуется между молекулами фторводорода и бутанола.
Ответ: 12.
Задача 13. Из предложенного перечня выберите два соединения, образованные как ковалентной, так и ионной связью.
- CaSO4
- C2H5OH
- NH4NO3
- NaCl
- C6H6
Решение: В этиловом спирте связи ковалентные, в хлориде натрия — ионные, в бензоле — ковалентные. В нитрате аммония и сульфате кальция связи в ионе аммония и нитратном и сульфатном анионах ковалентные, а между ионом аммония и нитратным анионом, а также ионом кальция и сульфат анионом — ионная.
Ответ: 13
Задача 14. Из предложенного перечня выберите два соединения, где кислород образует ковалентную полярную связь.
- NO2
- O2
- CO
- CaO
- Al2O3
Решение: Ковалентная полярная связь осуществляется между разными неметаллами.
Ответ: 13
Задача 15. Из предложенного перечня выберите два типа химических связей, которые реализуются в сульфате калия.
- ковалентная неполярная
- ковалентная полярная
- ионная
- металлическая
- водородная
Решение: Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. В сульфате калия между ионами калия и сульфат-ионами связь ионная, а между кислородом и серой в сульфат-ионе — ковалентная полярная.
Ответ: 23.
описание типов, особенности и примеры
 Атомы большинства элементов не существуют отдельно, так как могут взаимодействовать между собой. При этом взаимодействии образуются более сложные частицы.
Атомы большинства элементов не существуют отдельно, так как могут взаимодействовать между собой. При этом взаимодействии образуются более сложные частицы.
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
Типы химической связи можно представить в виде следующей таблицы:
| внутримолекулярные | межмолекулярные |
| ионное | водородное |
| металлическое | вандерваальсовое |
| ковалентное | ион-дипольное |
| диполь-дипольное |
Характеристика ионной связи
 Химическое взаимодействие, которое образуется из-за притяжения ионов, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц — ионов. Между ними и возникает притяжение.
Химическое взаимодействие, которое образуется из-за притяжения ионов, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц — ионов. Между ними и возникает притяжение.
Наименьшими показателями электроотрицательности обладают типичные металлы, а наибольшими — типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет.
Примеры образования
 Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Na0 — 1 е = Na + (катион)
Cl0 + 1 е = Cl— (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Ba0 — 2 е = Ba2+
S0 + 2 е = S2-
Ва отдаёт свои два электрона сере в результате чего образуются анионы серы S2- и катионы бария Ba2+ .
Металлическая химическая связь
 Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Mg — 2е <—> Mg2+
Cs — e <—> Cs+
Ca — 2e <—> Ca2+
Fe — 3e <—> Fe3+
Ковалентная: полярная и неполярная
 Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Ковалентное взаимодействие может образовываться по обменному механизму или по донорно-акцепторному.
Обменный механизм реализуется, если у каждого из атомов есть неспаренные электроны на внешних электронных уровнях и перекрывание атомных орбиталей приводит к возникновению пары электронов, принадлежащей уже обоим атомам. Когда же у одного из атомов есть пара электронов на внешнем электронном уровне, а у другого — свободная орбиталь, то при перекрывании атомных орбиталей происходит обобществление электронной пары и взаимодействие по донорно-акцепторному механизму.
Ковалентные разделяются по кратности на:
- простые или одинарные;
- двойные;
- тройные.
Двойные обеспечивают обобществление сразу двух пар электронов, а тройные — трёх.
По распределению электронной плотности (полярности) между связываемыми атомами ковалентная связь делится на:
- неполярную;
- полярную.
Неполярную связь образуют одинаковые атомы, а полярную — разные по электроотрицательности.
 Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие различающихся по электроотрицательности элементов приводит к образованию полярных связей. Общие электронные пары при таком типе взаимодействия притягиваются более электроотрицательным элементом, но полностью к нему не переходят (то есть образования ионов не происходит). В результате такого смещения электронной плотности на атомах появляются частичные заряды: на более электроотрицательном — отрицательный заряд, а на менее — положительный.
Свойства и характеристика ковалентности
Основные характеристики ковалентной связи:
- Длина определяется расстоянием между ядрами взаимодействующих атомов.
- Полярность определяется смещением электронного облака к одному из атомов.
- Направленность — свойство образовывать ориентированные в пространстве связи и, соответственно, молекулы, имеющие определённые геометрические формы.
- Насыщаемость определяется способностью образовывать ограниченное число связей.
- Поляризуемость определяется способностью изменять полярность под действием внешнего электрического поля.
- Энергия необходимая для разрушения связи, определяющая её прочность.
 Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (h3), хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (h3), хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
H· + ·H → H-H молекула имеет одинарную неполярную связь,
O: + :O → O=O молекула имеет двойную неполярную,
Ṅ: + Ṅ: → N≡N молекула имеет тройную неполярную.
В качестве примеров ковалентной связи химических элементов можно привести молекулы углекислого (CO2) и угарного (CO) газа, сероводорода (h3S), аммиака (Nh4), соляной кислоты (HCL), воды (h3O), метана (Ch5), оксида серы (SO2) и многих других.
В молекуле CO2 взаимосвязь между углеродом и атомами кислорода ковалентная полярная, так как более электроотрицательный водород притягивает к себе электронную плотность. Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Как определить химическую связь вещества
Для того чтобы определиться с типом связи в той или иной молекуле, достаточно рассмотреть составляющие её атомы. Простые вещества металлы образуют металлическую, металлы с неметаллами — ионную, простые вещества неметаллы — ковалентную неполярную, а молекулы, состоящие из разных неметаллов, образуются посредством ковалентной полярной связью.
Химическая связь: определение, типы, свойства

Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Что такое химическая связь
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы химических связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.

Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная химическая связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.

На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Химическая связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.

Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид химической связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства химических связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Химическая связь, видео
И в завершение познавательное видео об разных видах химической связи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Bonding: Definition, Types, Properties.
Классификация химических связей.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY) < E(X) + E(Y)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
Упрощенно можно считать, что в основе химических связей лежат электростатические силы, обусловленные взаимодействиями положительно заряженных ядер и отрицательно заряженных электронов.
В образовании химических связей элементов главных подгрупп принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными. Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s-орбитали и 1 на 2p-орбитали:

При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:

Примеры веществ с ковалентной полярной связью:
СCl4, H2S, CO2, NH3, SiO2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:

Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH4+:

Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом, а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом.
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:
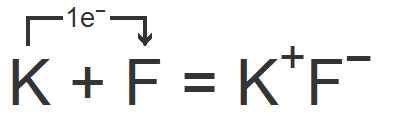
Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F−, Cl−, S2-), а также между простыми катионами и сложными анионами (NO3−, SO42-, PO43-, OH−). Поэтому к ионным соединениям относят соли и основания (Na2SO4, Cu(NO3)2, (NH4)2SO4), Ca(OH)2, NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+ , где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.

То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:

Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Основные виды химической связи — параграф 56 ГДЗ химия 8 Рудзитис
1. Объясните почему численные значения электроотрицательности атомов элементов позволяют судить о виде химической связи, возникающей между ними. Приведите примеры.
Электроотрицательность — способность атомов данного элемента оттягивать на себя электроны атомов других элементов в соединениях. Обычно используют относительную электроотрицательность, где за единицу принята электроотрицательность лития (см. § 55. Электроотрицательность химических элементов).
Чем больше разница в электроотрицательности химических элементов в соединении, тем сильнее атом более электроотрицательного элемента оттягивает на себя электроны. И тем более полярна химическая связь в соединении.
Например, NaF, KCl, LiF — будут типичными соединениями с ионной связью. H2S, HBr, CH4 — представители соединений с ковалентной полярной связью. А молекулы простых веществ, таких как H2, Cl2, O2 будут иметь ковалентную неполярную связь, так как разность в электроотрицательности элементов этих соединений равна нулю.
2. В тетрадях напишите по три формулы соединений: а) с ионной; б) с ковалентной полярной; в) с ковалентной неполярной связью. Изобразите их электронные формулы.
3. Изобразите структурные формулы молекул воды и хлороводорода.
H-O-H и H-Cl
4. Учитывая значения электроотрицательностей элементов (см. таблицу) составьте химические формулы и укажите сдвиг общих электронных пар в соединениях: а) лития с азотом; б) кислорода с фтором; в) углерода с серой; г) углерода с алюминием.
По таблице мы можем определить, какой элемент будет более электроотрицательным. А по таблице Менделеева узнать, сколько электронов есть у этого элемента и сколько электронов ему не хватает до устойчивой оболочки благородного газа.
а) Более электроотрицательный — азот. Находится в V группе, значит ему не хватает 3 электрона. У лития (I группа) есть 1 электрон. Таким образом мы можем написать формулу соединения и указать сдвиг:
Li3 –> N
б) Более электроотрицательный — фтор. Находится в VII группе, значит ему не хватает 1 электрона. У кислорода (VI группа) есть 2 электрона (почему 2, а не 6 вы узнаете в старших классах). Таким образом мы можем написать формулу соединения и указать сдвиг:
O –> F2
в) Углерод и сера имеют равные значения электроотрицательности. Поэтому такую связь можно считать ковалентной неполярной и не учитывать сдвиг. Однако, преимущество все же есть у серы, которой не хватает 2 электрона до устойчивой конфигурации. У углерода же есть сразу 4 электрона. Таким образом мы можем написать формулу соединения:
C – S2
г) Более электроотрицательный — углерод, которому не хватает 4 электрона. У алюминия есть 3. Таким образом мы можем написать формулу соединения и указать сдвиг:
Al4 –> C3
Типы химической связи | himiyaklas.ru
Химическая связь – это сила, удерживающая друг с другом частицы, образующие вещество.
В зависимости от частиц, которые удерживают эти силы, связи подразделяются на внутримолекулярные и межмолекулярные.

Внутримолекулярные связи.
- Ковалентная связь.
Ковалентная связь – это общая электронная пара у двух атомов неметаллов.
Рассмотрим на примере молекулы водорода (Н2), в которой как раз реализуется ковалентная связь.
Молекулы водорода состоит из двух атомов водорода (Н), у которых на внешнем энергетическом уровне один электрон:

Атомы стремятся полностью заполнить свои орбитали. Для этого и объединяются два атома. Они делают свои неспаренные электроны общими: и получается общая электронная пара. Электроны стали спаренными:

Эта общая электронная пара и есть ковалентная химическая связь. Ковалентная связь обозначается либо чертой, соединяющей атомы, либо двумя точками, которые обозначают общую электронную пару:

Представьте, что есть два соседа по парте. Это два атома. Им нужно нарисовать картинку, в которой есть красный и синий цвет. У них есть общая пара карандашей (один красный, другой синий) – это общая электронная пара. Оба соседа по парте пользуются этими карандашами. Таким образом эти два соседа связаны общей парой карандашей, т.е. ковалентной химической связью.
Существует два механизма образования ковалентной химической связи.
- Обменный механизм образования ковалентной связи.
В таком случае каждый атом предоставляет электроны для образования ковалентной связи. Этот механизм мы и рассмотрели, когда знакомились с ковалентной связью:

- Донорно-акцепторный механизм образования ковалентной связи.
В этом случае общая электронная пара, если можно так выразиться, неравноценная.
Один атом имеет НЭП – неподеленную электронную пару (два электрона на одной орбитали). И он предоставляет ее целиком для образования ковалентной связи. Этот атом называется донором – поскольку он предоставляет оба электрона для образования химической связи.
А второй атом имеет только свободную орбиталь. Он принимает электронную пару. Этот атом называется акцептором – он принимает оба электрона.

Классический пример – это образование иона аммония NH4+. Он образуется при взаимодействии иона H+ и аммиака (NH3). Катион водорода H+ – это пустая s-орбиталь.

Эта частица будет акцептором.
У тома азота в аммиаке есть НЭП (неподеленная электронная пара).

Атом азота в аммиаке будет донором:

В данном случае и синий и красный карандаш принес один сосед по парте. Он «угощает» второго. И они оба пользуются карандашами.
Конкретные реакции, в которых образуется такой ион, будут рассмотрены позже в соответствующих разделах. Пока вам просто нужно запомнить принцип, по которому образуется ковалентная связь по донорно-акцепторному механизму.
Ковалентная связь бывает двух видов. Различают ковалентную полярную и неполярную связи.
Ковалентная полярная связь возникает между атомами неметаллов с разными значениями электроотрицательности. То есть между разными атомами неметаллов.
Атом с большим значением электроотрицательности будет оттягивать общую электронную пару на себя.

Ковалентная неполярная связь возникает между атомами неметаллов с одинаковыми значениями электроотрицательности. Такое условие выполняется, если связь возникает между атомами одного химического элемента-неметалла. Поскольку у разных атомов электроотрицательности могут быть очень близкими друг к другу, но все равно будут отличаться.
Общая электронная пара не будет смещаться ни к одному атому, так как каждый атом «тянет» ее с одинаковой силой: общая электронная пара будет находиться посередине.

И конечно же ковалентная связь может быть одинарной, двойной и тройной:

- Ионная связь.
Ионная связь возникает между атомами металла и неметалла. Поскольку у металла и неметалла большая разница в электроотрицательности, электронная пара полностью оттягивается к более электроотрицательному атому – атому неметалла.
Конфигурация полностью заполненного энергетического уровня, достигается не за счет образования общей электронной пары. Неметалл забирает себе электрон металла – заполняет свой внешний уровень. А металлу проще отдать свои электроны (у него их немного) и у него тоже полностью заполненный уровень.

Таким образом металл, отдав электроны, приобретает отрицательный заряд, становится катионом. А неметалл, получив электроны, приобретает отрицательный заря, становится анионом.
Ионная химическая связь представляет собой электростатическое притяжение катиона к аниону.

Ионная связь имеет место в солях, оксидах и гидроксидах металлов. И в других веществах, в которых атом металла связан с атомом неметалла (Li3N, CaH2).
Здесь следует обратить внимание на одну важную особенность: ионная связь имеет место между катионом и анионов во всех солях. Наиболее общим образом мы описываем как связь металл-неметалл. Но необходимо понимать, что это сделано лишь для упрощения. В составе соли может и не быть атома металла. Например, в солях аммония (NH4Cl, (NH4)2SO4. Ион аммония NH4+ притягивается к аниону соли – это ионная связь.
Откровенно говоря, нет никакой ионной связи. Ионная связь – это всего лишь крайняя степень ковалентной полярной связи. У любой связи есть свой процент «ионности» – это зависит от разности электроотрицательностей. Но в школьной программе, а тем более в требованиях ЕГЭ ионная и ковалентная связь – это совершенно два разных понятия, которые нельзя смешивать.
- Металлическая связь.
Все великолепие металлической связи можно понять лишь вместе с металлической кристаллической решеткой. Поэтому металлическую связь мы рассмотрим позже, когда будем разбирать кристаллические решетки.
Все, что пока нужно знать – это то, что металлическая связь реализуется в простых веществах – металлах.

Межмолекулярные связи.
Межмолекулярные связи гораздо слабее внутримолекулярных, так как в них не замешана общая электронная пара.
- Водородные связи.
Водородные связи возникают в вещества, в которых атом водорода связан с атомом с высоким значением электроотрицательности (F, O, Cl, N).
В таком случае связь с атомов водорода становится сильнополярной. Электронная пара смещается от атома водорода к более электроотрицательному атому. Из-за этого смещения, на водороде появляется частичный положительный заряд (δ+), а на электроотрицательном атоме частичный отрицательный заряд (δ-).
Например, в молекуле фтороводорода:

К δ+ одной молекулы притягивается δ- другой молекулы. Это и есть водородная связь. Графически на схеме она обозначается пунктирной линией:

Молекула воды может образовывать четыре водородные связи:

Водородные связи обусловливают более низкие температуры кипения и плавления веществ, между молекулами которых они возникают. Сравните сероводород и воду. В воде есть водородные связи – она жидкость при нормальных условиях, а сероводород – газ.
- Силы Ван-дер-Ваальса.
Это очень слабые межмолекулярные взаимодействия. Принцип возникновения такой же, как и у водородных связей. Очень слабые частичные заряды возникают при колебаниях общей электронной пары. И возникают сиюминутные силы притяжения между этими зарядами.
4 типа химических связей
- Образование
- Наука
- Анатомия
- 4 типа химических связей
Джанет Рэй-Дюпри, Пэт Дюпри.
Атомы имеют тенденцию выстраиваться в наиболее стабильные возможные структуры, что означает, что они имеют тенденцию завершать или заполнять свои внешние электронные орбиты. Для этого они соединяются с другими атомами. Сила, которая удерживает атомы вместе в скоплениях, известная как молекул , называется химической связью . Есть два основных типа и несколько вторичных типов химических связей:
1 Ионная связь
Ионная связь включает перенос электрона, так что один атом получает электрон, а один атом теряет электрон. Один из образовавшихся ионов несет отрицательный заряд (анион), а другой ион — положительный заряд (катион). Поскольку противоположные заряды притягиваются, атомы связываются вместе, образуя молекулу.
2Ковалентная связь
Самая распространенная связь в органических молекулах, ковалентная связь, включает обмен электронами между двумя атомами.Пара общих электронов образует новую орбиту, которая простирается вокруг ядер обоих атомов, образуя молекулу. Есть два вторичных типа ковалентных связей, имеющих отношение к биологии — полярные связи и водородные связи.
3Полярная связь
Два атома, соединенные ковалентной связью, могут по-разному притягивать электроны в связи, создавая неравномерно распределенный заряд. Результат известен как полярная связь , промежуточный случай между ионной и ковалентной связью, при которой один конец молекулы слегка заряжен отрицательно, а другой конец — слегка положительно заряжен.
Эти незначительные дисбалансы в распределении зарядов обозначены на рисунке дельта-символами в нижнем регистре с надстрочным индексом заряда (+ или -). Хотя полученная молекула нейтральна, на близких расстояниях неравномерное распределение заряда может быть важным. Вода — пример полярной молекулы; конец кислорода имеет небольшой положительный заряд, тогда как концы водорода слегка отрицательны. Полярность объясняет, почему одни вещества легко растворяются в воде, а другие — нет.
4 Водородная связь
Поскольку они поляризованы, две соседние молекулы H 2 O (вода) могут образовывать связь, известную как водородная связь , где (электроотрицательный) атом водорода одной молекулы H 2 O является электростатически притягивается к (электроположительному) атому кислорода соседней молекулы воды.
Следовательно, молекулы воды временно соединяются в решетку с водородными связями. Водородные связи имеют только 1/20 прочности ковалентной связи, но даже этой силы достаточно, чтобы повлиять на структуру воды, создавая многие из ее уникальных свойств, таких как высокое поверхностное натяжение, удельная теплоемкость и теплота испарения. Водородные связи важны во многих жизненных процессах, таких как репликация и определение формы молекул ДНК.
Об авторе книги
Эрин Одиа преподает анатомию и физиологию в средней школе Кармел в Кармеле, штат Индиана, одной из лучших школ Индианы.Она также является автором книги «Анатомия и физиология для чайников».
Пэт ДюПри преподавал анатомию / физиологию, биологию, медицинскую терминологию и экологию.
,примеров химических связей
Все в мире вокруг нас состоит из атомов, которые представляют собой крошечные частицы материи. Различные атомы слипаются, образуя самые разные вещи в мире. Химическая связь образуется, когда два или более атома притягиваются друг к другу и образуют химическое соединение.
Как образуются химические связи
Атомы слипаются друг с другом из-за химического притяжения, что означает, что различные типы атомов притягиваются друг к другу и образуют связь.Это притяжение создается из-за электростатической силы, вызванной притяжением между электронами и ядрами.
Существуют различные типы химических связей, в том числе:
Ионные связи
Ковалентные связи
Дативные связи
Сетевые ковалентные связи
Ионные химические связи
связь — это ионная связь. Ионные связи образуются за счет электростатического притяжения атомов с противоположными зарядами.Ион — это атом, который приобрел или потерял один или несколько своих электронов в своей внешней оболочке, что придает атому либо положительный, либо отрицательный заряд.Ионные связи обычно образуются между одним металлическим и одним неметаллическим атомами.
Хлорид натрия или NaCl является примером ионной связи.
Другой пример ионной связи обнаружен во фториде лития (LiF). Литий имеет один электрон во внешней оболочке, а фтор имеет семь электронов во внешней оболочке.В этой ситуации электрон будет продан, так что внешняя оболочка лития заполнится восемью электронами.
Ионные связи создаются потому, что атомы хотят, чтобы их внешние оболочки были заполнены электронами; Итак, когда у атома внешняя оболочка не заполнена, он будет притягиваться к другим атомам, у которых есть лишние электроны.
Ковалентные связи
Ковалентная связь образуется, когда два атома с электроотрицательностью делятся своими электронами, а не обмениваются ими, как это происходит в ионных связях.Два атома водорода могут иметь общий электрон, образуя молекулу h3, и они соединены одной ковалентной связью.
Двойная ковалентная связь обнаруживается в этилене (C2h5), потому что два набора валентных электронов являются общими.
Тройная ковалентная связь видна в атомарном азоте (N2).
Дативная связь
Дативная связь, также называемая координационной ковалентной связью, создается, когда один атом дает оба электрона, необходимые для образования единой ковалентной связи.
Это можно увидеть с аммонием (Nh5 +). Азот дает два электрона, необходимых для связи с водородом и, следовательно, образования аммония с дательной связью.
Это также можно увидеть с гидроксонием (h4O +). В молекуле воды атом кислорода дает пару электронов для создания дательной связи с ионом водорода, образуя таким образом гидроксоний.
Сетчатая ковалентная связь
Иногда элементы образуют ковалентные связи в материале снова и снова, повторяя одну и ту же структуру с образованием очень больших молекул.Когда это происходит, образующиеся связи описываются как ковалентные сети.
Пример этого — алмазы. Углерод соединяется сам с собой, при этом каждый атом углерода образует четыре ковалентные связи с четырьмя другими атомами углерода. Это образует одну большую молекулу, которая представляет собой кристалл алмаза.
Силикаты, которые содержатся в кварце, песке и многих других минералах, также связаны друг с другом сетчатыми ковалентными связями.
Существует несколько различных типов химических связей, которые могут образовываться; но сходство между ними — это притяжение двух атомов.
Примеры химических связей.Примеры химических связей
Химические связиХимическая связь — это сила притяжения между атомами, которая заставляет несколько атомов объединяться по определенному шаблону с образованием соединений. Химические связи могут возникать либо в результате совместного использования и спаривания электронов на самых внешних энергетических уровнях, либо в результате передачи и принятия электронов. Химические связи могут образовывать простые связи, которые связывают только два атома вместе, как газообразный кислород, или они могут образовывать очень сложные замысловатые кристаллизованные структуры, связывая сотни атомов вместе с образованием таких соединений, как гемоглобин или алмаз.Цель химического связывания — создать стабильное соединение, выполняя правило октетов. Правило октетов гласит, что внешний энергетический уровень каждого атома хочет иметь 8 электронов. Когда это правило выполняется, атом считается стабильным. Октет может быть удовлетворен посредством разделения электронов или посредством процесса передачи и принятия электронов для образования химических связей.
Примеры химических связей:
1. Одиночные ковалентные связи образуются, когда между атомами совместно используется только одна пара электронов.Это очень характерно для неметаллических элементов. Вода — это H 2 O, что означает, что у нее один атом кислорода связан с двумя атомами водорода, и каждая связь представляет собой простую ковалентную связь.
2. Двойные ковалентные связи образуются, когда две пары электронов используются совместно участвующими атомами. Газообразный кислород, которым мы дышим, — это O 2 , или два атома кислорода, связанные вместе, но две пары электронов разделяются между атомами кислорода.
3. Тройные ковалентные связи образуются, когда три пары электронов совместно образуют тройную связь.Таким образом связывается азот, который составляет большую часть нашей атмосферы. Он существует как N 2 или два атома азота, связанных вместе тремя парами электронов.
4. Ионные связи обычно образуются между металлом и ионом неметалла. Металл любит отдавать свои электроны, чтобы стать положительно заряженным. Неметалл любит принимать электроны, чтобы стать отрицательно заряженными. Это позволяет создать силу притяжения между положительными и отрицательными ионами.Типичным примером соединения с ионной связью является поваренная соль. Поваренная соль имеет формулу NaCl и образуется из-за того, что натрий Na образует положительный ион, а хлор Cl образует отрицательный ион. Затем два иона притягиваются друг к другу, образуя ионную связь.
Примеры химических связей
.Химическая связь: (типы, образование и факты)
Что такое химическая связь?
Химическая связь — это сила притяжения, которая связывает атомы вместе с образованием новых соединений. Эти связи образуются в процессе, называемом химической реакцией.
Итак, как образуются эти облигации? Чтобы понять эту концепцию, давайте сначала разберемся со структурой атома.
Строение атома
Атом состоит из электронов, протонов и нейтронов. Протоны и нейтроны помещены вместе в ядре; центральная часть атома.Между тем, электроны вращаются вокруг ядра на определенных расстояниях, известных как оболочки. Число электронов в нормальном атоме равно числу протонов, и атом называется нейтральным.
Каждая оболочка атома обладает определенной способностью удерживать электроны. Итак, когда нижние оболочки заполняются, электроны занимают верхние оболочки, чтобы приспособиться к себе. Самая внешняя оболочка атома называется его валентной оболочкой. Первая оболочка может вместить 2 электрона, вторая оболочка может содержать 8 электронов, а третья оболочка может содержать 18 электронов.(Подробнее читайте в том, что такое атом).
Почему образуется химическая связь?
Атомы всегда стараются полностью заполнить свою валентную оболочку электронами, чтобы стать стабильными. Но количество электронов в атоме зависит от количества протонов. Таким образом, в большинстве случаев атомы не могут полностью заполнить свою валентную оболочку. Итак, им нужен способ завершить свою валентную оболочку. По этой причине они образуют связь с другими атомами.
Например: кислород имеет 8 протонов, поэтому он будет нести 8 электронов.Эти электроны будут размещаться в оболочках следующим образом: два электрона перейдут на первую оболочку, а оставшиеся шесть электронов перейдут на вторую оболочку (здесь вторая оболочка является валентной оболочкой). Но, как описано ранее, вторая оболочка может нести 8 электронов, а здесь к ней идут только 6 электронов. Это сделает атом кислорода нестабильным, поэтому атом кислорода каким-то образом попытается заставить эти оставшиеся два электрона завершить свою оболочку, или он попытается потерять эти 6 электронов, чтобы сделать первую оболочку валентной оболочкой.
Типы химической связи
Существует два основных типа
.
