Характеристика ренин-ангиотензин-альдостероновой системы при полиморфных вариантах гена VDR у больных артериальной гипертензией и ожирением | Сенцова
1. Puzyrev V. I. Genetics of arterial hypertension (current research paradigms). Clinical Medicine 2003;1:12-18. Russiаn (Пузырев В. П. Генетика артериальной гипертензии (современные исследовательские парадигмы). Клиническая медицина 2003;1:12-18.)
2. Sun J., Zhao M., Miao S., Xi B. Polymorphisms of three genes (ACE, AGT and CYP11B2) in the renin-angiotensin-aldosterone system are not associated with blood pressure salt sensitivity: A systematic meta-analysis. Blood Press 2016; 25:117-122. DOI: 10.3109/08037051.2015.1110923
3. Kohli S., Kumar R., Gupta M. et al. Impact of interactions between risk alleles on clinical endpoints in hypertension.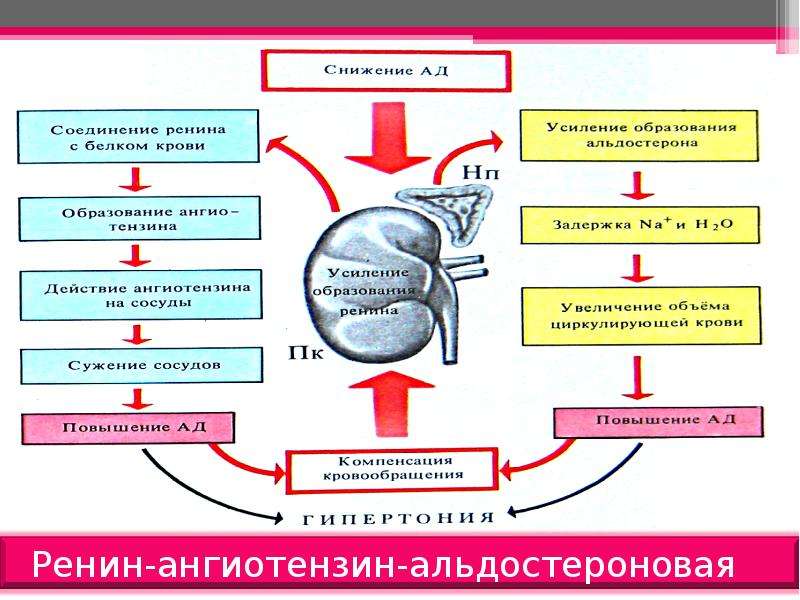
4. Ozaki K. Genetic background of heart failure: SNP association study for heart failure and the underlying diseases. Rinsho Byori 2013;2:167-175. PMID:23672095
5. Jhun M. A., Hu H., Schwartz J. et al. Effect modification by vitamin D. receptor genetic polymorphisms in the association beetwen cumulative lead exposure and puls pressure: a longitudinal study. Environ Health 2015;13:14-15. DOI: 10.1186/1476-069X-14-5
6. Wang L., Chu A., Buring J. E. et al. Common genetic variations in the vitamin D. pathway in relation to blood pressure. Am J. Hypertens 2014;11:1387-1395. DOI: 10.1093/ajh/hpu049
7. Basit S. Vitamin D.
11. Cooke A. A., Connaughton R. M., Lyons C. L. et al. Fatty acids and chronic low grade inflammation associated with obesity and the metabolic syndrome. Eur J. Pharmacol 2016;5:207-214. DOI: 10.1016/j.ejphar. 2016.04.021
12. Favre G. A., Esnault V. L., Van Obberghen E. Modulation of glucose metabolism by the renin-angiotensin-aldosterone system. Am J. Physiol Endocrinol Metab 2015;6:435-449. DOI: 10.1152/ajpendo. 00391.2014
13. Kang Y. S. Obesity associated hypertension: new insights into mechanism. Electrolyte Blood Press 2013;2:46-52. DOI: 10.5049/EBP. 2013.11.2.46
 Персонализированная медицина: современное состояние и перспективы. Вестник Российской академии медицинских наук 2012; 12:4-12. DOI:10.15690/vramn. v67i12.474
Персонализированная медицина: современное состояние и перспективы. Вестник Российской академии медицинских наук 2012; 12:4-12. DOI:10.15690/vramn. v67i12.474— минералокортикоиды — Биохимия
Строение альдостерона
Альдостерон у человека является основным представителем минералокортикоидных гормонов, производных холестерола.
Синтез
Осуществляется в клубочковой зоне коры надпочечников. Образованный из холестерола прогестерон на пути к альдостерону подвергается последовательному окислению 21-гидроксилазой, 11-гидроксилазой и 18-гидроксилазой. В конечном итоге образуется альдостерон.
Схема синтеза стероидных гормонов (полная схема)
Регуляция синтеза и секреции
Активируют:
- ангиотензин II, выделяемый при активации ренин-ангиотензиновой системы,
- повышение концентрации ионов калия в крови (связано с деполяризацией мембран, открытием кальциевых каналов и активацией аденилатциклазы).

Активация ренин-ангиотензиновой системы
- Для активации этой системы существует два пусковых момента:
- снижение давления в приносящих артериолах почек, которое определяется барорецепторами клеток юкстагломерулярного аппарата. Причиной этого может быть любое нарушение почечного кровотока – атеросклероз почечных артерий, повышенная вязкость крови, обезвоживание, кровопотери и т.п.
- снижение концентрации ионов Na+ в первичной моче в дистальных канальцах почек, которое определяется осморецепторами клеток юкстагломерулярного аппарата. Возникает в результате бессолевой диеты, при длительном использовании диуретиков.
Постоянная и независимая от почечного кровотока секреция ренина (базовая) поддерживается симпатической нервной системой.
- При выполнении одного или обоих пунктов клетки юкстагломерулярного аппарата активируются и из них в плазму крови секретируется фермент ренин.

- Для ренина в плазме имеется субстрат – белок α2-глобулиновой фракции ангиотензиноген. В результате протеолиза от белка отщепляется декапептид под названием ангиотензин I. Далее ангиотензин I при участии ангиотензин-превращающего фермента (АПФ) превращается в ангиотензин II.
- Главными мишенями ангиотензина II служат гладкие миоциты кровеносных сосудов и клубочковая зона коры надпочечников:
- стимуляция кровеносных сосудов вызывает их спазм и восстановление артериального давления.
- из надпочечников после стимуляции секретируется альдостерон, действующий на дистальные канальцы почек.
При воздействии альдостерона на канальцы почек увеличивается реабсорбция ионов Na+, вслед за натрием движется вода. В результате давление в кровеносной системе восстанавливается и концентрация ионов натрия увеличивается в плазме крови и, значит, в первичной моче, что снижает активность РААС.
Активация ренин-ангиотензин-альдостероновой системы
Механизм действия
Цитозольный.
Мишени и эффекты
Воздействует на слюнные железы, на дистальные канальцы и собирательные трубочки почек. В почках усиливает реабсорбцию ионов натрия и потерю ионов калия посредством следующих эффектов:
- увеличивает количество Na+,K+-АТФазы на базальной мембране эпителиальных клеток,
- стимулирует синтез митохондриальных белков и увеличение количества нарабатываемой в клетке энергии для работы Na+,K+-АТФазы,
- стимулирует образование Na-каналов на апикальной мембране клеток почечного эпителия.
Патология
Гиперфункция
Синдром Конна (первичный альдостеронизм) – возникает при аденомах клубочковой зоны. Характеризуется триадой признаков: гипертензия, гипернатриемия, алкалоз.
Вторичный гиперальдостеронизм – гиперплазия и гиперфункция юкстагломерулярных клеток и избыточная секреция ренина и ангиотензина II. Отмечается повышение артериального давления и появление отеков.
Отмечается повышение артериального давления и появление отеков.
Между ангиотензином II и глюкокортикоидами существует взаимодействие типа «плюс-плюс». Это подразумевает, что ангиотензин II способствует синтезу глюкокортикоидов, а те, в свою очередь, стимулируют синтез ангиотензина II. Это отчасти объясняет патогенез гипертонической болезни в результате нервных переживаний.
Механизмы развития артериальной гипертензии при ожирении
МЕХАНИЗМЫ РАЗВИТИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ ПРИ ОЖИРЕНИИ
Артериальная гипертензия – синдром стойкого повышения артериального давления с многофакторными механизмами развития. По современным представлениям данное патологическое состояние рассматривается с позиций дезорганизации различных звеньев сложной системы, удерживающей артериальное давление на нормальном уровне.
Основная роль в поддержании давления в артериях принадлежит симпато-адреналовой системе — условно выделенной структуре, которая включает определенные отделы головного мозга (гипоталамус, нейроретикулярную формацию ствола), периферические симпатические ганглии, симпатические нервы и мозговое вещество надпочечников.
Повышение активности центральных отделов симпато-адреналовой системы приводит к генерированию импульсов, передающихся через симпатические нервы к тканям-мишеням. Более крупные нервы, подходящие к сосудам, разветвляются на тонкую сеть волокон, имеющих на конце расширения — адренергические синапсы (структуры передачи сигнала). Под влиянием нервных импульсов в синапсах происходит высвобождение медиатора (биологически активного вещества) — норадреналина, воздействующего на рецепторы гладкомышечных клеток сосудов.
Адренергические синапсы мышечных клеток артерий и артериол имеют в своей структуре α-адренорецепторы (α1 и α2) и β-адренорецепторы (β1 и β2). Активация α1-адренорецепторов приводит к вазоконстрикции (уменьшению просвета сосуда), β2-адренорецепторов — к вазодилатации (расширению просвета). Количество постсинаптических α 1-адренорецепторов значительно преобладает над β-адренорецепторами, поэтому выброс из синапсов норадреналина в итоге вызывает сужение сосудов (вазоконстрикцию).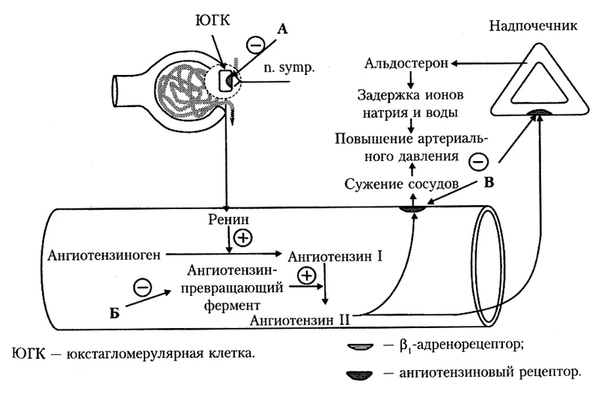
Активность симпато-адреналовой системы регулируется центрами, расположенными в рострально-вентролатеральной области продолговатого мозга, и получающими информацию от барорецепторов (реагирующих на изменения давления) синокаротидной зоны (сегмента сонных артерий) и аорты.
Механизмы развития артериальной гипертензии
Возбуждение α2-адрено- и I1-имидазолиновых рецепторов продолговатого мозга снижает активность симпатического и стимулирует деятельность парасимпатического отдела вегетативной нервной системы (являющегося антагонистом симпатического). Перечисленные эффекты ведут к снижению тонуса артерий и артериол, и, следовательно, величины артериального давления. Стимуляция I
Другим путем регуляции артериального давления является ренин-ангиотензиновая система – сложно организованная функциональная структура, включающая ряд взаимодействующих субстанций (ренин, ангиотензиноген, ангиотензин I, ангиотензин превращающий фермент, ангиотензин II и др. ). Ренин-ангиотензиновая система подразделяется на циркулирующую (переносимые с кровью факторы) и локальную (присутствующие в миокарде, сосудах, почках и головном мозге компоненты).
). Ренин-ангиотензиновая система подразделяется на циркулирующую (переносимые с кровью факторы) и локальную (присутствующие в миокарде, сосудах, почках и головном мозге компоненты).
Механизм действия ренин-ангиотензиновой системы активируется высвобождением ренина в результате стимуляции β1— и β2-адренорецепторов юкста-гломерулярного аппарата почек, падением давления в сосудах клубочков, снижением концентрации натрия, хлора и повышением уровня калия в плазме крови. Под действием ренина через ряд ферментативных реакций ангиотензиноген превращается в биологически активные вещества белковой природы – ангиотензин и ангиотензин-II (являющиеся по своему действию антагонистами). Описанные химические превращения происходят под действием ангиотензин-превращающего фермента (АПФ, АПФ-2).
Ангиотензин-II является главным звеном ренин-ангиотензиновой системы, оказывающим влияние на многие органы и ткани через специфические рецепторы 1-го и 2-го типов (AT1— и АТ2).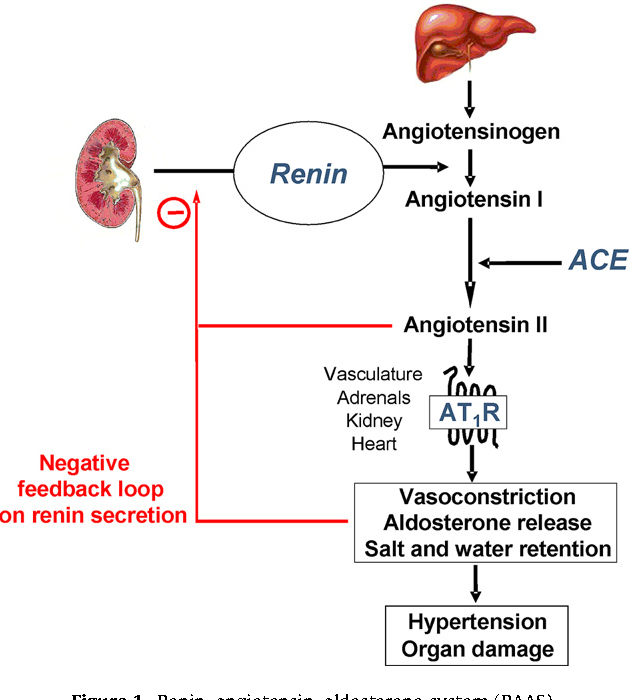 К непосредственным эффектам ангиотензина-II относятся усиление сокращений миокарда, вазоконстрикция артерий и артериол, усиление синтеза альдостерона и выброса катехоламинов (адреналина и норадреналина) надпочечниками, увеличение реабсорбции натрия и воды в почках, стимуляция выброса норадреналина симпатическими нервными окончаниями.
К непосредственным эффектам ангиотензина-II относятся усиление сокращений миокарда, вазоконстрикция артерий и артериол, усиление синтеза альдостерона и выброса катехоламинов (адреналина и норадреналина) надпочечниками, увеличение реабсорбции натрия и воды в почках, стимуляция выброса норадреналина симпатическими нервными окончаниями.
Результатом действия циркулирующей ренин-ангиотензиновой системы является быстрое, но кратковременное поддержание необходимого уровня артериального давления. Напротив эффектом локальной (тканевой) системы данного каскада является поддержание необходимых параметров давления за счет долгосрочно действующих механизмов (утолщения стенок сосудов, гипертрофии миокарда, гипертрофии почечных клубочков, нефроангиосклероза и др.). Дезорганизация обеих составляющих (циркулирующей и тканевой) ренин-ангиотензиновой системы является важной причиной развития артериальной гипертензии.
Еще одним важным механизмом регуляции системного сосудистого давления (а также — водно-электролитного баланса) является калликреин-кининовая система, которая также подразделяется на циркулирующую (плазменную) и тканевую (локальную).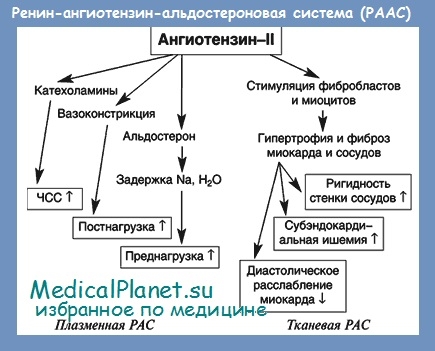 Звеньями биохимического каскада являются прекалликреин, калликреины, кининогены, кинин-превращающий фермент, брадикинин (и другие кинины).
Звеньями биохимического каскада являются прекалликреин, калликреины, кининогены, кинин-превращающий фермент, брадикинин (и другие кинины).
Под действием специфических ферментов прекалликреин превращается в калликреин, стимулирующий трансформацию кининогенов в кинины (биологически активные вещества с широким спектром эффектов). Реализация действия данной группы медиаторов на ткани происходит через активацию кининовых рецепторов (В1-В5).
Сосудорасширяющее и гипотензивное действие кининов происходит за счет непосредственного воздействия на стенку артерий и стимулирования выделения эндотелием вазодилятирующих факторов: оксида азота, простациклина, простагландина E2. Кинины увеличивают выделение натрия и воды почками, уменьшают секрецию адреналина надпочечниками и выделение норадреналина симпатической нервной системой.
При артериальной гипертензии отмечается снижение синтеза калликреина и ускорение дезактивации кининов. Депрессия калликреин-кининовой системы способствует проявлению эффектов эндотелиальных сосудосуживающих факторов, ренин-ангиотезиновой и симпато-адреналовой систем, способствуя развитию артериальной гипертензии.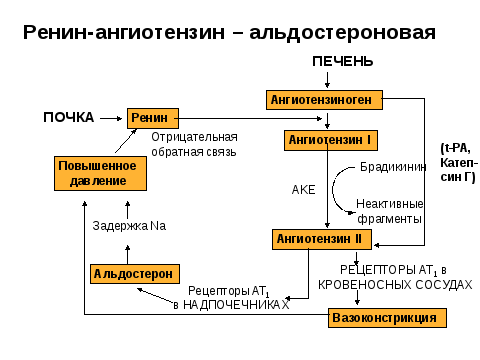
Важным механизмом регуляции тонуса сосудов и уровня артериального давления являются вырабатываемые эндотелием (внутренним слоем) сосудов вазоактивные биологически активные вещества.
Наиболее активным сосудорасширяющим фактором из данной группы медиаторов является оксид азота (NO). Образование NOв эндотелиоцитах происходит из L-аргинина под действием фермента NO-синтетазы. Ключевыми медиаторами синтеза оксида азота являются брадикинин и ацетилхолин. Синтезированные молекулы NO диффундируют через стенку сосуда в гладкомышечные клетки, где запускает цепь ферментативных превращений, приводящих в итоге к снижению концентрации ионизированного кальция. Результатом указанных химических реакций является расслабление миоцитов сосудов и вазодилятации.
К другим биологически-активным веществам эндотелиального происхождения, обладающим сосудорасширяющим эффектом, относятся эндотелиальный вазодилатирующий гиперполяризующий фактор, простациклин, адреномедулин, натрийуретические пептиды (А, В, С).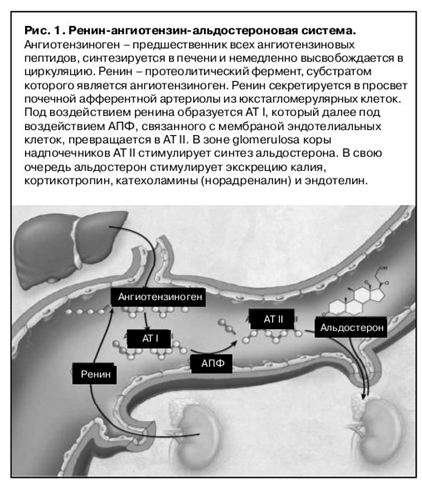
Недостаточности продукции клетками эндотелия снижающих тонус сосудов медиаторов, в первую очередь – NO, в настоящее время отводится одна из ключевых ролей в развитии артериальной гипертензии.
Подводя итог обзору различных механизмов развития артериальной гипертензии, следует подчеркнуть этиологическую и патогенетическую многофакторность этого заболевания. Стойкое повышение артериального давления является следствием взаимодействия генетических особенностей индивидуума и факторов внешней среды, приводящее к запуску основных патогенетических механизмов развития заболевания: активации симпатоадреналовой и ренин-ангаотензин-альдостероновой систем, снижения активности калликреин-кининовой системы и депрессорной функции почек, синтетической дисфункции эндотелия. Важнейшим звеном патогенеза артериальной гипертензии является истощение депрессорной системы организма (механизмов снижения артериального давления), стойкая вазоконстрикция и ремоделирование строения артерий (утолщение стенок и т. д.), приводящие к значительному росту периферического сосудистого сопротивления и стабилизации высокого артериального давления.
д.), приводящие к значительному росту периферического сосудистого сопротивления и стабилизации высокого артериального давления.
Ренин-ангиотензин-альдостероновая система — это… Что такое Ренин-ангиотензин-альдостероновая система?
- Ренин-ангиотензин-альдостероновая система
Схема работы ренин-ангиотензиновой системы (англ.)
Ренин-ангиотензиновая система (РАС) или ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в организме.
Компоненты системы
См.также
Ссылки
Wikimedia Foundation. 2010.
- Ренин-ангеотензин-альдостероновая система
- Рениприл
Смотреть что такое «Ренин-ангиотензин-альдостероновая система» в других словарях:
Ренин-ангеотензин-альдостероновая система — Схема работы ренин ангиотензиновой системы (англ.
 ) Ренин ангиотензиновая система (РАС) или ренин ангиотензин альдостероновая система (РААС) это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в… … Википедия
) Ренин ангиотензиновая система (РАС) или ренин ангиотензин альдостероновая система (РААС) это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в… … Википедиясистема ренин-ангиотензин-альдостероновая — (син. система ренин ангиотензинная) совокупность последовательно образующихся в организме биологически активных веществ, участвующих в регуляции водно солевого обмена и артериального давления; включает ренин, ангиотензиноген, ангиотензины и… … Большой медицинский словарь
Ренин-ангиотензиновая система — Схема работы ренин ангиотензиновой системы (англ.) Ренин ангиотензиновая система (РАС) или ренин ангиотензин альдостероновая система (РААС) это гормональная система … Википедия
система ренин-ангиотензинная — см. Система ренин ангиотензин альдостероновая … Большой медицинский словарь
Приленап — Действующее вещество ›› Гидрохлоротиазид* + Эналаприл* ( Hydrochlorothiazide* + Enalapril*) Латинское название Prilenap АТХ: ›› C09BA02 Эналаприл в комбинации с диуретиками Фармакологические группы: Ингибиторы АПФ в комбинациях ›› Ингибиторы АПФ… … Словарь медицинских препаратов
Энап-HЛ — Действующее вещество ›› Гидрохлоротиазид* + Эналаприл* ( Hydrochlorothiazide* + Enalapril*) Латинское название Enap HL АТХ: ›› C09BA02 Эналаприл в комбинации с диуретиками Фармакологическая группа: Ингибиторы АПФ в комбинациях Нозологическая… … Словарь медицинских препаратов
Энап-HЛ 20 — Действующее вещество ›› Гидрохлоротиазид* + Эналаприл* ( Hydrochlorothiazide* + Enalapril*) Латинское название Enap HL 20 АТХ: ›› C09BA02 Эналаприл в комбинации с диуретиками Фармакологическая группа: Ингибиторы АПФ в комбинациях Нозологическая… … Словарь медицинских препаратов
Энап-Н — Действующее вещество ›› Гидрохлоротиазид* + Эналаприл* ( Hydrochlorothiazide* + Enalapril*) Латинское название Enap H АТХ: ›› C09BA02 Эналаприл в комбинации с диуретиками Фармакологическая группа: Ингибиторы АПФ в комбинациях Нозологическая… … Словарь медицинских препаратов
Адренокортикотропный гормон — Производные проопиомеланокортина: Проопиомеланокортин γ MSH АКТГ … Википедия
Список медицинских сокращений — Эта страница глоссарий.
 # А … Википедия
# А … Википедия
Ренин-ангиотензиновая система — это… Что такое Ренин-ангиотензиновая система?
Схема работы ренин-ангиотензиновой системы (англ.)Ренин-ангиотензиновая система (РАС) или ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в организме.
Компоненты системы
Компоненты Ренин-ангиотензиновой (Ренин-ангиотензин альдостероновой) системы
Ренин-ангиотензин альдестероновый каскад начинается с биосинтеза препрорениновой из рениновой мРНК в юкстагломерулярных клетках и превращается в проренин путем отщепления 23 аминокислот. В эндоплазматическом ретикулуме проренин подвергается гликозилированию и приобретает 3-D структуру, которая характерна для аспартатных протеаз. Готовая форма проренина состоит из последовательности включающей 43 остатка присоединенных к N-концу ренина, содержащего 339-341 остаток.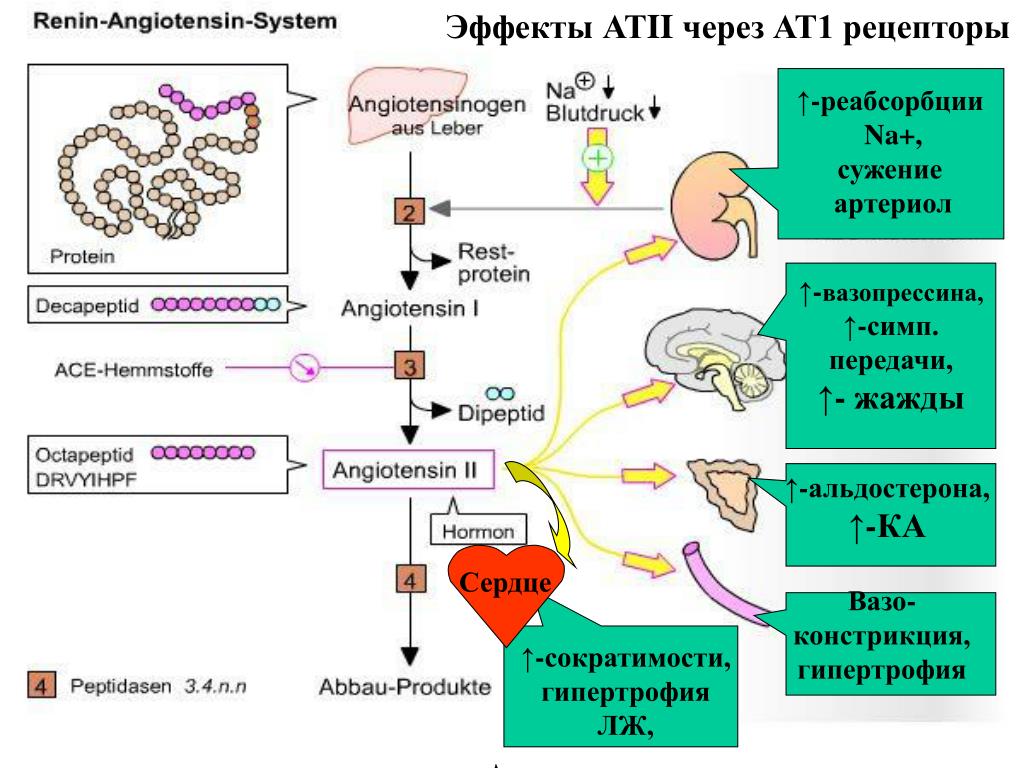 Предполагается, что дополнительная последовательность проренина (prosegment) связана с ренином для предотвращения взаимодействия с ангиотензиногеном. Большая часть проренина свободно выбрасывается в системный кровоток путем экзоцитоза, но некоторая доля превращается в ренин путем действия эндопептидаз в секреторных гранулах юкстагломерулярных клеток. Ренин, образуемый в секреторных гранулах в дальнейшем выделяется в кровоток, но этот процесс жестко контролируется давлением , Ang 2, NaCl, через внутриклеточные концентрации ионов кальция. Поэтому у здоровых людей объем циркулирующего проренина в десять раз выше концентрации активного ренина в плазме . Однако, все же остается не понятным, почему концентрация неактивного предшественника настолько высока.
Предполагается, что дополнительная последовательность проренина (prosegment) связана с ренином для предотвращения взаимодействия с ангиотензиногеном. Большая часть проренина свободно выбрасывается в системный кровоток путем экзоцитоза, но некоторая доля превращается в ренин путем действия эндопептидаз в секреторных гранулах юкстагломерулярных клеток. Ренин, образуемый в секреторных гранулах в дальнейшем выделяется в кровоток, но этот процесс жестко контролируется давлением , Ang 2, NaCl, через внутриклеточные концентрации ионов кальция. Поэтому у здоровых людей объем циркулирующего проренина в десять раз выше концентрации активного ренина в плазме . Однако, все же остается не понятным, почему концентрация неактивного предшественника настолько высока.
Контроль секреции ренина
Активная секреция ренина регулируется четырьмя независимыми факторами:
- почечным барорецепторным механизмом в афферентной артериоле, который улавливает изменение почечного перфузионного давления.

- Изменениями уровня NaCl в дистальном отделе нефрона. Этот поток измеряется как изменение концентрации Cl— клетками плотного пятна дистального извитого канальца нефрона в области, прилегающей к почечному тельцу.
- Стимуляцией симпатическими нервами через бета-1 адренергические рецепторы.
- Механизмом отрицательной обратной связи, реализованным через прямое действие ангиотензина 2 на юкстагломерулярные клетки. Секрецию ренина активирует снижение перфузионного давления или уровня NaCl и повышение симпатической активности. Ренин также синтезируется и других тканях, включая мозг, надпочечник, яичники, жировая ткань, сердце и сосудах.
Контроль секреции ренина — определяющий фактор активности РААС.
Механизм действия Ренин-ангиотензиновой системы
Ренин регулирует начальный, ограничивающий скорость, этап РААС путем отщепления N-концевого сегмента ангиотензиногена для формирования биологически инертного декапептида ангиотензина 1 или Ang-(1-10).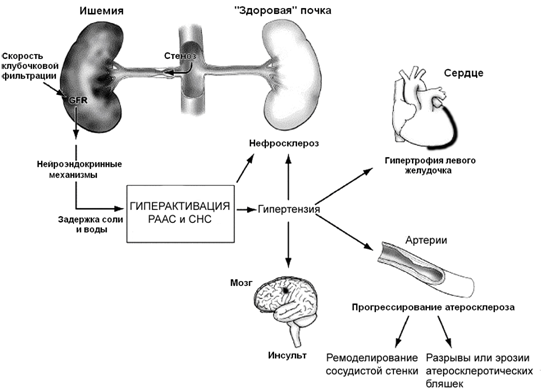 Первичный источник ангиотензиногена — печень. Долговременный подъем уровня ангиотензиногена в крови, который происходит во время беременности, при синдроме Кушинга или при лечении глюкокортикоидами, может вызвать гипертензию, хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина. Неактивный декапептид Ang 1 гидролизуется ангиотензин-конвериртирующим ферментом (ACE), который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 [Ang-(1-8)], биологически активный, мощный вазоконстриктор. АСЕ представляет собой экзопептидазу и секретируется главным образом легочным и почечным эндотелием, нейроэпителиальными клетками. Ферментативная активность АСЕ заключается в повышении вазоконстрикции и снижении вазодилятации.
Первичный источник ангиотензиногена — печень. Долговременный подъем уровня ангиотензиногена в крови, который происходит во время беременности, при синдроме Кушинга или при лечении глюкокортикоидами, может вызвать гипертензию, хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина. Неактивный декапептид Ang 1 гидролизуется ангиотензин-конвериртирующим ферментом (ACE), который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 [Ang-(1-8)], биологически активный, мощный вазоконстриктор. АСЕ представляет собой экзопептидазу и секретируется главным образом легочным и почечным эндотелием, нейроэпителиальными клетками. Ферментативная активность АСЕ заключается в повышении вазоконстрикции и снижении вазодилятации.
Новые данные о компонентах Ренин-ангиотензиновой системы
Хотя Ang2 наиболее биологически активный продукт РААС, существуют данные, что другие метаболиты агиотензинов 1 и 2 могу также могут иметь значительную активность. Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путем отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов, например, в мозге и почках. Ang 3 [Ang-(2-8)], гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV [Ang-(3-8)] гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу, вызываемое действием этих ангиотензинов на AT1-рецептор. Причем этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора. Пептиды, получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом ACE, названным ACE2) конкретно на Ang2.
Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путем отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов, например, в мозге и почках. Ang 3 [Ang-(2-8)], гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV [Ang-(3-8)] гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу, вызываемое действием этих ангиотензинов на AT1-рецептор. Причем этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора. Пептиды, получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом ACE, названным ACE2) конкретно на Ang2.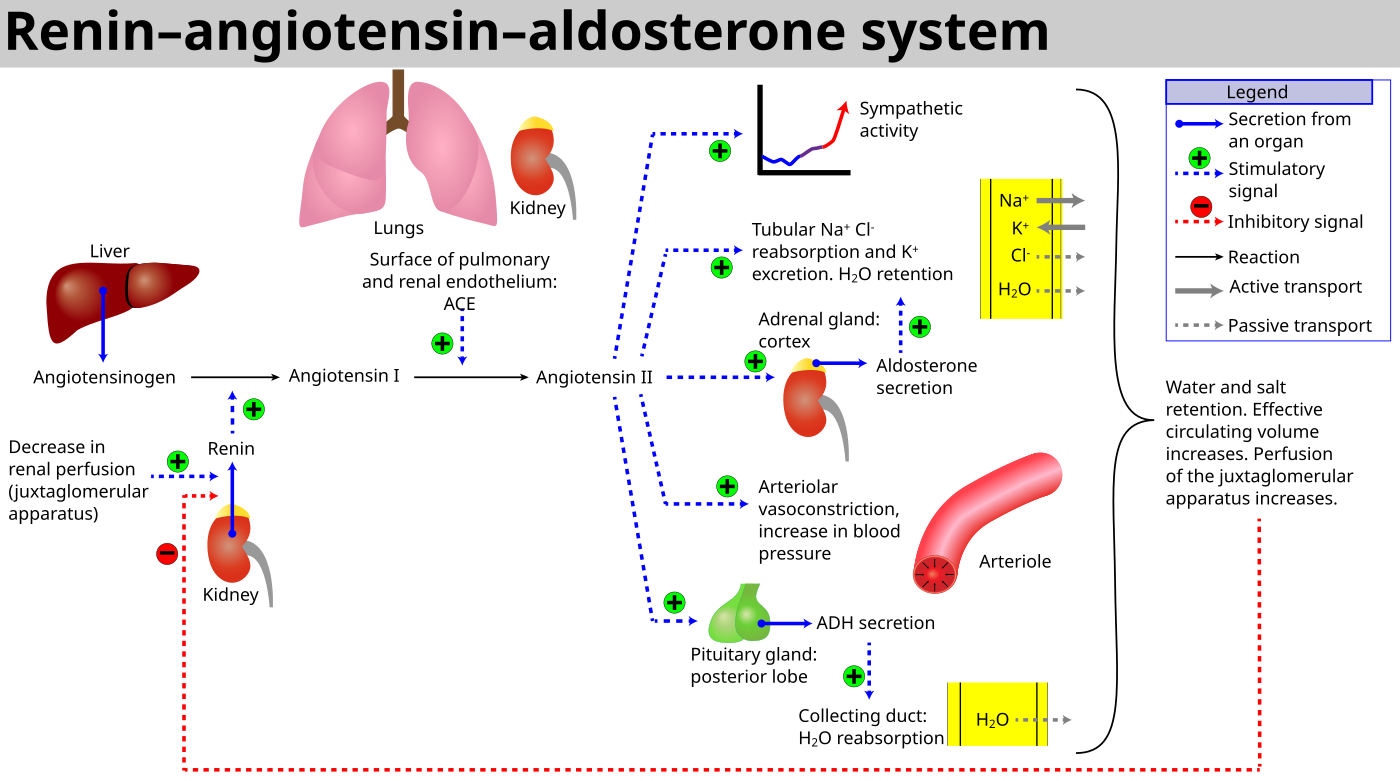 В отличие от ACE, ACE2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определенные рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. ACE2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
В отличие от ACE, ACE2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определенные рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. ACE2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
Рецепторы к Ангиотензину II
Описаны как минимум 4 подтипа рецепторов к ангиотензину.
- Первый тип AT1-R участвует в реализации наибольшего числа установленных физиологических и патофизиологических функций ангиотензина 2. Действие на сердечно-сосудистую систему (вазоконстрикция, повышение давления крови, повышение сократимости сердца, сосудистая и сердечная гипертония), действие на почки (реабсорбция Na+, ингибироавние выделения ренина), симпатическую нервную систему, надпочечника (стимуляция синтеза альдостерона).
 AT1-R рецетор также является посредником в влияниях ангиотензина на клеточный рост, пролиферацию, воспалительные реакции, и оксидативный стресс. Этот рецептор связан с G-белком и содержит семь встроенных в мембрану последовательностей. AT1-R широко представлен во многих типах клеток, являющихся мишенью Ang 2.
AT1-R рецетор также является посредником в влияниях ангиотензина на клеточный рост, пролиферацию, воспалительные реакции, и оксидативный стресс. Этот рецептор связан с G-белком и содержит семь встроенных в мембрану последовательностей. AT1-R широко представлен во многих типах клеток, являющихся мишенью Ang 2. - Второй тип AT2-R широко представлен в период эмбрионального развития мозга, почек затем же в период постнатального развития количество этого рецептора падает. Имеются данные, что, несмотря на низкий уровень экспрессии во взрослом организме, AT2 рецептор может выступать в качестве посредника в процессе вазодилятации и также оказывать антипролиферативный и антиапоптотичекие эффекты в гладких мышцах сосудов и угнетать рост кардиомиоцитов. В почках, как предполагается, активация AT2 влиять на реабсорбцию в проксимальных извитых канальцах и стимулировать реакции превращения простагландина E2 в простагландин F2α.2,7. Однако, важность некоторых из этих At2 связанных действий остается неизученной.

- Функции третьего типа (AT3) рецепторов не до конца изучены.
- Четвертый тип рецепторов (AT4) участвует в выделении ингибитора активатора плазминогена (под действием ангиотензина 2, а также 3 и 4). Предполагается, что эффекты характерные для Ang 1-7, включая вазодилятацию, натрийурез, снижение пролиферации, и защита сердца, реализуются через уникальные рецепторы, которые не связываются с Ang 2, такими как MAS рецепторы.
Также нужно отметить, что последние данные указывают на существование высокоаффинных поверхностных рецепторов, которые связывают как ренин, так и проренин. Они находятся в тканях мозга, сердца, плаценты и почек (в поэндотелиальной гладкой мускулатуре и мезангие). Эффекты таких рецепторов направлены на локальное увеличение выработки Ang2 и запуска внеклеточных киназ, таких как, MAP -киназ, к которым относится ERK1 и ERK2. Эти данные пролили свет на Ang2-независимые механизмы клеточного роста, активируемые ренином и проренином.
Влияние на прочие секреции
Как отмечалось ранее Ang2, через AT1 рецепторы стимулирует выработку альдостерона клубочковой зоной надпочечника .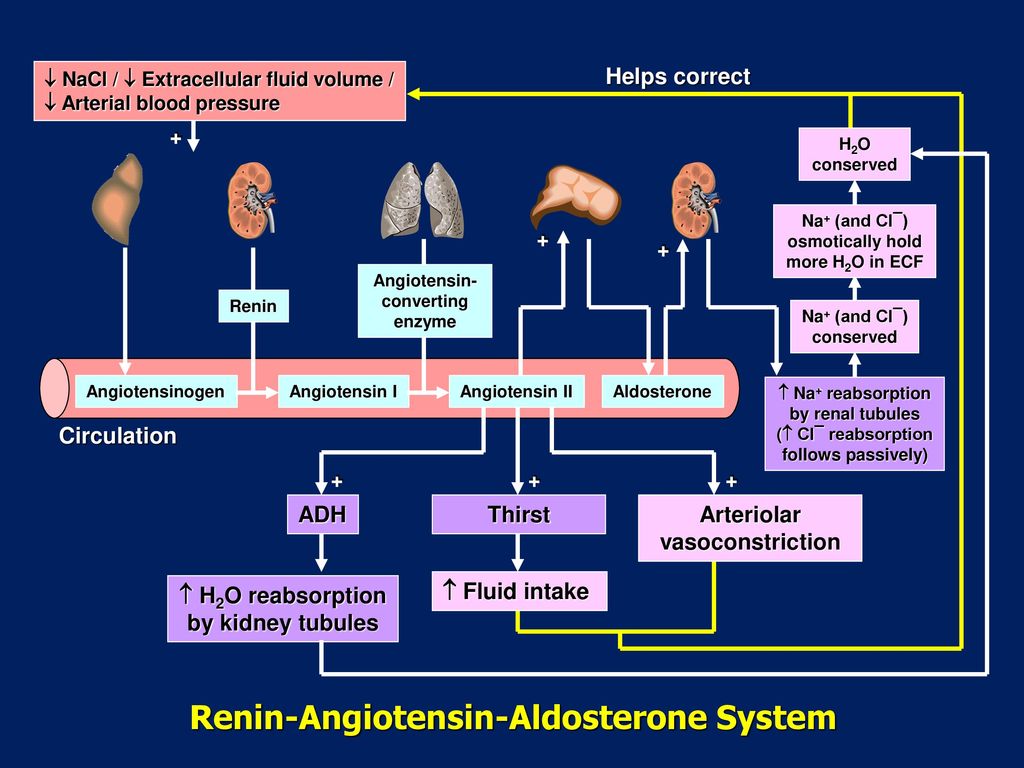 Альдостерон наиболее важный регулятор K+- Na+ баланса и таким образом играет важную роль в контроле объема жидкостей. Он увеличивает реабсорцию натрия и воды в дистальных извитых канальцах и собирательных трубочках (а также в толстой кишке и слюнных и потовых железах) и таким образом вызывает экскрецию ионов калия и водорода. Ангиотензин 2 вместе с внеклеточным уровнем ионов калия — наиболее значимые регуляторы альдостерона, но синтез Ang2 также может быть вызван АКТГ, норадреналином, эндотелином, серотонином, а ингибирован АНП и NO. Также важно отметить, что Ang 2 важный фактор трофики клубочковой зоны надпочечников, которая без его наличия может атрофироваться.
Альдостерон наиболее важный регулятор K+- Na+ баланса и таким образом играет важную роль в контроле объема жидкостей. Он увеличивает реабсорцию натрия и воды в дистальных извитых канальцах и собирательных трубочках (а также в толстой кишке и слюнных и потовых железах) и таким образом вызывает экскрецию ионов калия и водорода. Ангиотензин 2 вместе с внеклеточным уровнем ионов калия — наиболее значимые регуляторы альдостерона, но синтез Ang2 также может быть вызван АКТГ, норадреналином, эндотелином, серотонином, а ингибирован АНП и NO. Также важно отметить, что Ang 2 важный фактор трофики клубочковой зоны надпочечников, которая без его наличия может атрофироваться.
См. также
Ссылки
Шаблон:АТХ код C09
схема, функции и ее роль
Ренин-ангиотензин-альдостероновая система является комплексом ферментов и гормонов, которые поддерживают гомеостаз. Регулирует равновесие соли и воды в организме и уровень артериального давления.
Механизм работы
Физиология ренин-ангиотензин-альдостероновой системы берет начало на границе коркового и мозгового вещества почки, где имеются юкстагломерулярные клетки, вырабатывающие пептидазу (фермент) — ренин.
Ренин является гормоном и начальным звеном РААС.
Ситуации, при которых ренин выделяется в кровь
Существует несколько состояний, при которых идет попадание гормона в кровеносное русло:
- Уменьшение кровотока в ткани почек — при воспалительных процессах (гломерулонефрит др.), при диабетической нефропатии, опухолях почек.
- Снижение объема циркулирующей крови (при кровотечении, многократной рвоте, поносах, ожогах).
- Падение уровня артериального давления. В артериях почек имеются барорецепторы, которые реагируют на изменение системного давления.
- Изменение концентрации ионов натрия. В организме человека имеются скопления клеток, которые отвечают на изменение ионного состава крови стимуляцией выработки ренина. Соль теряется при обильном потоотделении, а также при рвоте.
- Стрессы, психоэмоциональные нагрузки. Юкстагломерулярный аппарат почки иннервируется симпатическими нервами, которые активируются при негативных психологических влияниях.

В крови ренин встречается с белком — ангиотензиногеном, который вырабатывается клетками печени и забирает у него фрагмент. Образуется ангиотензин I, который является источником воздействия для ангиотензинпревращающего фермента (АПФ). В итоге получается ангиотензин II, который служит вторым звеном и является мощным вазоконстриктором артериальной системы (суживает сосуды).
Эффекты ангиотензина II
Цель: повысить артериальное давление.
- Способствует синтезу альдостерона в клубочковой зоне коры надпочечников.
- Воздействует на центр голода и жажды в головном мозге, вызывая «солевой» аппетит. Поведение человека становится мотивированным на поиск воды и соленой пищи.
- Влияет на симпатические нервы, способствуя высвобождению норадреналина, который тоже является вазоконстриктором, но менее слабым по действию.
- Воздействует на сосуды, вызывая их спазм.
- Участвует в развитии хронической сердечной недостаточности: способствует пролиферации, фиброзу сосудов и миокарда.

- Снижает скорость клубочковой фильтрации.
- Тормозит выработку брадикинина.
Альдостерон — третий компонент, который действует на конечные канальцы почек и способствует выделению из организма ионов калия, магния и обратному всасыванию (реабсорбции) натрия, хлора, воды. Благодаря этому возрастает объем циркулирующей жидкости, поднимаются цифры артериального давления, и усиливается почечный кровоток. Рецепторы к альдостерону имеются не только в почках, но и в сердце, сосудах.
Когда организм достигает гомеостаза, начинают вырабатываться вазодилататоры (вещества, расширяющие сосуды) — брадикинин и каллидин. А компоненты РААС разрушаются в печени.
Схема ренин-ангиотензин-альдостероновой системы
Как любая система, РААС может давать сбой. Патофизиология ренин-ангиотензин-альдостероновой системы проявляет при следующих состояниях:
- Поражение коры надпочечников (инфекция, кровоизлияние и травма). Развивается состояние нехватки альдостерона, и организм начинает терять натрий, хлор и воду, что приводит к уменьшению объема циркулирующей жидкости и снижению артериального давления.
 Состояние компенсируют введением солевых растворов и стимуляторов рецепторов к альдостерону.
Состояние компенсируют введением солевых растворов и стимуляторов рецепторов к альдостерону. - Опухоль коры надпочечников приводит к избытку альдостерона, который реализует свои эффекты и повышает давление. Также активизируются процессы деления клеток, возникает гипертрофия и фиброз миокарда, и развивается сердечная недостаточность.
- Патология печени, когда нарушается разрушение альдостерона и происходит его накопление. Патология лечится блокаторами рецепторов к альдостерону.
- Стеноз почечной артерии.
- Воспалительные заболевания почек.
Значение РААС для жизни и медицины
Ренин-ангиотензин-альдостероновая система и ее роль в организме:
- принимает активное участие в поддержании нормального показателя артериального давления;
- обеспечивает равновесие воды и солей в организме;
- поддерживает кислотно-основной баланс крови.
Система может давать сбой. Воздействуя на ее компоненты, можно бороться с гипертонической болезнью. Механизм возникновения почечной гипертензии также тесно связан с РААС.
Механизм возникновения почечной гипертензии также тесно связан с РААС.
Высокоэффективные группы препаратов, которые синтезированы благодаря изучению РААС
- «Прилы». Ингибиторы (блокаторы) АПФ. Ангиотензин I не переходит в ангиотензин II. Нет вазоконстрикции — нет повышения артериального давления. Препараты: Амприлан, Эналаприл, Каптоприл и др. Ингибиторы АПФ значительно улучшают качество жизни больных сахарным диабетом, обеспечивая профилактику почечной недостаточности. Препараты принимают в минимальной дозировке, которая не вызывает снижения давления, а лишь улучшает местный кровоток и клубочковую фильтрацию. Медикаменты незаменимы при почечной недостаточности, хронической болезни сердца и служат одним из средств лечения гипертонической болезни (если нет противопоказаний).
- «Сартаны». Блокаторы рецепторов к ангиотензину II. Сосуды не реагируют на него и не сокращаются. Препараты: Лозартан, Эпросартан и др.
Противоположной ренин-ангиотензин-альдостероновой системе является кининовая. Поэтому блокирование РААС приводит к повышению в крови компонентов кининовой системы (брадикинин и др.), что благоприятно влияет на ткани сердца и стенки сосудов. Миокард не испытывает голодания, потому как брадикинин усиливает местный кровоток, стимулирует выработку естественных вазодилататоров в клетках мозгового вещества почек и микроцитах собирательных трубочек — простагландинов Е и И2. Они нейтрализуют прессорное действие ангиотензина II. Сосуды не спазмированы, что обеспечивает адекватное кровоснабжение органов и тканей организма, кровь не задерживается и снижается формирование атеросклеротических бляшек и тромбов. Кинины благоприятно воздействуют на почки, увеличивают диурез (суточное выделение мочи).
Поэтому блокирование РААС приводит к повышению в крови компонентов кининовой системы (брадикинин и др.), что благоприятно влияет на ткани сердца и стенки сосудов. Миокард не испытывает голодания, потому как брадикинин усиливает местный кровоток, стимулирует выработку естественных вазодилататоров в клетках мозгового вещества почек и микроцитах собирательных трубочек — простагландинов Е и И2. Они нейтрализуют прессорное действие ангиотензина II. Сосуды не спазмированы, что обеспечивает адекватное кровоснабжение органов и тканей организма, кровь не задерживается и снижается формирование атеросклеротических бляшек и тромбов. Кинины благоприятно воздействуют на почки, увеличивают диурез (суточное выделение мочи).
Б. Система ренин-ангиотензин / Биохимия
Ренин [2] — это фермент аспартил-протеиназа (см. Метаболизм стероидных гормонов). Фермент образуется в почках в форме предшественника (проренина), после расщепления последнего образовавшийся ренин секретируется в кровь. В крови субстратом ренина является ангиотензиноген — гликопротеин плазмы крови из фракции α2-глобулина (см. Белки плазмы крови), синтезирующийся в печени. Отщепляющийся декапептид носит название ангиотензин I. При действии пептидилдипептидазы A [3] [«ангиотензинконвертирующего фермента» [АКФ (АСЕ)], присутствующей в мембране кровеносных сосудов, особенно в лёгких, он превращается в ангиотензин II. Этот октапептид является гормоном и одновременно нейромедиатором. Ангиотензин II быстро расщепляется под действием пептидазы (так называемой ангиотензиназы [4]), присутствующей во многих тканях. Полупериод существования (биохимический полупериод) ангиотензина II составляет всего 1 мин.
В крови субстратом ренина является ангиотензиноген — гликопротеин плазмы крови из фракции α2-глобулина (см. Белки плазмы крови), синтезирующийся в печени. Отщепляющийся декапептид носит название ангиотензин I. При действии пептидилдипептидазы A [3] [«ангиотензинконвертирующего фермента» [АКФ (АСЕ)], присутствующей в мембране кровеносных сосудов, особенно в лёгких, он превращается в ангиотензин II. Этот октапептид является гормоном и одновременно нейромедиатором. Ангиотензин II быстро расщепляется под действием пептидазы (так называемой ангиотензиназы [4]), присутствующей во многих тканях. Полупериод существования (биохимический полупериод) ангиотензина II составляет всего 1 мин.Уровень ангиотензина II в крови определяется скоростью секреции ренина из почек. Местом образования ренина являются клетки юкстагломерулярного аппарата, которые секретируют ренин в ответ на уменьшение кровенаполнения приносящей клубочковой альвеолы и повышение концентрации ионов Na+ в дистальном отделе нефрона.
Действие ангиотензина II. Ангиотензин II взаимодействует с мембранными рецепторами почек, головного мозга, гипофиза, коры надпочечников, стенок кровеносных сосудов и сердца. Благодаря выраженному суживающему действию на сосуды он повышает кровяное давление, в почках способствует уменьшению экскреции ионов Na+ и воды. В головном мозге и нервных окончаниях (пластинках аксонов) симпатической нервной системы действие ангиотензина II вызывает повышение тонуса (нейромедиаторное действие). Он активирует центр жажды. В гипофизе он стимулирует секрецию вазопрессина (адиуретина) и кортикотропина [АКТГ (АСТН)]. В коре надпочечников ангиотензин II стимулирует биосинтез и секрецию альдостерона, который в почках способствует уменьшению экскреции натрия и воды. Разнообразное действие ангиотензина II прямо или косвенно ведёт к повышению кровяного давления и уменьшению выведения из организма натрия и воды.
На эту важную систему гормональной регуляции кровяного давления, точнее на некоторые её звенья, можно воздействовать с помощью ингибиторов, например:
— с помощью субстратных аналогов ангиотензиногена ингибировать ренин;
— конкурентно ингибировать фермент АКФ [3] с помощью субстратных аналогов ангиотензина II. Кроме того, АКФ может расщеплять другие сигнальные пептиды крови, например брадикинин;
Кроме того, АКФ может расщеплять другие сигнальные пептиды крови, например брадикинин;
— блокировать рецепторы ангиотензина с помощью антагонистов пептидных гормонов.
Статьи раздела «Эндокринная функция почек»:
— Следущая статья | — Вернуться в раздел
Система ренин-ангиотензин-альдостерон — TeachMePhysiology
Ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система в организме, которая важна для регулирования кровяного давления и баланса жидкости. Система в основном состоит из трех гормонов: ренин , ангиотензин II и альдостерон . В первую очередь она регулируется скоростью почечного кровотока .
В этой статье описывается система, обсуждается, как она регулируется, и выделяются некоторые клинически значимые моменты, связанные с ней.
РААС
Ренин выпуска
Первым этапом РААС является высвобождение фермента ренин . Ренин высвобождается из зернистых клеток почечного юкстагломерулярного аппарата (JGA) в ответ на один из трех факторов:
Ренин высвобождается из зернистых клеток почечного юкстагломерулярного аппарата (JGA) в ответ на один из трех факторов:
- Снижение доставки натрия к дистальному извитому канальцу, обнаруженное клетками macula densa .
- Пониженное перфузионное давление в почке обнаружено барорецепторами в афферентной артериоле.
- Симпатическая стимуляция JGA через β 1 адренорецепторов.
Высвобождение ренина ингибируется предсердным натрийуретическим пептидом (ANP) , который высвобождается растянутыми предсердиями в ответ на повышение кровяного давления.
Рис. 1. Юкстагломерулярный аппарат показан в виде диаграммы, сопровождаемой электронной микрофотографией на месте [/ caption]Производство ангиотензина II
Ангиотензиноген — это белок-предшественник, продуцируемый в печени и расщепляемый ренином с образованием ангиотензина I.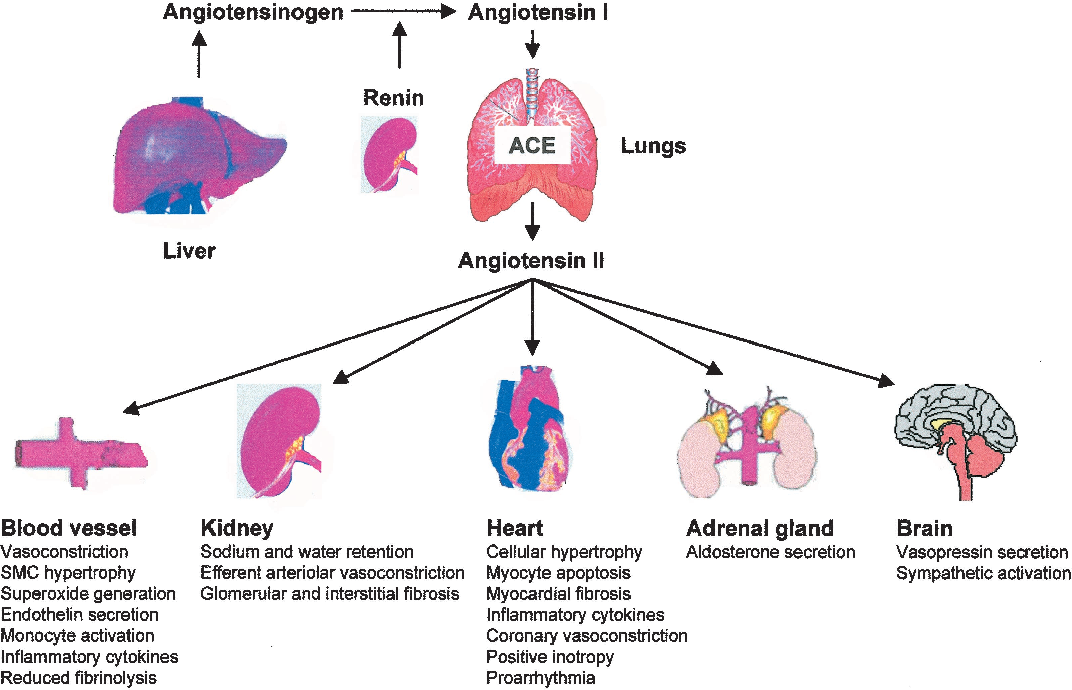
Ангиотензин I затем превращается в ангиотензин II ангиотензинпревращающим ферментом (ACE). Это преобразование происходит в основном в легких , где АПФ продуцируется эндотелиальными клетками сосудов, хотя АПФ также вырабатывается в меньших количествах в почечном эндотелии.
Связывание ангиотензина II
Ангиотензин II проявляет свое действие путем связывания с различными рецепторами по всему телу. Он связывается с одним из двух рецепторов, связанных с G-белком, рецепторами AT1 и AT2.Большинство действий происходит через рецептор AT1.
В таблице ниже показано его влияние в различных точках. Они будут рассмотрены более подробно ниже.
| Участок | Основное действие |
| Артериолы | Сужение сосудов |
| Почки | Стимулирует реабсорбцию Na + |
| Симпатическая нервная система | Повышенное высвобождение норадреналина (NA) |
| Кора надпочечников | Стимулирует высвобождение альдостерона |
| Гипоталамус | Повышает чувство жажды и стимулирует высвобождение антидиуретического гормона (АДГ) |
Действие ангиотензина II
Сердечно-сосудистые эффекты
Ангиотензин 2 действует на рецепторов AT1 , обнаруженных в эндотелии артериол по всему кровотоку, обеспечивая сужение сосудов . Эта передача сигналов происходит через белок Gq , чтобы активировать фосфолипазу C и впоследствии увеличить внутриклеточный кальций.
Эта передача сигналов происходит через белок Gq , чтобы активировать фосфолипазу C и впоследствии увеличить внутриклеточный кальций.
Чистым эффектом этого является увеличение общего периферического сопротивления и, следовательно, артериального давления.
Нейронные эффекты
Ангиотензин II действует на гипоталамус , стимулируя чувство жажды, что приводит к увеличению потребления жидкости. Это помогает повысить циркулирующий объем и, в свою очередь, кровяное давление.Он также увеличивает секрецию АДГ задней долей гипофиза, что приводит к выработке более концентрированной мочи для уменьшения потери жидкости при мочеиспускании. Это позволяет лучше поддерживать циркулирующий объем до тех пор, пока не будет израсходовано больше жидкости.
Дополнительную информацию о ADH можно найти здесь.
Он также стимулирует симпатическую нервную систему к увеличению высвобождения норадреналина (NA) . Этот гормон обычно связан с реакцией «бей или беги» в стрессовых ситуациях и имеет ряд действий, которые имеют отношение к RAAS:
- Увеличение сердечного выброса.
- Сужение сосудов артериол.
- Выпуск ренина.
Почечные эффекты
Ангиотензин II действует на почки, вызывая различные эффекты, включая сужение афферентных и эфферентных артериол и усиление реабсорбции Na + в проксимальном извитом канальце. Эти эффекты и их механизмы кратко описаны в таблице ниже.
| Цель | Действие | Механизм |
| Почечная артерия и афферентная артериола | Сужение сосудов | Управляемые напряжением кальциевые каналы открываются и обеспечивают приток ионов кальция |
| Эфферентная артериола | Сужение сосудов (больше, чем афферентная артериола) | Активация рецептора AT1 |
| Мезангиальные клетки | Сокращение, ведущее к уменьшению площади фильтрации | Активация рецепторов Gq и открытие потенциалозависимых кальциевых каналов |
| Проксимальный извитый канальец | Повышенная реабсорбция Na + | Повышенная активность Na + / H + -антипортера и регулировка сил Старлинга в перитубулярных капиллярах для увеличения парацеллюлярной реабсорбции |
Ангиотензин II также является важным фактором тубулогломерулярной обратной связи, , который помогает поддерживать стабильную скорость клубочковой фильтрации.Местное высвобождение простагландинов, которое приводит к преимущественному расширению сосудов к афферентной артериоле в клубочках, также имеет жизненно важное значение для этого процесса.
Альдостерон
Наконец, ангиотензин II действует на кору надпочечников, стимулируя высвобождение альдостерона. Альдостерон — это минералокортикоид , стероидный гормон, выделяемый клубочковой зоной коры надпочечников.
Альдостерон действует на основных клеток собирательных каналов нефрона.Он увеличивает экспрессию апикальных эпителиальных Na + каналов (ENaC) для реабсорбции натрия с мочой. Кроме того, повышается активность базолатеральной Na + / K + / АТФазы.
Это приводит к тому, что дополнительный реабсорбированный через ENaC натрий перекачивается в кровь натриево-калиевым насосом. В обмен калий перемещается из крови в основную клетку нефрона. Затем этот калий выходит из клетки в почечные канальцы и выводится с мочой.
В результате повысило уровень альдостерона, вызвало снижение уровня калия в крови.
Рис. 2. Схема, описывающая RAAS и его действия в теле. [/ caption][старт-клиника]
Клиническая значимость
Ингибиторы АПФ
Ингибиторы АПФ — это класс препаратов, обычно используемых при лечении гипертонии и сердечной недостаточности. Примеры включают; рамиприл, лизиноприл и эналаприл.
Они подавляют действие ангиотензинпревращающего фермента и, таким образом, снижают уровень ангиотензина II в организме. Это означает, что он снижает активность РААС в организме. Таким образом, физиологические эффекты этих препаратов включают:
- Пониженное сопротивление артериол
- Снижение сужения артериол
- Снижение сердечного выброса
- Снижение выведения калия почками
Эти действия помогают снизить артериальное давление у пациентов с гипертонией, а также помогают улучшить результаты при таких состояниях, как сердечная недостаточность.
Типичные побочные эффекты включают сухой кашель, гиперкалиемию, головную боль, головокружение, утомляемость, почечную недостаточность и, в редких случаях, отек Квинке.
Болезни почекДвумя наиболее важными прогностическими факторами хронической болезни почек являются гипертония и протеинурия . Следовательно, ингибиторы АПФ важны для лечения диабетической нефропатии и других форм хронической почечной недостаточности. Это связано с тем, что они снижают системное артериальное давление и уменьшают экскрецию белка с мочой.
Механизм, с помощью которого они снижают протеинурию, вероятно, связан с ингибированием преимущественной вазоконстрикции, которая возникает в эфферентной артериоле в клубочках, таким образом снижая СКФ и уменьшая экскрецию белка с мочой.
Важно отметить, что ингибиторы АПФ следует применять с осторожностью у пациентов с двусторонним стенозом почечной артерии и часто не следует назначать в случаях острого повреждения почек , поскольку снижение СКФ может быть выраженным и опасным.
[окончание клинической]
Независимая регуляция ренин-ангиотензин-альдостероновой системы в почках
Clin Exp Nephrol. Авторская рукопись; доступно в PMC 1 декабря 2018 г. 1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
Хироюки Кобори
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
Автор, ответственный за переписку.Эта статья распространяется в соответствии с условиями Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что вы укажете соответствующую ссылку. оригинальному автору (ам) и источнику, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Окончательная отредактированная версия этой статьи издателем доступна в Clin Exp Nephrol. См. другие статьи в PMC, в которых цитируется опубликованная статья. .Abstract
Ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регуляции почечной гемодинамики и функций, а также в патофизиологии гипертонии и почечной недостаточности. В почках производство ангиотензина II (Ang II) контролируется несколькими независимыми механизмами. Ang II отделен в почечной интерстициальной жидкости с гораздо более высокими концентрациями, чем те, которые присутствуют в кровотоке. Неправильная активация внутрипочечного РААС вносит важный вклад в патогенез гипертонии и почечного повреждения.Было обнаружено, что внутрипочечные уровни Ang II преимущественно регулируются ангиотензиногеном и, следовательно, ангиотензиноген в моче может быть биомаркером для внутрипочечного образования Ang II. Кроме того, недавние исследования показали, что альдостерон способствует прогрессированию почечного повреждения посредством прямого воздействия на клубочковые подоциты, мезангиальные клетки, клетки проксимальных канальцев и тубулоинтерстициальные фибробласты посредством активации локально экспрессируемых минералокортикоидных рецепторов. Таким образом, теперь выясняется, что внутрипочечный РААС регулируется независимо, и его несоответствующая активация вносит вклад в патогенез развития гипертонии и почечной недостаточности.В этой короткой обзорной статье основное внимание будет уделено независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена.
Ключевые слова: Ренин-ангиотензин-альдостероновая система (РААС), ангиотензин II (Ang II), ангиотензиноген, почки
Введение
Ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система, которая регулирует кровяное давление и баланс жидкости / электролитов [1]. Ангиотензин II (Ang II) связывается с рецептором Ang II типа 1 (AT 1 ) на гладкомышечных клетках сосудов и канальцах, что вызывает сужение сосудов и реабсорбцию натрия соответственно, что приводит к повышению артериального давления [2].Ang II также связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать продукцию альдостерона, что увеличивает реабсорбцию натрия за счет активации рецептора минералокортикоидов (MR) в дистальном отделе нефрона [3].
В настоящее время выясняется, что местная активация внутрипочечного РААС играет важную роль в патогенезе гипертонии и повреждения почечной ткани [4]. Ряд исследований показал, что прогрессирование протеинурии и повреждения почечной ткани связано с активацией внутрипочечного РААС [5–9].Также было показано, что лечение ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов Ang II AT 1 (БРА) значительно снижает протеинурию у пациентов с ХБП, независимо от изменений артериального давления [10]. Ранее мы показали, что активация внутрипочечного РААС предшествовала возникновению микроальбуминурии у крыс с диабетом 2 типа [11]. Кроме того, раннее лечение БРА уменьшало прогрессирование альбуминурии и почечного повреждения [6, 12]. Эти данные предполагают специфический вклад внутрипочечной активации РААС в патофизиологию протеинурии и почечного повреждения.
Во время лечения БРА накопление Ang II теоретически может конкурировать с БРА в сайте связывания рецептора. С другой стороны, увеличение Ang II во время лечения ARB позволяет стимулировать рецептор AT 2 [4]. Активация рецептора AT 2 связана с повышенным высвобождением оксида азота, гуанилатциклазы и тканевого брадикинина [13]. В отличие от рецептора AT 1 , рецептор AT 2 обладает свойствами, препятствующими росту, и стимулирует запрограммированную гибель клеток.Таким образом, рецептор AT 2 , по-видимому, уравновешивает эффекты рецептора AT 1 [14].
В этом обзоре мы кратко суммируем наше текущее понимание независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена. Механизмы, ответственные за повреждение почек, вызванное альдостероном, были рассмотрены ранее [1, 15, 16] и не будут подробно обсуждаться в этом обзоре.
Регуляция циркулирующих классических путей РААС ()
Краткая схема регуляции циркулирующей ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II, JG клетка юкстагломерулярная клетка, MR минералокортикоидный рецептор
Перед обсуждением регуляции внутрипочечного RAAS в плазме классической регуляцией будет RAAS. обсуждается [1, 4]. Ангиотензиноген — единственный известный субстрат для ренина, который является ферментом, ограничивающим скорость РААС. Ангиотензиноген в основном образуется клетками печени и постоянно секретируется в кровоток [17, 18], тогда как ренин высвобождается в основном из юкстагломерулярных клеток почек [4, 19] и расщепляет ангиотензиноген на N-конце с образованием ангиотензина I (Ang I ) [20].В плазме уровни ангиотензиногена намного выше, чем концентрации Ang I и Ang II более чем в 1000 раз [7]. Поскольку уровни ангиотензиногена в плазме близки к константе Михаэлиса-Ментен для ренина, уровни ангиотензиногена могут контролировать уровни Ang I в плазме [17, 21]. Действительно, было показано, что повышение уровня ангиотензиногена приводит к повышению уровня Ang II в плазме [22, 23]. Однако изменения в синтезе ангиотензиногена происходят медленно и, таким образом, менее ответственны за динамическую регуляцию плазменного Ang I [17, 24].Поэтому было высказано предположение, что изменения в активности ренина плазмы (PRA) играют доминирующую роль в определении скорости образования Ang I из огромных запасов циркулирующего ангиотензиногена в плазме [1, 25]. показаны типичные концентрации ангиотензиногена в плазме, измеренные у анестезированных крыс и выраженные в наномолях на литр, тогда как концентрации Ang I и Ang II выражены в пикомолях на литр. Как показано на фиг.1, концентрации Ang I и Ang II в плазме, по-видимому, представляют собой небольшие доли доступного ангиотензиногена, что подтверждает идею о том, что ренин является критическим фактором для определения генерации Ang II в плазме [1, 18, 25] .Ang I в плазме легко превращается в Ang II не только благодаря циркулирующему растворимому типу АПФ, но также благодаря широко распространенному присутствию АПФ на эндотелиальных клетках многих сосудистых русел, включая легкие [2, 18]. Хотя были идентифицированы другие пути образования Ang II из Ang I [26], циркулирующие уровни Ang II отражают в первую очередь последствия ферментативного каскада ренина и АПФ на ангиотензиноген и Ang I [27, 28]. Циркулирующий Ang II связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать выработку альдостерона, что увеличивает реабсорбцию натрия за счет активации MR в дистальном отделе нефрона [3].
Регуляция локальных путей РААС в почках ()
Краткая схема регуляции внутрипочечной ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II
В почках продукция Ang II контролируется независимыми множественными механизмами [4]. Все компоненты, необходимые для генерации внутрипочечного Ang II, присутствуют вдоль нефрона [2, 7]. Концентрации Ang II в тканях почек намного выше, чем можно объяснить концентрациями, доставляемыми артериальным кровотоком [4, 29].Плазма-ангиотензиноген может не проникать через клубочковую мембрану из-за своего молекулярного размера, но почки также экспрессируют ангиотензиноген [5, 30]. Однако уровни ангиотензиногена в тканях почек намного ниже, чем в плазме [4]. С другой стороны, ренин секретируется клетками юкстагломерулярного аппарата и доставляется в почечный интерстиций, который обеспечивает путь локальной генерации Ang I в почках [19]. В частности, исследования показали, что активность ренина в почечной ткани более чем в 1000 раз выше, чем PRA (пикомолярные уровни Ang I / мл плазмы / час по сравнению снаномолярные уровни Ang I / г ткани / ч) [31]. Таким образом, большое количество ренина может легко расщеплять ангиотензиноген с образованием Ang I. Кроме того, Ang I также может легко превращаться в Ang II в почках [32, 33], потому что ACE обильно экспрессируется в проксимальных и дистальных канальцах, собирательных протоках и др. и почечные эндотелиальные клетки [34]. В совокупности, в отличие от роли ренина в плазме, ангиотензиноген является критическим фактором, регулирующим продукцию Ang II в почках. С другой стороны, подробный механизм, ответственный за индуцированную Ang II продукцию альдостерона в почках, до сих пор не выяснен ().
Исследования показали компартментализацию и независимую регуляцию почечной интерстициальной и канальцевой жидкости Ang II. Концентрации Ang II в почечной интерстициальной жидкости намного выше, чем уровни в плазме [35]. Nishiyama et al. [36] показали, что почечная интерстициальная инфузия ингибиторов АПФ значительно снижает уровни Ang II в почечной интерстициальной жидкости. Эти данные указывают на то, что Ang II генерируется в почечном интерстициальном пространстве. Также было показано, что концентрация Ang II в жидкости проксимальных канальцев в 100–200 раз выше, чем в плазме [37, 38].Эти результаты предполагают, что Ang II также синтезируется в просвете проксимального канальца, по крайней мере частично [39, 40].
Помимо внутрипочечной генерации Ang II, циркулирующий Ang II интернализуется в почках через рецептор AT 1 [41]. Ли и др. [42] показали, что внутрипочечный перенос / накопление Ang II в эндосомах кортикальных канальцев почек усиливается во время развития Ang II-индуцированной гипертензии. Важно отметить, что лечение БРА блокирует интернализацию Ang II в почках.
Специфическая роль ангиотензиногена в регуляции продукции Ang II в почках
В почках мРНК и белок ангиотензиногена в основном локализованы в клетках проксимальных канальцев [43, 44]. Ангиотензиноген, продуцируемый в клетках проксимальных канальцев, по-видимому, секретируется непосредственно в просвет канальцев и почечный интерстиций в дополнение к производству своих метаболитов внутриклеточно [45]. Сообщается, что концентрация ангиотензиногена в проксимальных канальцах у анестезированных крыс находится в диапазоне 300-600 нмоль / л, что значительно превышает уровни Ang I и Ang II в канальцевой жидкости [7].Трансгенные мыши, которые системно экспрессируют человеческий ренин и человеческий ангиотензиноген только в почках, показали повышенные внутрипочечные уровни Ang II, в то время как уровни Ang II в плазме не изменились. Интересно, что у этих мышей также была увеличена экспрессия эндогенного ангиотензиногена мыши [23]. Таким образом, селективная стимуляция внутрипочечной продукции Ang II из человеческого ангиотензиногена дополнительно стимулирует экспрессию эндогенного внутрипочечного ангиотензиногена мыши. Сходным образом внутрипочечная экспрессия ангиотензиногена увеличивается у крыс с гипертензией, которым вводили Ang II [46, 47].Хронические инфузии Ang II также значительно увеличивали скорость экскреции ангиотензиногена с мочой в зависимости от времени и дозы, что было связано с повышением систолического артериального давления и уровней Ang II в почках, но не с концентрациями Ang II в плазме [30]. Кроме того, лечение БРА предотвращало индуцированное Ang II увеличение экспрессии ангиотензиногена в почках и ангиотензиногена мочи [30]. Эти данные предполагают, что продукция ангиотензиногена в почках положительно стимулируется локальным Ang II через активацию рецептора AT 1 .Дальнейшие исследования показали, что высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена в клетках проксимальных канальцев человека [48, 49]. Кроме того, в почечных тканях крыс с диабетом 2 типа [6, 11, 44, 50] и пациентов [51] экспрессия генов ангиотензиногена была значительно увеличена в почках. Таким образом, можно предположить, что во время развития диабета высокий уровень глюкозы первоначально увеличивает внутрипочечные уровни ангиотензиногена, что приводит к образованию Ang II в почках. Затем несоответствующее производство Ang II может дополнительно стимулировать локальную экспрессию ангиотензиногена и связанное с ним образование Ang II в почках.Предполагается, что такой порочный круг внутрипочечной активации РААС является критическим фактором прогрессирования диабетической нефропатии [52, 53]. Исследования также показали, что лечение БРА значительно снижает как экспрессию ангиотензиногена, так и уровни Ang II в почках [6, 10, 12, 54, 55]. Таким образом, фармакологические ренопротекторные эффекты БРА можно частично объяснить ингибированием продукции внутрипочечного ангиотензиногена и Ang II. Хотя почечный ангиотензиноген преимущественно локализуется в проксимальных канальцах [44, 46, 47], слабая экспрессия также обнаруживается в клубочках.Поскольку гломерулярный ангиотензиноген повышен в поврежденных клубочках [56–58], локальная активация RAAS в клубочках может играть роль в патофизиологии повреждения клубочков. Недавно Eriguchi et al. [56] показали, что ангиотензиноген вырабатывается в поврежденных подоцитах клубочков у нефротических крыс, индуцированных пуромицином. Эти данные предполагают потенциальный вклад генерации ангиотензиногена подоцитами в прогрессирование протеинурии.
Помимо двух факторов, Ang II и высокого уровня глюкозы, другие факторы, такие как митоген-активированные протеинкиназы (MAPK), активные формы кислорода (ROS) и ядерный фактор, усиливающий легкую каппа-цепь активированных B-клеток (NFkB ), как сообщалось, также активируют экспрессию ангиотензиногена.Zhang et al. [59] показали, что экспрессия гена ангиотензиногена стимулируется через путь киназы p38 в иммортализованных клетках проксимальных канальцев почки крысы. Hsieh et al. [60] обнаружили, что экспрессия гена ангиотензиногена активируется через ROS в клеточной линии проксимальных канальцев. Кроме того, Kobori и Nishiyama [61] представили доказательства in vivo, что АФК стимулируют экспрессию гена ангиотензиногена в почках чувствительных к соли крыс Даля, которым вводят диету с высоким содержанием соли. Наконец, экспрессия гена ангиотензиногена активируется фактором транскрипции NFkB p65 в гепатоцитах [62].Также было высказано предположение о возможной связи между активацией MAPK и путями NFkB [63, 64].
Ангиотензиноген мочи как биомаркер внутрипочечного РААС и повреждения почек
Как упоминалось ранее, ангиотензиноген плазмы не может легко проникать через клубочковую мембрану из-за своего молекулярного размера. Ding et al. [65] получили мышей со сверхэкспрессией человеческого ангиотензиногена, специфичной для почек, и обнаружили большое количество человеческого ангиотензиногена в моче, но лишь незначительные следы в системном кровотоке.Kobori et al. [30] крысам внутривенно вводили человеческий ангиотензиноген; однако циркулирующий ангиотензиноген человека в моче не обнаруживался. Дальнейшие исследования с помощью двухфотонной микроскопии визуализировали гломерулярную динамику in vivo и показали, что клубочковая фильтрация циркулирующего ангиотензиногена человека намного меньше по сравнению с альбумином у мышей, что свидетельствует об ограниченной проницаемости клубочков [66].
Поскольку ангиотензиноген является белком, можно подумать, что у субъектов с протеинурией повышенная экскреция ангиотензиногена с мочой является неспецифическим следствием повышенной экскреции белков плазмы с мочой [67, 68].Однако уровень ангиотензиногена в моче не увеличивался, хотя уровень белка в моче повышен у крыс, получавших дезоксикортикостерон ацетат, что является моделью RAAS-независимой гипертензии [30]. Кроме того, соотношение ангиотензиноген / креатинин в моче у пациентов с незначительной патологией клубочков (8,3 ± 3,7 мкг / г Cr) было таким же, как и у здоровых субъектов (10,8 ± 3,4 мкг / г Cr), даже несмотря на то, что у этих пациентов наблюдалась тяжелая протеинурия [9 ]. У пациентов с преальбуминурией и диабетом 1 типа уровни ангиотензиногена в моче были уже выше, чем у контрольных субъектов [69].Zhuang et al. [70] показали, что повышенный уровень ангиотензиногена в моче предшествует развитию альбуминурии у пациентов с диабетом 2 типа. Точно так же ангиотензиноген с мочой и экскреция натрия значительно увеличиваются у детей с нормальным альбуминурием и диабетом [71]. Эти данные предполагают, что повышенный уровень ангиотензиногена в моче у пациентов с протеинурией нельзя просто объяснить неспецифическими последствиями протеинурии.
Однако циркулирующий ангиотензиноген может фильтроваться через клубочковую мембрану при некоторых патофизиологических условиях.Действительно, несколько клинических исследований показали, что уровни ангиотензиногена в моче достоверно коррелируют с альбуминурией у пациентов с артериальной гипертензией [72] и ХБП [67, 73, 74]. Matsusaka et al. [75, 76] показали, что у мышей с тяжелым повреждением подоцитов и потерей макромолекулярной барьерной функции стенки клубочковых капилляров внутрипочечная генерация Ang II увеличивается за счет фильтрованного ангиотензиногена, происходящего из печени. Eriguchi et al. [56] показали, что во время прогрессирования повреждения подоцитов отфильтрованный ангиотензиноген обильно реабсорбируется проксимальными канальцами, что приводит к снижению генерации ангиотензиногена в проксимальных канальцах.Также было высказано предположение, что клубочковые подоциты являются важным источником ангиотензиногена мочи при этом патологическом состоянии [9]. Эти данные предполагают, что фильтрованный циркулирующий ангиотензиноген также может быть источником и / или триггером генерации внутрипочечного Ang II у субъектов с тяжелым повреждением барьера клубочковой фильтрации, что может играть важную роль в активации внутрипочечного RAAS во время прогрессирования ХБП.
Растущее количество доказательств показывает, что ангиотензиноген в моче является специфическим биомаркером состояния внутрипочечного РААС, гипертонии и почечной недостаточности.Kobori et al. [30, 77] провели эксперименты на животных и показали, что повышение уровня ангиотензиногена в моче связано с увеличением экспрессии почечного ангиотензиногена и уровня Ang II в почках. У пациентов с незначительной патологией клубочков и IgA-нефропатией соотношение ангиотензиноген / креатинин в моче сильно коррелирует с экспрессией гена ангиотензиногена в тканях почечной биопсии [9]. Эти данные показали, что ангиотензиноген мочи является полезным маркером для прогнозирования уровней ангиотензиногена в почках этих пациентов.Сэндвич-твердофазный иммуноферментный анализ (ELISA) на человеческий ангиотензиноген был разработан Katsurada et al. [78], и теперь он коммерчески доступен, что позволило легко измерить большое количество образцов с течением времени. Также было показано, что обычные условия хранения не влияют на измеренные значения ангиотензиногена мочи [79]. Кроме того, экскреция ангиотензиногена с мочой не имеет циркадного ритма [80]. Таким образом, исследования ангиотензиногена в моче получили широкое распространение в мире, и растущее количество клинических данных указывает на то, что повышенные уровни ангиотензиногена в моче коррелируют с клиническими параметрами у пациентов с артериальной гипертензией [71, 72, 81] и ХБП [55, 73, 82–84].
Kobori et al. [81] показали, что ангиотензиноген в моче значительно коррелировал с артериальным давлением у пациентов с артериальной гипертензией, которые не получали антигипертензивные препараты. Они также обнаружили, что эта корреляция была высокой у чернокожих мужчин, что позволяет предположить возможный вклад ангиотензиногена мочи в солевую гипертензию. Интересно, что Kobori et al. [85] также показали, что как экспрессия ангиотензиногена в тканях почек, так и ангиотензиноген в моче заметно увеличивались у крыс с гипертензией, чувствительных к соли Даля.Кониши и др. [55] показали, что натрий-чувствительный индекс артериального давления сильно коррелирует с ангиотензиногеном мочи у пациентов с нефропатией IgA, у которых наблюдается натрий-зависимое повышение артериального давления. Аналогичным образом Zou et al. [86] показали, что экскреция ангиотензиногена с мочой выше при большей экскреции натрия с мочой и связана как с клиническим, так и с амбулаторным артериальным давлением. Дальнейшие исследования показали, что повышение уровня ангиотензиногена в моче значительно коррелирует с уровнем натрия в моче и предшествует гипертензии у детей с нормальным альбуминурием и диабетом 1 типа [71].Эти данные позволяют предположить, что ангиотензиноген мочи является полезным биомаркером для выявления натрийзависимой гипертензии. Савагути и др. [84] показали, что ангиотензиноген в моче сильно коррелировал с частотой сердечно-сосудистых осложнений у пациентов с диабетической нефропатией 2 типа. Недавние исследования также показали, что ангиотензиноген в моче значительно коррелирует с индексом массы левого желудочка и толщиной интима-медиа у пациентов с гипертонической болезнью, перенесших трансплантацию почки [87]. Мы также показали, что уровни ангиотензиногена в моче и внутрипочечного ангиотензиногена значительно увеличиваются у крыс с аортальной регургитацией [88], что указывает на потенциальную роль внутрипочечного ангиотензиногена в патофизиологии кардио-почечного синдрома.
Несколько клинических исследований показали, что ангиотензиноген в моче значительно повышен у пациентов с ХБП, включая IgA-нефропатию [55], диабетическую нефропатию [84, 87, 89], поликистоз почек [90, 91], фокальный сегментарный гломерулосклероз [56]. У этих пациентов с ХБП уровень ангиотензиногена в моче положительно коррелирует с уровнем белка или альбумина в моче, тогда как он отрицательно коррелирует с расчетной скоростью клубочковой фильтрации. Недавние исследования также показали, что ангиотензиноген мочи является прогностическим биомаркером острого повреждения почек [92, 93] и рубцевания почек [94].Однако важно отметить, что антитела, используемые в коммерчески доступных наборах для анализа ангиотензиногена ELISA, распознают как интактный ангиотензиноген, так и ангиотензиноген des-Ang I [78]. Схематически ангиотензиноген можно рассматривать как состоящий из комбинации функции Ang I, расположенной на N-конце, и присутствия структуры серпина (ингибитора сериновой протеазы) на противоположном конце. Таким образом, необходимы дальнейшие исследования с использованием нового набора ELISA для интактного ангиотензиногена.Кобори и Нишияма недавно предположили, что соотношение между ангиотензиногеном des-Ang I и интактным ангиотензиногеном может быть стабильным маркером активности ренина (был зарегистрирован патент PCT / JP2014 / 078751). Поскольку уровни ангиотензиногена в плазме очень высоки, мы предполагаем, что острые изменения в активации ренина могут не отражать соотношение ангиотензиноген des-Ang I / интактный ангиотензиноген в плазме. Чтобы проверить эту идею, мы электрически стимулировали почечный симпатический нерв с частотой 1 Гц (5 В, 1 мс) в течение 20 минут у анестезированных крыс и собрали образцы плазмы и мочи.Все экспериментальные процедуры проводились в соответствии с руководящими принципами по уходу и использованию животных, установленными Университетом Кагава (Кагава, Япония). Наши предварительные данные показали, что активация почечного симпатического нерва значительно увеличила PRA, но не изменила соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в плазме (). Интересно, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче вскоре увеличивалось при стимуляции почечного симпатического нерва. Эти данные позволяют предположить, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче является потенциальным биомаркером активности ренина в почках.
Влияние электрической стимуляции почечного симпатического нерва с частотой 1 Гц (5 В, 1 мс) в течение 20 минут на PRA, соотношение Des-Ang I-AGT / интактный AGT в плазме и соотношение Des-Ang I-AGT / интактный AGT в моче у анестезированных крыс ( n = 12–15). PRA активность ренина плазмы, AGT ангиотензиноген, Ang I ангиотензин I. * P <0,05 по сравнению с контролем
Ангиотензиноген Des-Ang I, составляющий более 97% молекулы, по-видимому, не имеет функция.Недавно было показано, что некоторые серпины (антитромбин, маспин, фактор пигментного эпителия и каллистатин) обладают антиангиогенной активностью, что свидетельствует об общем механизме пролиферации и миграции эндотелиальных клеток. Ангиотензиноген и его продукт расщепления ренин, ангиотензиноген des-Ang I, также являются ингибиторами ангиогенеза как in vitro, так и in vivo в концентрациях в диапазоне концентраций, наблюдаемых в плазме. Это свойство, скорее всего, является следствием структурной аналогии ангиотензиногена с серпинами.Патологическое значение этой новой функции все еще не известно, но ангиотензиноген, продуцируемый глиальными клетками, может играть роль в стабилизации гематоэнцефалического барьера. Эти новые данные следует рассматривать в свете общего действия ренин-ангиотензиновой системы на ангиогенез [95].
Выводы
Внутрипочечный RAAS независимо регулируется, и его несоответствующая активация вносит свой вклад в патогенез развития гипертонии и почечной недостаточности. В этом кратком обзоре обсуждалась особая роль ангиотензиногена в регуляции внутрипочечной активности РААС.Локально экспрессируемый ангиотензиноген является основным фактором контроля внутрипочечных уровней Ang II, но фильтрованный циркулирующий ангиотензиноген также может быть источником образования внутрипочечного Ang II, если барьер клубочковой фильтрации серьезно поврежден. В любом случае ангиотензиноген мочи является полезным биомаркером для определения статуса внутрипочечного РААС, гипертензии и почечной недостаточности.
Благодарности
Финансирование Это исследование было частично поддержано Японским обществом содействия науке (JSPS) по грантам на научные исследования (KAKENHI) (26460343 Акире Нишияме и 15K08237 Хироюки Кобори).
Сноски
Соблюдение этических стандартов
Конфликт интересов Авторы заявили, что конфликта интересов не существует.
Этическое разрешение Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам учреждения или практики, в которой проводились исследования (номер одобрения Университета Кагава: # 15,031).
Ссылки
1. Нишияма А., Ким-Мицуяма С.Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: Обзор регуляции системы ренин-ангиотензин-альдостерон. J Pharmacol Sci. 2010. 113: 289–91. Проблема. [PubMed] [Google Scholar] 2. Navar LG, Inscho EW, Majid SA, Imig JD, Harrison-Bernard LM, Mitchell KD. Паракринная регуляция почечной микроциркуляции. Physiol Rev.1996; 76: 425–536. DOI: 10.1152 / Physrev.1996.76.2.425. Проблема. [PubMed] [CrossRef] [Google Scholar] 3. Нишияма А., Хитоми Х., Рахман А., Киемото Х. Открытие лекарств для преодоления хронической болезни почек (ХБП): Фармакологические эффекты блокаторов минералокортикоидных рецепторов.J Pharmacol Sci. 2009; 109: 1–6. Проблема. [PubMed] [Google Scholar] 4. Кобори Х., Нангаку М., Навар Л.Г., Нишияма А. Внутрипочечная ренин-ангиотензиновая система: от физиологии к патобиологии гипертонии и болезней почек. Pharmacol Rev.2007; 59: 251–87. DOI: 10.1124 / pr.59.3.3. Проблема. [PubMed] [CrossRef] [Google Scholar] 5. Кобори Х., Одзава Й., Сузаки Й., Прието-Карраскеро М.С., Нишияма А., Сёдзи Т. и др. Лекция молодых ученых: «Внутритрубчатый ангиотензиноген при гипертонии и заболеваниях почек»Am J Hypertens. 2006; 19: 541–50. DOI: 10.1016 / j.amjhyper.2005.11.014. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Нагаи Ю., Яо Л., Кобори Х., Мията К., Одзава Ю., Миятаке А. и др. Временная блокада ангиотензина II на преддиабетической стадии ослабляет развитие повреждения почек у крыс с диабетом 2 типа. J Am Soc Nephrol. 2005; 16: 703–11. DOI: 10.1681 / ASN.2004080649. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Навар Л.Г., Нишияма А. Внутрипочечное образование ангиотензина II.Contrib Nephrol. 2001; (135): 1–15. [PubMed] [Google Scholar] 8. Нишияма А., Кобори Х., Фукуи Т., Чжан Г.Х., Яо Л., Рахман М. и др. Роль ангиотензина II и активных форм кислорода в циклоспорин А-зависимой гипертензии. Гипертония. 2003. 42: 754–60. DOI: 10.1161 / 01.HYP.0000085195.38870.44. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Нишияма А., Кониси Ю., Охаши Н., Морикава Т., Урушихара М., Маеда И. и др. Ангиотензиноген мочи отражает активность внутрипочечной ренин-ангиотензиновой системы у пациентов с нефропатией iga.Nephrol Dial Transpl. 2011; 26: 170–7. DOI: 10.1093 / ndt / gfq371. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Fan YY, Kobori H, Nakano D, Hitomi H, Mori H, Masaki T и др. Аберрантная активация внутрипочечной ренин-ангиотензиновой системы в развивающихся почках крыс с диабетом 2 типа. Horm Metab Res. 2013; 45: 338–43. DOI: 10,1055 / с-0032-1331256. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Нишияма А., Накагава Т., Кобори Х., Нагаи Ю., Окада Н., Кониси И. и др.Строгая блокада ангиотензина предотвращает увеличение внутрипочечного ангиотензина II и аномалии подоцитов у крыс с диабетом 2 типа с микроальбуминурией. J Hypertens. 2008; 26: 1849–59. DOI: 10.1097 / HJH.0b013e3283060efa. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13. Сираджи Х.М., Кэри РМ. Защитная роль рецептора ангиотензина AT2 в модели почечной гипертензии. Гипертония. 1999; 33: 1237–42. Проблема. [PubMed] [Google Scholar] 14. Навар Л.Г., Митчелл К.Д., Харрисон-Бернард Л.М., Кобори Х., Нишияма А.Рассмотрение. Уровни внутрипочечного ангиотензина II в норме и при гипертонии. J Renin Angiotensin Aldosterone Syst. 2001; 2: S176 – S84. DOI: 10.1177 / 14703203010020013001. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Нишияма А., Хасегава К., Диах С., Хитоми Х. Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: блокаторы минералокортикоидных рецепторов оказывают антигипертензивное и ренопротекторное действие независимо от системы ренин-ангиотензин. J Pharmacol Sci. 2010; 113: 310–4.Проблема. [PubMed] [Google Scholar] 16. Рафик К., Хитоми Х, Накано Д., Нишияма А. Патофизиологические роли альдостерона и рецептора минералокортикоидов в почках. J Pharmacol Sci. 2011; 115: 1–7. Проблема. [PubMed] [Google Scholar] 17. Brasier AR, Li J. Механизмы индуцируемого контроля транскрипции гена ангиотензиногена. Гипертония. 1996; 27: 465–75. Проблема. [PubMed] [Google Scholar] 18. Пол М., Поян Мехр А., Кройц Р. Физиология местных ренин-ангиотензиновых систем. Physiol Rev.2006; 86: 747–803. DOI: 10.1152 / Physrev.00036.2005. Проблема. [PubMed] [CrossRef] [Google Scholar] 19. Hackenthal E, Paul M, Ganten D, Taugner R. Морфология, физиология и молекулярная биология секреции ренина. Physiol Rev.1990; 70: 1067–116. DOI: 10.1152 / Physrev.1990.70.4.1067. Проблема. [PubMed] [CrossRef] [Google Scholar] 20. Бейлис К., Энгельс К., Химел А., Навар Л.Г. Активность ренина в плазме и скорость метаболического клиренса ангиотензина II у стареющих крыс без стресса. Mech Aging Dev. 1997. 97: 163–72. Проблема. [PubMed] [Google Scholar] 21.Гулд А.Б., Грин Д. Кинетика реакции человеческого ренина и человеческого субстрата. Cardiovasc Res. 1971; 5: 86–9. Проблема. [PubMed] [Google Scholar] 22. Kim HS, Krege JH, Kluckman KD, Hagaman JR, Hodgin JB, Best CF, et al. Генетический контроль артериального давления и локуса ангиотензиногена. Proc Natl Acad Sci USA. 1995; 92: 2735–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Кобори Х., Одзава Ю., Сато Р., Кацурада А., Мията К., Охаши Н. и др. Почечно-специфическое усиление ang II стимулирует эндогенный внутрипочечный ангиотензиноген у мышей, нацеленных на ген.Am J Physiol Renal Physiol. 2007; 293: F938–45. DOI: 10.1152 / ajprenal.00146.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Deschepper CF. Ангиотензиноген. Гормональная регуляция и относительное значение в генерации ангиотензина II. Kidney Int. 1994; 46: 1561–3. Проблема. [PubMed] [Google Scholar] 26. Девараджан С., Яхиро Э., Уехара Й., Хабе С., Нишияма А., Миура С. и др. Депрессорный эффект ингибитора химазы у мышей с умеренной гипертензией, вызванной высоким содержанием соли. Am J Physiol Heart Circ Physiol.2015; 309: h2987–96. DOI: 10.1152 / ajpheart.00721.2014. Проблема. [PubMed] [CrossRef] [Google Scholar] 27. Erdos EG. Фермент, преобразующий ангиотензин I, и изменения в наших представлениях с годами. Льюис К. Мемориальная лекция Даля. Гипертония. 1990; 16: 363–70. Проблема. [PubMed] [Google Scholar] 28. Джонстон CI. Тканевый ангиотензин-превращающий фермент при сердечной и сосудистой гипертрофии, восстановлении и ремоделировании. Гипертония. 1994; 23: 258–68. Проблема. [PubMed] [Google Scholar] 29. Ингерт С, Грима М, Кокард С, Бартелмебс М, Имбс Дж.Вклад интернализации ангиотензина II в уровни внутрипочечного ангиотензина II у крыс. Am J Physiol Renal Physiol. 2002; 283: F1003–10. DOI: 10.1152 / ajprenal.00322.2001. Проблема. [PubMed] [CrossRef] [Google Scholar] 30. Кобори Х., Нишияма А., Харрисон-Бернард Л. М., Навар Л. Г.. Ангиотензиноген в моче как индикатор внутрипочечного ангиотензинового статуса при артериальной гипертензии. Гипертония. 2003; 41: 42–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Кэмпбелл Д. Д., Лоуренс А. С., Таури А., Кладис А., Валентийн А. Дж..Дифференциальная регуляция уровней пептида ангиотензина в плазме и почках крысы. Гипертония. 1991; 18: 763–73. Проблема. [PubMed] [Google Scholar] 32. Komlosi P, Fuson AL, Fintha A, Peti-Peterdi J, Rosivall L, Warnock DG, et al. Превращение ангиотензина I в ангиотензин II стимулирует транспорт натрия в собирательных протоках коры головного мозга. Гипертония. 2003; 42: 195–9. DOI: 10.1161 / 01.HYP.0000081221.36703.01. Проблема. [PubMed] [CrossRef] [Google Scholar] 33. Rosivall L, Navar LG. Влияние на почечную гемодинамику внутриартериальных инфузий ангиотензинов I и II.Am J Physiol. 1983; 245: F181–7. DOI: 10.1152 / ajprenal.1983.245.2.F181. Проблема. [PubMed] [CrossRef] [Google Scholar] 34. Casarini DE, Boim MA, Stella RC, Krieger-Azzolini MH, Krieger JE, Schor N. Активность ангиотензин-превращающего фермента в канальцевой жидкости вдоль нефрона крысы. Am J Physiol. 1997; 272: F405–9. DOI: 10.1152 / ajprenal.1997.272.3.F405. Проблема. [PubMed] [CrossRef] [Google Scholar] 35. Нишияма А., Сет Д.М., Навар Л.Г. Концентрация ангиотензинов I и II в почечной интерстициальной жидкости у анестезированных крыс.Гипертония. 2002; 39: 129–34. Проблема. [PubMed] [Google Scholar] 36. Нишияма А., Сет Д.М., Навар Л.Г. Концентрации ангиотензина I и ангиотензина II в интерстициальной жидкости почек во время местного ингибирования ангиотензинпревращающего фермента. J Am Soc Nephrol. 2002; 13: 2207–12. Проблема. [PubMed] [Google Scholar] 37. Браам Б., Митчелл К.Д., Фокс Дж., Навар Л.Г. Проксимальная канальцевая секреция ангиотензина II у крыс. Am J Physiol. 1993; 264: F891–8. DOI: 10.1152 / ajprenal.1993.264.5.F891. Проблема. [PubMed] [CrossRef] [Google Scholar] 38.Seikaly MG, Arant BS, Jr, Seney FD., Jr. Концентрации эндогенного ангиотензина в определенных компартментах внутрипочечной жидкости крысы. J Clin Invest. 1990; 86: 1352–7. DOI: 10,1172 / JCI114846. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Хираньячаттада С., Харрис П.Дж. Модуляция локально продуцируемого люминального ангиотензина II реабсорбции натрия в проксимальных канальцах через рецептор AT1. Br J Pharmacol. 1996. 119: 617–8. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Куан А, Баум М.Эндогенная продукция ангиотензина II модулирует транспорт проксимальных канальцев крысы. J Clin Invest. 1996; 97: 2878–82. DOI: 10,1172 / JCI118745. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Гонсалес-Вильялобос Р.А., Сет Д.М., Сато Р., Хортон Х., Охаши Н., Мията К. и др. Интраренальное увеличение ангиотензина II и ангиотензиногена у мышей, которым вводили хронический ангиотензин II. Am J Physiol Renal Physiol. 2008; 295: F772–9. DOI: 10.1152 / ajprenal.00019.2008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42.Ли XC, Карретеро О.А., Navar LG, Zhuo JL. Опосредованное рецептором AT1 накопление внеклеточного ангиотензина II в клетках проксимальных канальцев: роль микротрубочек цитоскелета и тирозинфосфатаз. Am J Physiol Renal Physiol. 2006; 291: F375–83. DOI: 10.1152 / ajprenal.00405.2005. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Дарби И.А., Серния С. Гибридизация in situ и иммуногистохимия почечного ангиотензиногена в почках новорожденных и взрослых крыс. Cell Tissue Res. 1995; 281: 197–206.Проблема. [PubMed] [Google Scholar] 44. Камияма М., Гарнер М.К., Фаррагут К.М., Софуэ Т., Хара Т., Морикава Т. и др. Детальная локализация увеличенной мРНК ангиотензиногена и белка в проксимальных сегментах канальцев диабетических почек у крыс и людей. Int J Biol Sci. 2014; 10: 530–42. DOI: 10.7150 / ijbs.8450. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Lantelme P, Rohrwasser A, Gociman B, Hillas E, Cheng T, Petty G, et al. Влияние диетического натрия и генетического фона на ангиотензиноген и ренин у мышей.Гипертония. 2002; 39: 1007–14. Проблема. [PubMed] [Google Scholar] 46. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Повышение экспрессии ангиотензиногена при ангиотензин II-зависимой гипертензии. Гипертония. 2001; 37: 1329–35. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экспрессия мРНК ангиотензиногена и белка при ангиотензин II-зависимой гипертензии. J Am Soc Nephrol. 2001; 12: 431–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ван Дж., Шибаяма Й., Кобори Х., Лю Й., Кобара Х., Масаки Т. и др.Высокий уровень глюкозы увеличивает ангиотензиноген в клетках проксимальных канальцев почек человека за счет ядерного фактора-5 гепатоцитов. PLoS One. 2017; 12: e0185600. DOI: 10.1371 / journal.pone.0185600. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Чжан С.Л., Филеп Дж. Г., Хохман Т. К., Тан СС, Ингельфингер Дж. Р., Чан Дж. С.. Молекулярные механизмы действия глюкозы на экспрессию гена ангиотензиногена в клетках проксимальных канальцев крыс. Kidney Int. 1999; 55: 454–64. DOI: 10.1046 / j.1523-1755.1999.00271.x. Проблема. [PubMed] [CrossRef] [Google Scholar] 50.Мията К., Охаши Н., Сузаки Ю., Кацурада А., Кобори Х. Последовательная активация оси реактивных форм кислорода / ангиотензиногена / ренин-ангиотензиновой системы при повреждении почек у крыс с диабетом 2 типа. Clin Exp Pharmacol Physiol. 2008; 35: 922–7. DOI: 10.1111 / j.1440-1681.2008.04938.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Kamiyama M, Urushihara M, Morikawa T., Konishi Y, Imanishi M, Nishiyama A, et al. Оксидативный стресс / ангиотензиноген / ренин-ангиотензиновая система у пациентов с диабетической нефропатией.Int J Mol Sci. 2013; 14: 23045–62. DOI: 10.3390 / ijms141123045. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Огава С., Мацусима М., Мори Т., Окамура М., Сенда М., Сакамото Т. и др. Выявление стадий диабетической нефропатии, при которых блокаторы рецепторов ангиотензина II наиболее эффективно подавляют альбуминурию. Am J Hypertens. 2013; 26: 1064–9. DOI: 10,1093 / ajh / hpt085. Проблема. [PubMed] [CrossRef] [Google Scholar] 53. Сато Э., Мори Т., Сато М., Фудзивара М., Накамичи Ю., Оба И. и др. Экскреция ангиотензиногена с мочой связана с артериальным давлением у молодых людей с ожирением.Clin Exp Hypertens. 2016; 38: 203–8. DOI: 10.3109 / 10641963.2015.1081219. Проблема. [PubMed] [CrossRef] [Google Scholar] 54. Ихара Г., Киемото Х., Кобори Х., Нагаи Й., Охаши Н., Хитоми Х. и др. Регрессия повреждения поверхностных клубочковых подоцитов у крыс с диабетом 2 типа с явной альбуминурией: эффект блокады ангиотензина II. J Hypertens. 2010; 28: 2289–98. DOI: 10.1097 / HJH.0b013e32833dfcda. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Кониси Ю., Нишияма А., Морикава Т., Китабаяси С., Сибата М., Хамада М. и др.Связь между ангиотензиногеном мочи и солевой чувствительностью артериального давления у пациентов с нефропатией ига. Гипертония. 2011; 58: 205–11. DOI: 10.1161 / HYPERTENSIONAHA.110.166843. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Эригути М., Йотсуэда Р., Торису К., Кавай Й., Хасэгава С., Танака С. и др. Оценка ангиотензиногена мочи как маркера повреждения подоцитов при протеинурических нефропатиях. Am J Physiol Renal Physiol. 2016; 310: F322–33. DOI: 10.1152 / ajprenal.00260.2015. Вып. [PubMed] [CrossRef] [Google Scholar] 57. Охаши Н., Урушихара М., Сато Р., Кобори Х. Гломерулярный ангиотензиноген индуцируется в мезангиальных клетках диабетических крыс через пути реактивных форм кислорода — erk / jnk. Hypertens Res. 2010; 33: 1174–81. DOI: 10.1038 / ч. 2010.143. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Такамацу М., Урушихара М., Кондо С., Симидзу М., Мориока Т., Оите Т. и др. Гломерулярный белок ангиотензиногена усиливается при педиатрической нефропатии. Педиатр Нефрол.2008; 23: 1257–67. DOI: 10.1007 / s00467-008-0801-6. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Чжан С.Л., Тан СС, Чен Х, Филеп Дж. Г., Ингельфингер Дж. Р., Чан Дж. С.. Высокие уровни глюкозы стимулируют экспрессию гена ангиотензиногена через путь митоген-активируемой протеинкиназы p38 в клетках проксимальных канальцев почек крысы. Эндокринология. 2000; 141: 4637–46. DOI: 10.1210 / endo.141.12.7844. Проблема. [PubMed] [CrossRef] [Google Scholar] 60. Се Т.Дж., Чжан С.Л., Филеп Дж. Г., Тан СС, Ингельфингер-младший, Чан Дж. С..Высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена за счет генерации активных форм кислорода в клетках проксимальных канальцев почек крысы. Эндокринология. 2002. 143: 2975–85. DOI: 10.1210 / endo.143.8.8931. Проблема. [PubMed] [CrossRef] [Google Scholar] 61. Кобори Х., Нишияма А. Влияние темпола на продукцию почечного ангиотензиногена у чувствительных к соли крыс. Biochem Biophys Res Commun. 2004; 315: 746–50. DOI: 10.1016 / j.bbrc.2004.01.120. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 62. Ли Дж., Brasier AR.Активация гена ангиотензиногена ангиотензином II опосредуется фактором транскрипции rel a (ядерный фактор-каппаб p65): одним из механизмов петли положительной обратной связи ренин-ангиотензиновой системы в гепатоцитах. Мол Эндокринол. 1996. 10: 252–64. DOI: 10.1210 / исправление.10.3.8833654. Проблема. [PubMed] [CrossRef] [Google Scholar] 63. Бринкманн М.М., Гленн М., Радуга Л., Кизер А., Хенке-Гендо С., Шульц Т.Ф. Активация митоген-активируемой протеинкиназы и путей nf-каппаб мембранным белком k15 герпеса, ассоциированным с саркомой Капоши.J Virol. 2003. 77: 9346–58. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Hoffmann E, Thiefes A, Buhrow D, Dittrich-Breiholz O, Schneider H, Resch K и др. Mek1-зависимая отсроченная экспрессия fos-родственного антигена-1 противодействует c-fos и p65 nf-kappab-опосредованной транскрипции интерлейкина-8 в ответ на цитокины или факторы роста. J Biol Chem. 2005; 280: 9706–18. DOI: 10.1074 / jbc.M407071200. Проблема. [PubMed] [CrossRef] [Google Scholar] 65. Дин И, Дэвиссон Р.Л., Харди Д.О., Чжу Л.Дж., Меррилл, округ Колумбия, Кэттералл Дж.Ф. и др.Промотор белка, регулируемого андрогенами почек, обеспечивает специфичную для клеток проксимального канальца почек и высокую андроген-чувствительную экспрессию гена ангиотензиногена человека у трансгенных мышей. J Biol Chem. 1997. 272: 28142–8. Проблема. [PubMed] [Google Scholar] 66. Накано Д., Кобори Х., Берфорд Дж. Л., Геворгян Х., Зайдель С., Хитоми Х и др. Мультифотонная визуализация клубочковой проницаемости ангиотензиногена. J Am Soc Nephrol. 2012; 23: 1847–56. DOI: 10.1681 / ASN.2012010078. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Roksnoer LC, Verdonk K, van den Meiracker AH, Hoorn EJ, Zietse R, Danser AH. Мочевые маркеры активности внутрипочечной ренин-ангиотензиновой системы in vivo. Curr Hypertens Rep., 2013; 15: 81–8. DOI: 10.1007 / s11906-012-0326-z. Проблема. [PubMed] [CrossRef] [Google Scholar] 68. Zhuang Z, Bai Q, Lata A, Liang Y, Zheng D, Wang Y. Изменения концентрации ангиотензиногена в моче и его связь с белками мочи у крыс с диабетом. Int J Clin Exp Pathol. 2015; 8: 11946–56. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Сайто Т., Урушихара М., Котани Ю., Кагами С., Кобори Х. Повышенный ангиотензиноген в моче является прецедентом повышения уровня альбумина в моче у пациентов с диабетом 1 типа. Am J Med Sci. 2009; 338: 478–80. DOI: 10.1097 / MAJ.0b013e3181b90c25. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Чжуанг З., Бай Ц., Лян А.Л., Чжэн Ю., Ван ДЙ. Повышение уровня ангиотензиногена в моче предшествует развитию альбуминурии у нормотензивных пациентов с диабетом 2 типа. Int J Clin Exp Pathol. 2015; 8: 11464–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71.Солтысяк Дж., Сковронска Б., Фична П., Остальска-Новицка Д., Станкевич В., Левандовска-Стаховяк М. и др. Ангиотензиноген и натрий в моче связаны с артериальным давлением у детей с нормоальбуминурией и диабетом. Педиатр Нефрол. 2014; 29: 2373–8. DOI: 10.1007 / s00467-014-2861-0. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Кобори Х., Альпер А.Б., младший, Шенава Р., Кацурада А., Сайто Т., Охаши Н. и др. Ангиотензиноген мочи как новый биомаркер состояния внутрипочечной ренин-ангиотензиновой системы у пациентов с артериальной гипертензией.Гипертония. 2009; 53: 344–50. DOI: 10.1161 / HYPERTENSIONAHA.108.123802. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Кобори Х., Охаши Н., Кацурада А., Мията К., Сато Р., Сайто Т. и др. Ангиотензиноген мочи как потенциальный биомаркер тяжести хронических заболеваний почек. J Am Soc Hyperten. 2008; 2: 349–54. DOI: 10.1016 / j.jash.2008.04.008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. ван ден Хеувел М., Батенбург В. В., Джайнандунсинг С., Гаррелдс И. М., ван Гул Дж. М., Фелдерс Р. А. и др.Ренин в моче, но не ангиотензиноген или альдостерон, отражает активность почечной ренин-ангиотензин-альдостероновой системы и эффективность блокады ренин-ангиотензин-альдостероновой системы в почках. J Hypertens. 2011; 29: 2147–55. DOI: 10.1097 / HJH.0b013e32834bbcbf. Проблема. [PubMed] [CrossRef] [Google Scholar] 75. Мацусака Т., Ниймура Ф., Пастан I, Шинтани А., Нишияма А., Итикава И. Повреждение подоцитов усиливает фильтрацию печеночного ангиотензиногена и почечного ангиотензина II поколения. Kidney Int.2014; 85: 1068–77. DOI: 10.1038 / ki.2013.453. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Мацусака Т., Ниймура Ф., Симидзу А., Пастан I, Сайто А., Кобори Х. и др. Ангиотензиноген печени является основным источником почечного ангиотензина II. J Am Soc Nephrol. 2012; 23: 1181–9. DOI: 10.1681 / ASN.2011121159. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экскреция ангиотензиногена с мочой отражает внутрипочечную продукцию ангиотензиногена.Почки. 2002. 61: 579–85. DOI: 10.1046 / j.1523-1755.2002.00155.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Кацурада А., Хагивара Ю., Мияшита К., Сато Р., Мията К., Охаши Н. и др. Новый сэндвич-элиза для ангиотензиногена человека. Am J Physiol Renal Physiol. 2007; 293: F956–60. DOI: 10.1152 / айпренал.00090.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Нисидзима Ю., Кобори Х., Софуэ Т., Кайфу К., Мориваки К., Хара Т. и др. Важные аспекты забора мочи для измерения ангиотензиногена: время и условия хранения у здоровых людей.Tohoku J Exp Med. 2012; 228: 333–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Nishijima Y, Kobori H, Kaifu K, Mizushige T., Hara T., Nishiyama A, et al. Циркадный ритм ангиотензиногена плазмы и мочи у здоровых добровольцев и пациентов с хронической болезнью почек. J Renin Angiotensin Aldosterone Syst. 2014; 15: 505–8. DOI: 10.1177 / 1470320314557584. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 81. Кобори Х., Урушихара М, Сюй Дж. Х., Беренсон Г.С., Навар Л.Г. Ангиотензиноген в моче коррелирует с артериальным давлением у мужчин (исследование сердца) J Гипертензия.2010; 28: 1422–8. DOI: 10.1097 / HJH.0b013e3283392673. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 82. Миллс К.Т., Кобори Х., Хамм Л.Л., Альпер А.Б., Хан И.Е., Рахман М. и др. Повышенная экскреция ангиотензиногена с мочой связана с риском хронического заболевания почек. Nephrol Dial Transpl. 2012; 27: 3176–81. DOI: 10.1093 / ndt / gfs011. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Мидзусигэ Т., Кобори Х., Нисидзима Й., Яно Й., Саката К., Хаякава М. и др. Ангиотензиноген в моче может быть прогностическим маркером ренопротекторного действия алоглиптина у пациентов с диабетом 2 типа.J Diabetes Res. 2015; 2015: 517472. DOI: 10.1155 / 2015/517472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Савагути М., Араки С.И., Кобори Х., Урушихара М., Ханеда М., Коя Д. и др. Связь между уровнем ангиотензиногена в моче и прогнозом почек и сердечно-сосудистой системы у пациентов с сахарным диабетом 2 типа. J. Исследование диабета. 2012; 3: 318–24. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Кобори Х., Нишияма А., Абэ Й., Навар Л.Г. Повышение внутрипочечного ангиотензиногена у чувствительных к соли крыс на диете с высоким содержанием соли.Гипертония. 2003. 41: 592–7. DOI: 10.1161 / 01.HYP.0000056768.03657.B4. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86. Цзоу Дж, Ли Й, Ли Ф.Х., Вэй Ф.Ф., Ван Дж. Экскреция ангиотензиногена с мочой и амбулаторное артериальное давление. J Hypertens. 2012; 30: 2000–6. DOI: 10.1097 / HJH.0b013e3283576928. Проблема. [PubMed] [CrossRef] [Google Scholar] 87. Тирьяки О., Усалан С. Связь между скоростью экскреции ангиотензиногена с мочой и индексом массы левого желудочка и толщиной интимы-медиа сонной артерии у реципиентов трансплантата почки с гипертонией.Clin Transpl. 2015; 29: 351–8. DOI: 10.1111 / ctr.12521. Проблема. [PubMed] [CrossRef] [Google Scholar] 88. Рафик К., Нома Т., Фудзисава И., Исихара Ю., Араи Ю., Наби А.Х. и др. Симпатическая денервация почек подавляет повреждение подоцитов de novo и альбуминурию у крыс с аортальной регургитацией. Тираж. 2012; 125: 1402–13. DOI: 10.1161 / CIRCULATIONAHA.111.064097. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 89. Satirapoj B, Siritaweesuk N, Supasyndh O. Ангиотензиноген в моче как потенциальный биомаркер диабетической нефропатии.Clin Kidney J. 2014; 7: 354–60. DOI: 10.1093 / ckj / sfu059. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90. Курултак I, Сенгул С., Коджак С., Эрдогмус С., Калайоглу Р., Месцигил П. и др. Ангиотензиноген в моче, связанные факторы и клинические последствия у пациентов с нормотензивной аутосомно-доминантной поликистозной болезнью почек. Ren Fail. 2014; 36: 717–21. DOI: 10.3109 / 0886022X.2014.8. Проблема. [PubMed] [CrossRef] [Google Scholar] 91. Пак Х.С., Кан А.Ю., Чан Дж.Й., Ким Х., Хан М., О К.Х. и др. Повышенное соотношение ангиотензиноген / креатинин (agt / cr) в моче может быть связано со снижением функции почек у пациентов с аутосомно-доминантной поликистозной болезнью почек.BMC Nephrol. 2015; 16:86. DOI: 10.1186 / s12882-015-0075-8. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Тумлин Дж. А., Чавла Л. С. и др. Ангиотензиноген в моче и риск тяжелых аки. Clin J Am Soc Nephrol. 2013; 8: 184–93. DOI: 10.2215 / CJN.06280612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Велес Дж. К., Артур Дж. М. и др. Ангиотензиноген в моче позволяет прогнозировать неблагоприятные исходы у пациентов с острым повреждением почек в отделении интенсивной терапии.Crit Care. 2013; 17: R69. DOI: 10.1186 / cc12612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94. Китао Т., Кимата Т., Яманучи С., Като С., Цуджи С., Канеко К. Мочевые биомаркеры для скрининга почечных рубцов у детей с фебрильной инфекцией мочевыводящих путей: пилотное исследование. J Urol. 2015; 194: 766–71. DOI: 10.1016 / j.juro.2015.04.091. Проблема. [PubMed] [CrossRef] [Google Scholar] 95. Корвол П., Ламанд Н., Круз А., Селерье Дж., Гаск Дж. М.. Ингибирование ангиогенеза: новая функция ангиотензиногена и дез (ангиотензин I) ангиотензиногена.J Urol. 2003. 5: 149–54. Проблема. [PubMed] [Google Scholar]Независимая регуляция ренин-ангиотензин-альдостероновой системы в почках
Clin Exp Nephrol. Авторская рукопись; доступно в PMC 1 декабря 2018 г. 1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
Хироюки Кобори
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
Автор, ответственный за переписку.Эта статья распространяется в соответствии с условиями Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что вы укажете соответствующую ссылку. оригинальному автору (ам) и источнику, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Окончательная отредактированная версия этой статьи издателем доступна в Clin Exp Nephrol. См. другие статьи в PMC, в которых цитируется опубликованная статья. .Abstract
Ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регуляции почечной гемодинамики и функций, а также в патофизиологии гипертонии и почечной недостаточности. В почках производство ангиотензина II (Ang II) контролируется несколькими независимыми механизмами. Ang II отделен в почечной интерстициальной жидкости с гораздо более высокими концентрациями, чем те, которые присутствуют в кровотоке. Неправильная активация внутрипочечного РААС вносит важный вклад в патогенез гипертонии и почечного повреждения.Было обнаружено, что внутрипочечные уровни Ang II преимущественно регулируются ангиотензиногеном и, следовательно, ангиотензиноген в моче может быть биомаркером для внутрипочечного образования Ang II. Кроме того, недавние исследования показали, что альдостерон способствует прогрессированию почечного повреждения посредством прямого воздействия на клубочковые подоциты, мезангиальные клетки, клетки проксимальных канальцев и тубулоинтерстициальные фибробласты посредством активации локально экспрессируемых минералокортикоидных рецепторов. Таким образом, теперь выясняется, что внутрипочечный РААС регулируется независимо, и его несоответствующая активация вносит вклад в патогенез развития гипертонии и почечной недостаточности.В этой короткой обзорной статье основное внимание будет уделено независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена.
Ключевые слова: Ренин-ангиотензин-альдостероновая система (РААС), ангиотензин II (Ang II), ангиотензиноген, почки
Введение
Ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система, которая регулирует кровяное давление и баланс жидкости / электролитов [1]. Ангиотензин II (Ang II) связывается с рецептором Ang II типа 1 (AT 1 ) на гладкомышечных клетках сосудов и канальцах, что вызывает сужение сосудов и реабсорбцию натрия соответственно, что приводит к повышению артериального давления [2].Ang II также связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать продукцию альдостерона, что увеличивает реабсорбцию натрия за счет активации рецептора минералокортикоидов (MR) в дистальном отделе нефрона [3].
В настоящее время выясняется, что местная активация внутрипочечного РААС играет важную роль в патогенезе гипертонии и повреждения почечной ткани [4]. Ряд исследований показал, что прогрессирование протеинурии и повреждения почечной ткани связано с активацией внутрипочечного РААС [5–9].Также было показано, что лечение ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов Ang II AT 1 (БРА) значительно снижает протеинурию у пациентов с ХБП, независимо от изменений артериального давления [10]. Ранее мы показали, что активация внутрипочечного РААС предшествовала возникновению микроальбуминурии у крыс с диабетом 2 типа [11]. Кроме того, раннее лечение БРА уменьшало прогрессирование альбуминурии и почечного повреждения [6, 12]. Эти данные предполагают специфический вклад внутрипочечной активации РААС в патофизиологию протеинурии и почечного повреждения.
Во время лечения БРА накопление Ang II теоретически может конкурировать с БРА в сайте связывания рецептора. С другой стороны, увеличение Ang II во время лечения ARB позволяет стимулировать рецептор AT 2 [4]. Активация рецептора AT 2 связана с повышенным высвобождением оксида азота, гуанилатциклазы и тканевого брадикинина [13]. В отличие от рецептора AT 1 , рецептор AT 2 обладает свойствами, препятствующими росту, и стимулирует запрограммированную гибель клеток.Таким образом, рецептор AT 2 , по-видимому, уравновешивает эффекты рецептора AT 1 [14].
В этом обзоре мы кратко суммируем наше текущее понимание независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена. Механизмы, ответственные за повреждение почек, вызванное альдостероном, были рассмотрены ранее [1, 15, 16] и не будут подробно обсуждаться в этом обзоре.
Регуляция циркулирующих классических путей РААС ()
Краткая схема регуляции циркулирующей ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II, JG клетка юкстагломерулярная клетка, MR минералокортикоидный рецептор
Перед обсуждением регуляции внутрипочечного RAAS в плазме классической регуляцией будет RAAS. обсуждается [1, 4]. Ангиотензиноген — единственный известный субстрат для ренина, который является ферментом, ограничивающим скорость РААС. Ангиотензиноген в основном образуется клетками печени и постоянно секретируется в кровоток [17, 18], тогда как ренин высвобождается в основном из юкстагломерулярных клеток почек [4, 19] и расщепляет ангиотензиноген на N-конце с образованием ангиотензина I (Ang I ) [20].В плазме уровни ангиотензиногена намного выше, чем концентрации Ang I и Ang II более чем в 1000 раз [7]. Поскольку уровни ангиотензиногена в плазме близки к константе Михаэлиса-Ментен для ренина, уровни ангиотензиногена могут контролировать уровни Ang I в плазме [17, 21]. Действительно, было показано, что повышение уровня ангиотензиногена приводит к повышению уровня Ang II в плазме [22, 23]. Однако изменения в синтезе ангиотензиногена происходят медленно и, таким образом, менее ответственны за динамическую регуляцию плазменного Ang I [17, 24].Поэтому было высказано предположение, что изменения в активности ренина плазмы (PRA) играют доминирующую роль в определении скорости образования Ang I из огромных запасов циркулирующего ангиотензиногена в плазме [1, 25]. показаны типичные концентрации ангиотензиногена в плазме, измеренные у анестезированных крыс и выраженные в наномолях на литр, тогда как концентрации Ang I и Ang II выражены в пикомолях на литр. Как показано на фиг.1, концентрации Ang I и Ang II в плазме, по-видимому, представляют собой небольшие доли доступного ангиотензиногена, что подтверждает идею о том, что ренин является критическим фактором для определения генерации Ang II в плазме [1, 18, 25] .Ang I в плазме легко превращается в Ang II не только благодаря циркулирующему растворимому типу АПФ, но также благодаря широко распространенному присутствию АПФ на эндотелиальных клетках многих сосудистых русел, включая легкие [2, 18]. Хотя были идентифицированы другие пути образования Ang II из Ang I [26], циркулирующие уровни Ang II отражают в первую очередь последствия ферментативного каскада ренина и АПФ на ангиотензиноген и Ang I [27, 28]. Циркулирующий Ang II связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать выработку альдостерона, что увеличивает реабсорбцию натрия за счет активации MR в дистальном отделе нефрона [3].
Регуляция локальных путей РААС в почках ()
Краткая схема регуляции внутрипочечной ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II
В почках продукция Ang II контролируется независимыми множественными механизмами [4]. Все компоненты, необходимые для генерации внутрипочечного Ang II, присутствуют вдоль нефрона [2, 7]. Концентрации Ang II в тканях почек намного выше, чем можно объяснить концентрациями, доставляемыми артериальным кровотоком [4, 29].Плазма-ангиотензиноген может не проникать через клубочковую мембрану из-за своего молекулярного размера, но почки также экспрессируют ангиотензиноген [5, 30]. Однако уровни ангиотензиногена в тканях почек намного ниже, чем в плазме [4]. С другой стороны, ренин секретируется клетками юкстагломерулярного аппарата и доставляется в почечный интерстиций, который обеспечивает путь локальной генерации Ang I в почках [19]. В частности, исследования показали, что активность ренина в почечной ткани более чем в 1000 раз выше, чем PRA (пикомолярные уровни Ang I / мл плазмы / час по сравнению снаномолярные уровни Ang I / г ткани / ч) [31]. Таким образом, большое количество ренина может легко расщеплять ангиотензиноген с образованием Ang I. Кроме того, Ang I также может легко превращаться в Ang II в почках [32, 33], потому что ACE обильно экспрессируется в проксимальных и дистальных канальцах, собирательных протоках и др. и почечные эндотелиальные клетки [34]. В совокупности, в отличие от роли ренина в плазме, ангиотензиноген является критическим фактором, регулирующим продукцию Ang II в почках. С другой стороны, подробный механизм, ответственный за индуцированную Ang II продукцию альдостерона в почках, до сих пор не выяснен ().
Исследования показали компартментализацию и независимую регуляцию почечной интерстициальной и канальцевой жидкости Ang II. Концентрации Ang II в почечной интерстициальной жидкости намного выше, чем уровни в плазме [35]. Nishiyama et al. [36] показали, что почечная интерстициальная инфузия ингибиторов АПФ значительно снижает уровни Ang II в почечной интерстициальной жидкости. Эти данные указывают на то, что Ang II генерируется в почечном интерстициальном пространстве. Также было показано, что концентрация Ang II в жидкости проксимальных канальцев в 100–200 раз выше, чем в плазме [37, 38].Эти результаты предполагают, что Ang II также синтезируется в просвете проксимального канальца, по крайней мере частично [39, 40].
Помимо внутрипочечной генерации Ang II, циркулирующий Ang II интернализуется в почках через рецептор AT 1 [41]. Ли и др. [42] показали, что внутрипочечный перенос / накопление Ang II в эндосомах кортикальных канальцев почек усиливается во время развития Ang II-индуцированной гипертензии. Важно отметить, что лечение БРА блокирует интернализацию Ang II в почках.
Специфическая роль ангиотензиногена в регуляции продукции Ang II в почках
В почках мРНК и белок ангиотензиногена в основном локализованы в клетках проксимальных канальцев [43, 44]. Ангиотензиноген, продуцируемый в клетках проксимальных канальцев, по-видимому, секретируется непосредственно в просвет канальцев и почечный интерстиций в дополнение к производству своих метаболитов внутриклеточно [45]. Сообщается, что концентрация ангиотензиногена в проксимальных канальцах у анестезированных крыс находится в диапазоне 300-600 нмоль / л, что значительно превышает уровни Ang I и Ang II в канальцевой жидкости [7].Трансгенные мыши, которые системно экспрессируют человеческий ренин и человеческий ангиотензиноген только в почках, показали повышенные внутрипочечные уровни Ang II, в то время как уровни Ang II в плазме не изменились. Интересно, что у этих мышей также была увеличена экспрессия эндогенного ангиотензиногена мыши [23]. Таким образом, селективная стимуляция внутрипочечной продукции Ang II из человеческого ангиотензиногена дополнительно стимулирует экспрессию эндогенного внутрипочечного ангиотензиногена мыши. Сходным образом внутрипочечная экспрессия ангиотензиногена увеличивается у крыс с гипертензией, которым вводили Ang II [46, 47].Хронические инфузии Ang II также значительно увеличивали скорость экскреции ангиотензиногена с мочой в зависимости от времени и дозы, что было связано с повышением систолического артериального давления и уровней Ang II в почках, но не с концентрациями Ang II в плазме [30]. Кроме того, лечение БРА предотвращало индуцированное Ang II увеличение экспрессии ангиотензиногена в почках и ангиотензиногена мочи [30]. Эти данные предполагают, что продукция ангиотензиногена в почках положительно стимулируется локальным Ang II через активацию рецептора AT 1 .Дальнейшие исследования показали, что высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена в клетках проксимальных канальцев человека [48, 49]. Кроме того, в почечных тканях крыс с диабетом 2 типа [6, 11, 44, 50] и пациентов [51] экспрессия генов ангиотензиногена была значительно увеличена в почках. Таким образом, можно предположить, что во время развития диабета высокий уровень глюкозы первоначально увеличивает внутрипочечные уровни ангиотензиногена, что приводит к образованию Ang II в почках. Затем несоответствующее производство Ang II может дополнительно стимулировать локальную экспрессию ангиотензиногена и связанное с ним образование Ang II в почках.Предполагается, что такой порочный круг внутрипочечной активации РААС является критическим фактором прогрессирования диабетической нефропатии [52, 53]. Исследования также показали, что лечение БРА значительно снижает как экспрессию ангиотензиногена, так и уровни Ang II в почках [6, 10, 12, 54, 55]. Таким образом, фармакологические ренопротекторные эффекты БРА можно частично объяснить ингибированием продукции внутрипочечного ангиотензиногена и Ang II. Хотя почечный ангиотензиноген преимущественно локализуется в проксимальных канальцах [44, 46, 47], слабая экспрессия также обнаруживается в клубочках.Поскольку гломерулярный ангиотензиноген повышен в поврежденных клубочках [56–58], локальная активация RAAS в клубочках может играть роль в патофизиологии повреждения клубочков. Недавно Eriguchi et al. [56] показали, что ангиотензиноген вырабатывается в поврежденных подоцитах клубочков у нефротических крыс, индуцированных пуромицином. Эти данные предполагают потенциальный вклад генерации ангиотензиногена подоцитами в прогрессирование протеинурии.
Помимо двух факторов, Ang II и высокого уровня глюкозы, другие факторы, такие как митоген-активированные протеинкиназы (MAPK), активные формы кислорода (ROS) и ядерный фактор, усиливающий легкую каппа-цепь активированных B-клеток (NFkB ), как сообщалось, также активируют экспрессию ангиотензиногена.Zhang et al. [59] показали, что экспрессия гена ангиотензиногена стимулируется через путь киназы p38 в иммортализованных клетках проксимальных канальцев почки крысы. Hsieh et al. [60] обнаружили, что экспрессия гена ангиотензиногена активируется через ROS в клеточной линии проксимальных канальцев. Кроме того, Kobori и Nishiyama [61] представили доказательства in vivo, что АФК стимулируют экспрессию гена ангиотензиногена в почках чувствительных к соли крыс Даля, которым вводят диету с высоким содержанием соли. Наконец, экспрессия гена ангиотензиногена активируется фактором транскрипции NFkB p65 в гепатоцитах [62].Также было высказано предположение о возможной связи между активацией MAPK и путями NFkB [63, 64].
Ангиотензиноген мочи как биомаркер внутрипочечного РААС и повреждения почек
Как упоминалось ранее, ангиотензиноген плазмы не может легко проникать через клубочковую мембрану из-за своего молекулярного размера. Ding et al. [65] получили мышей со сверхэкспрессией человеческого ангиотензиногена, специфичной для почек, и обнаружили большое количество человеческого ангиотензиногена в моче, но лишь незначительные следы в системном кровотоке.Kobori et al. [30] крысам внутривенно вводили человеческий ангиотензиноген; однако циркулирующий ангиотензиноген человека в моче не обнаруживался. Дальнейшие исследования с помощью двухфотонной микроскопии визуализировали гломерулярную динамику in vivo и показали, что клубочковая фильтрация циркулирующего ангиотензиногена человека намного меньше по сравнению с альбумином у мышей, что свидетельствует об ограниченной проницаемости клубочков [66].
Поскольку ангиотензиноген является белком, можно подумать, что у субъектов с протеинурией повышенная экскреция ангиотензиногена с мочой является неспецифическим следствием повышенной экскреции белков плазмы с мочой [67, 68].Однако уровень ангиотензиногена в моче не увеличивался, хотя уровень белка в моче повышен у крыс, получавших дезоксикортикостерон ацетат, что является моделью RAAS-независимой гипертензии [30]. Кроме того, соотношение ангиотензиноген / креатинин в моче у пациентов с незначительной патологией клубочков (8,3 ± 3,7 мкг / г Cr) было таким же, как и у здоровых субъектов (10,8 ± 3,4 мкг / г Cr), даже несмотря на то, что у этих пациентов наблюдалась тяжелая протеинурия [9 ]. У пациентов с преальбуминурией и диабетом 1 типа уровни ангиотензиногена в моче были уже выше, чем у контрольных субъектов [69].Zhuang et al. [70] показали, что повышенный уровень ангиотензиногена в моче предшествует развитию альбуминурии у пациентов с диабетом 2 типа. Точно так же ангиотензиноген с мочой и экскреция натрия значительно увеличиваются у детей с нормальным альбуминурием и диабетом [71]. Эти данные предполагают, что повышенный уровень ангиотензиногена в моче у пациентов с протеинурией нельзя просто объяснить неспецифическими последствиями протеинурии.
Однако циркулирующий ангиотензиноген может фильтроваться через клубочковую мембрану при некоторых патофизиологических условиях.Действительно, несколько клинических исследований показали, что уровни ангиотензиногена в моче достоверно коррелируют с альбуминурией у пациентов с артериальной гипертензией [72] и ХБП [67, 73, 74]. Matsusaka et al. [75, 76] показали, что у мышей с тяжелым повреждением подоцитов и потерей макромолекулярной барьерной функции стенки клубочковых капилляров внутрипочечная генерация Ang II увеличивается за счет фильтрованного ангиотензиногена, происходящего из печени. Eriguchi et al. [56] показали, что во время прогрессирования повреждения подоцитов отфильтрованный ангиотензиноген обильно реабсорбируется проксимальными канальцами, что приводит к снижению генерации ангиотензиногена в проксимальных канальцах.Также было высказано предположение, что клубочковые подоциты являются важным источником ангиотензиногена мочи при этом патологическом состоянии [9]. Эти данные предполагают, что фильтрованный циркулирующий ангиотензиноген также может быть источником и / или триггером генерации внутрипочечного Ang II у субъектов с тяжелым повреждением барьера клубочковой фильтрации, что может играть важную роль в активации внутрипочечного RAAS во время прогрессирования ХБП.
Растущее количество доказательств показывает, что ангиотензиноген в моче является специфическим биомаркером состояния внутрипочечного РААС, гипертонии и почечной недостаточности.Kobori et al. [30, 77] провели эксперименты на животных и показали, что повышение уровня ангиотензиногена в моче связано с увеличением экспрессии почечного ангиотензиногена и уровня Ang II в почках. У пациентов с незначительной патологией клубочков и IgA-нефропатией соотношение ангиотензиноген / креатинин в моче сильно коррелирует с экспрессией гена ангиотензиногена в тканях почечной биопсии [9]. Эти данные показали, что ангиотензиноген мочи является полезным маркером для прогнозирования уровней ангиотензиногена в почках этих пациентов.Сэндвич-твердофазный иммуноферментный анализ (ELISA) на человеческий ангиотензиноген был разработан Katsurada et al. [78], и теперь он коммерчески доступен, что позволило легко измерить большое количество образцов с течением времени. Также было показано, что обычные условия хранения не влияют на измеренные значения ангиотензиногена мочи [79]. Кроме того, экскреция ангиотензиногена с мочой не имеет циркадного ритма [80]. Таким образом, исследования ангиотензиногена в моче получили широкое распространение в мире, и растущее количество клинических данных указывает на то, что повышенные уровни ангиотензиногена в моче коррелируют с клиническими параметрами у пациентов с артериальной гипертензией [71, 72, 81] и ХБП [55, 73, 82–84].
Kobori et al. [81] показали, что ангиотензиноген в моче значительно коррелировал с артериальным давлением у пациентов с артериальной гипертензией, которые не получали антигипертензивные препараты. Они также обнаружили, что эта корреляция была высокой у чернокожих мужчин, что позволяет предположить возможный вклад ангиотензиногена мочи в солевую гипертензию. Интересно, что Kobori et al. [85] также показали, что как экспрессия ангиотензиногена в тканях почек, так и ангиотензиноген в моче заметно увеличивались у крыс с гипертензией, чувствительных к соли Даля.Кониши и др. [55] показали, что натрий-чувствительный индекс артериального давления сильно коррелирует с ангиотензиногеном мочи у пациентов с нефропатией IgA, у которых наблюдается натрий-зависимое повышение артериального давления. Аналогичным образом Zou et al. [86] показали, что экскреция ангиотензиногена с мочой выше при большей экскреции натрия с мочой и связана как с клиническим, так и с амбулаторным артериальным давлением. Дальнейшие исследования показали, что повышение уровня ангиотензиногена в моче значительно коррелирует с уровнем натрия в моче и предшествует гипертензии у детей с нормальным альбуминурием и диабетом 1 типа [71].Эти данные позволяют предположить, что ангиотензиноген мочи является полезным биомаркером для выявления натрийзависимой гипертензии. Савагути и др. [84] показали, что ангиотензиноген в моче сильно коррелировал с частотой сердечно-сосудистых осложнений у пациентов с диабетической нефропатией 2 типа. Недавние исследования также показали, что ангиотензиноген в моче значительно коррелирует с индексом массы левого желудочка и толщиной интима-медиа у пациентов с гипертонической болезнью, перенесших трансплантацию почки [87]. Мы также показали, что уровни ангиотензиногена в моче и внутрипочечного ангиотензиногена значительно увеличиваются у крыс с аортальной регургитацией [88], что указывает на потенциальную роль внутрипочечного ангиотензиногена в патофизиологии кардио-почечного синдрома.
Несколько клинических исследований показали, что ангиотензиноген в моче значительно повышен у пациентов с ХБП, включая IgA-нефропатию [55], диабетическую нефропатию [84, 87, 89], поликистоз почек [90, 91], фокальный сегментарный гломерулосклероз [56]. У этих пациентов с ХБП уровень ангиотензиногена в моче положительно коррелирует с уровнем белка или альбумина в моче, тогда как он отрицательно коррелирует с расчетной скоростью клубочковой фильтрации. Недавние исследования также показали, что ангиотензиноген мочи является прогностическим биомаркером острого повреждения почек [92, 93] и рубцевания почек [94].Однако важно отметить, что антитела, используемые в коммерчески доступных наборах для анализа ангиотензиногена ELISA, распознают как интактный ангиотензиноген, так и ангиотензиноген des-Ang I [78]. Схематически ангиотензиноген можно рассматривать как состоящий из комбинации функции Ang I, расположенной на N-конце, и присутствия структуры серпина (ингибитора сериновой протеазы) на противоположном конце. Таким образом, необходимы дальнейшие исследования с использованием нового набора ELISA для интактного ангиотензиногена.Кобори и Нишияма недавно предположили, что соотношение между ангиотензиногеном des-Ang I и интактным ангиотензиногеном может быть стабильным маркером активности ренина (был зарегистрирован патент PCT / JP2014 / 078751). Поскольку уровни ангиотензиногена в плазме очень высоки, мы предполагаем, что острые изменения в активации ренина могут не отражать соотношение ангиотензиноген des-Ang I / интактный ангиотензиноген в плазме. Чтобы проверить эту идею, мы электрически стимулировали почечный симпатический нерв с частотой 1 Гц (5 В, 1 мс) в течение 20 минут у анестезированных крыс и собрали образцы плазмы и мочи.Все экспериментальные процедуры проводились в соответствии с руководящими принципами по уходу и использованию животных, установленными Университетом Кагава (Кагава, Япония). Наши предварительные данные показали, что активация почечного симпатического нерва значительно увеличила PRA, но не изменила соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в плазме (). Интересно, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче вскоре увеличивалось при стимуляции почечного симпатического нерва. Эти данные позволяют предположить, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче является потенциальным биомаркером активности ренина в почках.
Влияние электрической стимуляции почечного симпатического нерва с частотой 1 Гц (5 В, 1 мс) в течение 20 минут на PRA, соотношение Des-Ang I-AGT / интактный AGT в плазме и соотношение Des-Ang I-AGT / интактный AGT в моче у анестезированных крыс ( n = 12–15). PRA активность ренина плазмы, AGT ангиотензиноген, Ang I ангиотензин I. * P <0,05 по сравнению с контролем
Ангиотензиноген Des-Ang I, составляющий более 97% молекулы, по-видимому, не имеет функция.Недавно было показано, что некоторые серпины (антитромбин, маспин, фактор пигментного эпителия и каллистатин) обладают антиангиогенной активностью, что свидетельствует об общем механизме пролиферации и миграции эндотелиальных клеток. Ангиотензиноген и его продукт расщепления ренин, ангиотензиноген des-Ang I, также являются ингибиторами ангиогенеза как in vitro, так и in vivo в концентрациях в диапазоне концентраций, наблюдаемых в плазме. Это свойство, скорее всего, является следствием структурной аналогии ангиотензиногена с серпинами.Патологическое значение этой новой функции все еще не известно, но ангиотензиноген, продуцируемый глиальными клетками, может играть роль в стабилизации гематоэнцефалического барьера. Эти новые данные следует рассматривать в свете общего действия ренин-ангиотензиновой системы на ангиогенез [95].
Выводы
Внутрипочечный RAAS независимо регулируется, и его несоответствующая активация вносит свой вклад в патогенез развития гипертонии и почечной недостаточности. В этом кратком обзоре обсуждалась особая роль ангиотензиногена в регуляции внутрипочечной активности РААС.Локально экспрессируемый ангиотензиноген является основным фактором контроля внутрипочечных уровней Ang II, но фильтрованный циркулирующий ангиотензиноген также может быть источником образования внутрипочечного Ang II, если барьер клубочковой фильтрации серьезно поврежден. В любом случае ангиотензиноген мочи является полезным биомаркером для определения статуса внутрипочечного РААС, гипертензии и почечной недостаточности.
Благодарности
Финансирование Это исследование было частично поддержано Японским обществом содействия науке (JSPS) по грантам на научные исследования (KAKENHI) (26460343 Акире Нишияме и 15K08237 Хироюки Кобори).
Сноски
Соблюдение этических стандартов
Конфликт интересов Авторы заявили, что конфликта интересов не существует.
Этическое разрешение Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам учреждения или практики, в которой проводились исследования (номер одобрения Университета Кагава: # 15,031).
Ссылки
1. Нишияма А., Ким-Мицуяма С.Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: Обзор регуляции системы ренин-ангиотензин-альдостерон. J Pharmacol Sci. 2010. 113: 289–91. Проблема. [PubMed] [Google Scholar] 2. Navar LG, Inscho EW, Majid SA, Imig JD, Harrison-Bernard LM, Mitchell KD. Паракринная регуляция почечной микроциркуляции. Physiol Rev.1996; 76: 425–536. DOI: 10.1152 / Physrev.1996.76.2.425. Проблема. [PubMed] [CrossRef] [Google Scholar] 3. Нишияма А., Хитоми Х., Рахман А., Киемото Х. Открытие лекарств для преодоления хронической болезни почек (ХБП): Фармакологические эффекты блокаторов минералокортикоидных рецепторов.J Pharmacol Sci. 2009; 109: 1–6. Проблема. [PubMed] [Google Scholar] 4. Кобори Х., Нангаку М., Навар Л.Г., Нишияма А. Внутрипочечная ренин-ангиотензиновая система: от физиологии к патобиологии гипертонии и болезней почек. Pharmacol Rev.2007; 59: 251–87. DOI: 10.1124 / pr.59.3.3. Проблема. [PubMed] [CrossRef] [Google Scholar] 5. Кобори Х., Одзава Й., Сузаки Й., Прието-Карраскеро М.С., Нишияма А., Сёдзи Т. и др. Лекция молодых ученых: «Внутритрубчатый ангиотензиноген при гипертонии и заболеваниях почек»Am J Hypertens. 2006; 19: 541–50. DOI: 10.1016 / j.amjhyper.2005.11.014. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Нагаи Ю., Яо Л., Кобори Х., Мията К., Одзава Ю., Миятаке А. и др. Временная блокада ангиотензина II на преддиабетической стадии ослабляет развитие повреждения почек у крыс с диабетом 2 типа. J Am Soc Nephrol. 2005; 16: 703–11. DOI: 10.1681 / ASN.2004080649. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Навар Л.Г., Нишияма А. Внутрипочечное образование ангиотензина II.Contrib Nephrol. 2001; (135): 1–15. [PubMed] [Google Scholar] 8. Нишияма А., Кобори Х., Фукуи Т., Чжан Г.Х., Яо Л., Рахман М. и др. Роль ангиотензина II и активных форм кислорода в циклоспорин А-зависимой гипертензии. Гипертония. 2003. 42: 754–60. DOI: 10.1161 / 01.HYP.0000085195.38870.44. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Нишияма А., Кониси Ю., Охаши Н., Морикава Т., Урушихара М., Маеда И. и др. Ангиотензиноген мочи отражает активность внутрипочечной ренин-ангиотензиновой системы у пациентов с нефропатией iga.Nephrol Dial Transpl. 2011; 26: 170–7. DOI: 10.1093 / ndt / gfq371. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Fan YY, Kobori H, Nakano D, Hitomi H, Mori H, Masaki T и др. Аберрантная активация внутрипочечной ренин-ангиотензиновой системы в развивающихся почках крыс с диабетом 2 типа. Horm Metab Res. 2013; 45: 338–43. DOI: 10,1055 / с-0032-1331256. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Нишияма А., Накагава Т., Кобори Х., Нагаи Ю., Окада Н., Кониси И. и др.Строгая блокада ангиотензина предотвращает увеличение внутрипочечного ангиотензина II и аномалии подоцитов у крыс с диабетом 2 типа с микроальбуминурией. J Hypertens. 2008; 26: 1849–59. DOI: 10.1097 / HJH.0b013e3283060efa. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13. Сираджи Х.М., Кэри РМ. Защитная роль рецептора ангиотензина AT2 в модели почечной гипертензии. Гипертония. 1999; 33: 1237–42. Проблема. [PubMed] [Google Scholar] 14. Навар Л.Г., Митчелл К.Д., Харрисон-Бернард Л.М., Кобори Х., Нишияма А.Рассмотрение. Уровни внутрипочечного ангиотензина II в норме и при гипертонии. J Renin Angiotensin Aldosterone Syst. 2001; 2: S176 – S84. DOI: 10.1177 / 14703203010020013001. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Нишияма А., Хасегава К., Диах С., Хитоми Х. Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: блокаторы минералокортикоидных рецепторов оказывают антигипертензивное и ренопротекторное действие независимо от системы ренин-ангиотензин. J Pharmacol Sci. 2010; 113: 310–4.Проблема. [PubMed] [Google Scholar] 16. Рафик К., Хитоми Х, Накано Д., Нишияма А. Патофизиологические роли альдостерона и рецептора минералокортикоидов в почках. J Pharmacol Sci. 2011; 115: 1–7. Проблема. [PubMed] [Google Scholar] 17. Brasier AR, Li J. Механизмы индуцируемого контроля транскрипции гена ангиотензиногена. Гипертония. 1996; 27: 465–75. Проблема. [PubMed] [Google Scholar] 18. Пол М., Поян Мехр А., Кройц Р. Физиология местных ренин-ангиотензиновых систем. Physiol Rev.2006; 86: 747–803. DOI: 10.1152 / Physrev.00036.2005. Проблема. [PubMed] [CrossRef] [Google Scholar] 19. Hackenthal E, Paul M, Ganten D, Taugner R. Морфология, физиология и молекулярная биология секреции ренина. Physiol Rev.1990; 70: 1067–116. DOI: 10.1152 / Physrev.1990.70.4.1067. Проблема. [PubMed] [CrossRef] [Google Scholar] 20. Бейлис К., Энгельс К., Химел А., Навар Л.Г. Активность ренина в плазме и скорость метаболического клиренса ангиотензина II у стареющих крыс без стресса. Mech Aging Dev. 1997. 97: 163–72. Проблема. [PubMed] [Google Scholar] 21.Гулд А.Б., Грин Д. Кинетика реакции человеческого ренина и человеческого субстрата. Cardiovasc Res. 1971; 5: 86–9. Проблема. [PubMed] [Google Scholar] 22. Kim HS, Krege JH, Kluckman KD, Hagaman JR, Hodgin JB, Best CF, et al. Генетический контроль артериального давления и локуса ангиотензиногена. Proc Natl Acad Sci USA. 1995; 92: 2735–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Кобори Х., Одзава Ю., Сато Р., Кацурада А., Мията К., Охаши Н. и др. Почечно-специфическое усиление ang II стимулирует эндогенный внутрипочечный ангиотензиноген у мышей, нацеленных на ген.Am J Physiol Renal Physiol. 2007; 293: F938–45. DOI: 10.1152 / ajprenal.00146.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Deschepper CF. Ангиотензиноген. Гормональная регуляция и относительное значение в генерации ангиотензина II. Kidney Int. 1994; 46: 1561–3. Проблема. [PubMed] [Google Scholar] 26. Девараджан С., Яхиро Э., Уехара Й., Хабе С., Нишияма А., Миура С. и др. Депрессорный эффект ингибитора химазы у мышей с умеренной гипертензией, вызванной высоким содержанием соли. Am J Physiol Heart Circ Physiol.2015; 309: h2987–96. DOI: 10.1152 / ajpheart.00721.2014. Проблема. [PubMed] [CrossRef] [Google Scholar] 27. Erdos EG. Фермент, преобразующий ангиотензин I, и изменения в наших представлениях с годами. Льюис К. Мемориальная лекция Даля. Гипертония. 1990; 16: 363–70. Проблема. [PubMed] [Google Scholar] 28. Джонстон CI. Тканевый ангиотензин-превращающий фермент при сердечной и сосудистой гипертрофии, восстановлении и ремоделировании. Гипертония. 1994; 23: 258–68. Проблема. [PubMed] [Google Scholar] 29. Ингерт С, Грима М, Кокард С, Бартелмебс М, Имбс Дж.Вклад интернализации ангиотензина II в уровни внутрипочечного ангиотензина II у крыс. Am J Physiol Renal Physiol. 2002; 283: F1003–10. DOI: 10.1152 / ajprenal.00322.2001. Проблема. [PubMed] [CrossRef] [Google Scholar] 30. Кобори Х., Нишияма А., Харрисон-Бернард Л. М., Навар Л. Г.. Ангиотензиноген в моче как индикатор внутрипочечного ангиотензинового статуса при артериальной гипертензии. Гипертония. 2003; 41: 42–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Кэмпбелл Д. Д., Лоуренс А. С., Таури А., Кладис А., Валентийн А. Дж..Дифференциальная регуляция уровней пептида ангиотензина в плазме и почках крысы. Гипертония. 1991; 18: 763–73. Проблема. [PubMed] [Google Scholar] 32. Komlosi P, Fuson AL, Fintha A, Peti-Peterdi J, Rosivall L, Warnock DG, et al. Превращение ангиотензина I в ангиотензин II стимулирует транспорт натрия в собирательных протоках коры головного мозга. Гипертония. 2003; 42: 195–9. DOI: 10.1161 / 01.HYP.0000081221.36703.01. Проблема. [PubMed] [CrossRef] [Google Scholar] 33. Rosivall L, Navar LG. Влияние на почечную гемодинамику внутриартериальных инфузий ангиотензинов I и II.Am J Physiol. 1983; 245: F181–7. DOI: 10.1152 / ajprenal.1983.245.2.F181. Проблема. [PubMed] [CrossRef] [Google Scholar] 34. Casarini DE, Boim MA, Stella RC, Krieger-Azzolini MH, Krieger JE, Schor N. Активность ангиотензин-превращающего фермента в канальцевой жидкости вдоль нефрона крысы. Am J Physiol. 1997; 272: F405–9. DOI: 10.1152 / ajprenal.1997.272.3.F405. Проблема. [PubMed] [CrossRef] [Google Scholar] 35. Нишияма А., Сет Д.М., Навар Л.Г. Концентрация ангиотензинов I и II в почечной интерстициальной жидкости у анестезированных крыс.Гипертония. 2002; 39: 129–34. Проблема. [PubMed] [Google Scholar] 36. Нишияма А., Сет Д.М., Навар Л.Г. Концентрации ангиотензина I и ангиотензина II в интерстициальной жидкости почек во время местного ингибирования ангиотензинпревращающего фермента. J Am Soc Nephrol. 2002; 13: 2207–12. Проблема. [PubMed] [Google Scholar] 37. Браам Б., Митчелл К.Д., Фокс Дж., Навар Л.Г. Проксимальная канальцевая секреция ангиотензина II у крыс. Am J Physiol. 1993; 264: F891–8. DOI: 10.1152 / ajprenal.1993.264.5.F891. Проблема. [PubMed] [CrossRef] [Google Scholar] 38.Seikaly MG, Arant BS, Jr, Seney FD., Jr. Концентрации эндогенного ангиотензина в определенных компартментах внутрипочечной жидкости крысы. J Clin Invest. 1990; 86: 1352–7. DOI: 10,1172 / JCI114846. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Хираньячаттада С., Харрис П.Дж. Модуляция локально продуцируемого люминального ангиотензина II реабсорбции натрия в проксимальных канальцах через рецептор AT1. Br J Pharmacol. 1996. 119: 617–8. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Куан А, Баум М.Эндогенная продукция ангиотензина II модулирует транспорт проксимальных канальцев крысы. J Clin Invest. 1996; 97: 2878–82. DOI: 10,1172 / JCI118745. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Гонсалес-Вильялобос Р.А., Сет Д.М., Сато Р., Хортон Х., Охаши Н., Мията К. и др. Интраренальное увеличение ангиотензина II и ангиотензиногена у мышей, которым вводили хронический ангиотензин II. Am J Physiol Renal Physiol. 2008; 295: F772–9. DOI: 10.1152 / ajprenal.00019.2008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42.Ли XC, Карретеро О.А., Navar LG, Zhuo JL. Опосредованное рецептором AT1 накопление внеклеточного ангиотензина II в клетках проксимальных канальцев: роль микротрубочек цитоскелета и тирозинфосфатаз. Am J Physiol Renal Physiol. 2006; 291: F375–83. DOI: 10.1152 / ajprenal.00405.2005. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Дарби И.А., Серния С. Гибридизация in situ и иммуногистохимия почечного ангиотензиногена в почках новорожденных и взрослых крыс. Cell Tissue Res. 1995; 281: 197–206.Проблема. [PubMed] [Google Scholar] 44. Камияма М., Гарнер М.К., Фаррагут К.М., Софуэ Т., Хара Т., Морикава Т. и др. Детальная локализация увеличенной мРНК ангиотензиногена и белка в проксимальных сегментах канальцев диабетических почек у крыс и людей. Int J Biol Sci. 2014; 10: 530–42. DOI: 10.7150 / ijbs.8450. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Lantelme P, Rohrwasser A, Gociman B, Hillas E, Cheng T, Petty G, et al. Влияние диетического натрия и генетического фона на ангиотензиноген и ренин у мышей.Гипертония. 2002; 39: 1007–14. Проблема. [PubMed] [Google Scholar] 46. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Повышение экспрессии ангиотензиногена при ангиотензин II-зависимой гипертензии. Гипертония. 2001; 37: 1329–35. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экспрессия мРНК ангиотензиногена и белка при ангиотензин II-зависимой гипертензии. J Am Soc Nephrol. 2001; 12: 431–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ван Дж., Шибаяма Й., Кобори Х., Лю Й., Кобара Х., Масаки Т. и др.Высокий уровень глюкозы увеличивает ангиотензиноген в клетках проксимальных канальцев почек человека за счет ядерного фактора-5 гепатоцитов. PLoS One. 2017; 12: e0185600. DOI: 10.1371 / journal.pone.0185600. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Чжан С.Л., Филеп Дж. Г., Хохман Т. К., Тан СС, Ингельфингер Дж. Р., Чан Дж. С.. Молекулярные механизмы действия глюкозы на экспрессию гена ангиотензиногена в клетках проксимальных канальцев крыс. Kidney Int. 1999; 55: 454–64. DOI: 10.1046 / j.1523-1755.1999.00271.x. Проблема. [PubMed] [CrossRef] [Google Scholar] 50.Мията К., Охаши Н., Сузаки Ю., Кацурада А., Кобори Х. Последовательная активация оси реактивных форм кислорода / ангиотензиногена / ренин-ангиотензиновой системы при повреждении почек у крыс с диабетом 2 типа. Clin Exp Pharmacol Physiol. 2008; 35: 922–7. DOI: 10.1111 / j.1440-1681.2008.04938.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Kamiyama M, Urushihara M, Morikawa T., Konishi Y, Imanishi M, Nishiyama A, et al. Оксидативный стресс / ангиотензиноген / ренин-ангиотензиновая система у пациентов с диабетической нефропатией.Int J Mol Sci. 2013; 14: 23045–62. DOI: 10.3390 / ijms141123045. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Огава С., Мацусима М., Мори Т., Окамура М., Сенда М., Сакамото Т. и др. Выявление стадий диабетической нефропатии, при которых блокаторы рецепторов ангиотензина II наиболее эффективно подавляют альбуминурию. Am J Hypertens. 2013; 26: 1064–9. DOI: 10,1093 / ajh / hpt085. Проблема. [PubMed] [CrossRef] [Google Scholar] 53. Сато Э., Мори Т., Сато М., Фудзивара М., Накамичи Ю., Оба И. и др. Экскреция ангиотензиногена с мочой связана с артериальным давлением у молодых людей с ожирением.Clin Exp Hypertens. 2016; 38: 203–8. DOI: 10.3109 / 10641963.2015.1081219. Проблема. [PubMed] [CrossRef] [Google Scholar] 54. Ихара Г., Киемото Х., Кобори Х., Нагаи Й., Охаши Н., Хитоми Х. и др. Регрессия повреждения поверхностных клубочковых подоцитов у крыс с диабетом 2 типа с явной альбуминурией: эффект блокады ангиотензина II. J Hypertens. 2010; 28: 2289–98. DOI: 10.1097 / HJH.0b013e32833dfcda. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Кониси Ю., Нишияма А., Морикава Т., Китабаяси С., Сибата М., Хамада М. и др.Связь между ангиотензиногеном мочи и солевой чувствительностью артериального давления у пациентов с нефропатией ига. Гипертония. 2011; 58: 205–11. DOI: 10.1161 / HYPERTENSIONAHA.110.166843. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Эригути М., Йотсуэда Р., Торису К., Кавай Й., Хасэгава С., Танака С. и др. Оценка ангиотензиногена мочи как маркера повреждения подоцитов при протеинурических нефропатиях. Am J Physiol Renal Physiol. 2016; 310: F322–33. DOI: 10.1152 / ajprenal.00260.2015. Вып. [PubMed] [CrossRef] [Google Scholar] 57. Охаши Н., Урушихара М., Сато Р., Кобори Х. Гломерулярный ангиотензиноген индуцируется в мезангиальных клетках диабетических крыс через пути реактивных форм кислорода — erk / jnk. Hypertens Res. 2010; 33: 1174–81. DOI: 10.1038 / ч. 2010.143. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Такамацу М., Урушихара М., Кондо С., Симидзу М., Мориока Т., Оите Т. и др. Гломерулярный белок ангиотензиногена усиливается при педиатрической нефропатии. Педиатр Нефрол.2008; 23: 1257–67. DOI: 10.1007 / s00467-008-0801-6. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Чжан С.Л., Тан СС, Чен Х, Филеп Дж. Г., Ингельфингер Дж. Р., Чан Дж. С.. Высокие уровни глюкозы стимулируют экспрессию гена ангиотензиногена через путь митоген-активируемой протеинкиназы p38 в клетках проксимальных канальцев почек крысы. Эндокринология. 2000; 141: 4637–46. DOI: 10.1210 / endo.141.12.7844. Проблема. [PubMed] [CrossRef] [Google Scholar] 60. Се Т.Дж., Чжан С.Л., Филеп Дж. Г., Тан СС, Ингельфингер-младший, Чан Дж. С..Высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена за счет генерации активных форм кислорода в клетках проксимальных канальцев почек крысы. Эндокринология. 2002. 143: 2975–85. DOI: 10.1210 / endo.143.8.8931. Проблема. [PubMed] [CrossRef] [Google Scholar] 61. Кобори Х., Нишияма А. Влияние темпола на продукцию почечного ангиотензиногена у чувствительных к соли крыс. Biochem Biophys Res Commun. 2004; 315: 746–50. DOI: 10.1016 / j.bbrc.2004.01.120. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 62. Ли Дж., Brasier AR.Активация гена ангиотензиногена ангиотензином II опосредуется фактором транскрипции rel a (ядерный фактор-каппаб p65): одним из механизмов петли положительной обратной связи ренин-ангиотензиновой системы в гепатоцитах. Мол Эндокринол. 1996. 10: 252–64. DOI: 10.1210 / исправление.10.3.8833654. Проблема. [PubMed] [CrossRef] [Google Scholar] 63. Бринкманн М.М., Гленн М., Радуга Л., Кизер А., Хенке-Гендо С., Шульц Т.Ф. Активация митоген-активируемой протеинкиназы и путей nf-каппаб мембранным белком k15 герпеса, ассоциированным с саркомой Капоши.J Virol. 2003. 77: 9346–58. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Hoffmann E, Thiefes A, Buhrow D, Dittrich-Breiholz O, Schneider H, Resch K и др. Mek1-зависимая отсроченная экспрессия fos-родственного антигена-1 противодействует c-fos и p65 nf-kappab-опосредованной транскрипции интерлейкина-8 в ответ на цитокины или факторы роста. J Biol Chem. 2005; 280: 9706–18. DOI: 10.1074 / jbc.M407071200. Проблема. [PubMed] [CrossRef] [Google Scholar] 65. Дин И, Дэвиссон Р.Л., Харди Д.О., Чжу Л.Дж., Меррилл, округ Колумбия, Кэттералл Дж.Ф. и др.Промотор белка, регулируемого андрогенами почек, обеспечивает специфичную для клеток проксимального канальца почек и высокую андроген-чувствительную экспрессию гена ангиотензиногена человека у трансгенных мышей. J Biol Chem. 1997. 272: 28142–8. Проблема. [PubMed] [Google Scholar] 66. Накано Д., Кобори Х., Берфорд Дж. Л., Геворгян Х., Зайдель С., Хитоми Х и др. Мультифотонная визуализация клубочковой проницаемости ангиотензиногена. J Am Soc Nephrol. 2012; 23: 1847–56. DOI: 10.1681 / ASN.2012010078. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Roksnoer LC, Verdonk K, van den Meiracker AH, Hoorn EJ, Zietse R, Danser AH. Мочевые маркеры активности внутрипочечной ренин-ангиотензиновой системы in vivo. Curr Hypertens Rep., 2013; 15: 81–8. DOI: 10.1007 / s11906-012-0326-z. Проблема. [PubMed] [CrossRef] [Google Scholar] 68. Zhuang Z, Bai Q, Lata A, Liang Y, Zheng D, Wang Y. Изменения концентрации ангиотензиногена в моче и его связь с белками мочи у крыс с диабетом. Int J Clin Exp Pathol. 2015; 8: 11946–56. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Сайто Т., Урушихара М., Котани Ю., Кагами С., Кобори Х. Повышенный ангиотензиноген в моче является прецедентом повышения уровня альбумина в моче у пациентов с диабетом 1 типа. Am J Med Sci. 2009; 338: 478–80. DOI: 10.1097 / MAJ.0b013e3181b90c25. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Чжуанг З., Бай Ц., Лян А.Л., Чжэн Ю., Ван ДЙ. Повышение уровня ангиотензиногена в моче предшествует развитию альбуминурии у нормотензивных пациентов с диабетом 2 типа. Int J Clin Exp Pathol. 2015; 8: 11464–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71.Солтысяк Дж., Сковронска Б., Фична П., Остальска-Новицка Д., Станкевич В., Левандовска-Стаховяк М. и др. Ангиотензиноген и натрий в моче связаны с артериальным давлением у детей с нормоальбуминурией и диабетом. Педиатр Нефрол. 2014; 29: 2373–8. DOI: 10.1007 / s00467-014-2861-0. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Кобори Х., Альпер А.Б., младший, Шенава Р., Кацурада А., Сайто Т., Охаши Н. и др. Ангиотензиноген мочи как новый биомаркер состояния внутрипочечной ренин-ангиотензиновой системы у пациентов с артериальной гипертензией.Гипертония. 2009; 53: 344–50. DOI: 10.1161 / HYPERTENSIONAHA.108.123802. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Кобори Х., Охаши Н., Кацурада А., Мията К., Сато Р., Сайто Т. и др. Ангиотензиноген мочи как потенциальный биомаркер тяжести хронических заболеваний почек. J Am Soc Hyperten. 2008; 2: 349–54. DOI: 10.1016 / j.jash.2008.04.008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. ван ден Хеувел М., Батенбург В. В., Джайнандунсинг С., Гаррелдс И. М., ван Гул Дж. М., Фелдерс Р. А. и др.Ренин в моче, но не ангиотензиноген или альдостерон, отражает активность почечной ренин-ангиотензин-альдостероновой системы и эффективность блокады ренин-ангиотензин-альдостероновой системы в почках. J Hypertens. 2011; 29: 2147–55. DOI: 10.1097 / HJH.0b013e32834bbcbf. Проблема. [PubMed] [CrossRef] [Google Scholar] 75. Мацусака Т., Ниймура Ф., Пастан I, Шинтани А., Нишияма А., Итикава И. Повреждение подоцитов усиливает фильтрацию печеночного ангиотензиногена и почечного ангиотензина II поколения. Kidney Int.2014; 85: 1068–77. DOI: 10.1038 / ki.2013.453. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Мацусака Т., Ниймура Ф., Симидзу А., Пастан I, Сайто А., Кобори Х. и др. Ангиотензиноген печени является основным источником почечного ангиотензина II. J Am Soc Nephrol. 2012; 23: 1181–9. DOI: 10.1681 / ASN.2011121159. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экскреция ангиотензиногена с мочой отражает внутрипочечную продукцию ангиотензиногена.Почки. 2002. 61: 579–85. DOI: 10.1046 / j.1523-1755.2002.00155.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Кацурада А., Хагивара Ю., Мияшита К., Сато Р., Мията К., Охаши Н. и др. Новый сэндвич-элиза для ангиотензиногена человека. Am J Physiol Renal Physiol. 2007; 293: F956–60. DOI: 10.1152 / айпренал.00090.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Нисидзима Ю., Кобори Х., Софуэ Т., Кайфу К., Мориваки К., Хара Т. и др. Важные аспекты забора мочи для измерения ангиотензиногена: время и условия хранения у здоровых людей.Tohoku J Exp Med. 2012; 228: 333–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Nishijima Y, Kobori H, Kaifu K, Mizushige T., Hara T., Nishiyama A, et al. Циркадный ритм ангиотензиногена плазмы и мочи у здоровых добровольцев и пациентов с хронической болезнью почек. J Renin Angiotensin Aldosterone Syst. 2014; 15: 505–8. DOI: 10.1177 / 1470320314557584. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 81. Кобори Х., Урушихара М, Сюй Дж. Х., Беренсон Г.С., Навар Л.Г. Ангиотензиноген в моче коррелирует с артериальным давлением у мужчин (исследование сердца) J Гипертензия.2010; 28: 1422–8. DOI: 10.1097 / HJH.0b013e3283392673. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 82. Миллс К.Т., Кобори Х., Хамм Л.Л., Альпер А.Б., Хан И.Е., Рахман М. и др. Повышенная экскреция ангиотензиногена с мочой связана с риском хронического заболевания почек. Nephrol Dial Transpl. 2012; 27: 3176–81. DOI: 10.1093 / ndt / gfs011. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Мидзусигэ Т., Кобори Х., Нисидзима Й., Яно Й., Саката К., Хаякава М. и др. Ангиотензиноген в моче может быть прогностическим маркером ренопротекторного действия алоглиптина у пациентов с диабетом 2 типа.J Diabetes Res. 2015; 2015: 517472. DOI: 10.1155 / 2015/517472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Савагути М., Араки С.И., Кобори Х., Урушихара М., Ханеда М., Коя Д. и др. Связь между уровнем ангиотензиногена в моче и прогнозом почек и сердечно-сосудистой системы у пациентов с сахарным диабетом 2 типа. J. Исследование диабета. 2012; 3: 318–24. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Кобори Х., Нишияма А., Абэ Й., Навар Л.Г. Повышение внутрипочечного ангиотензиногена у чувствительных к соли крыс на диете с высоким содержанием соли.Гипертония. 2003. 41: 592–7. DOI: 10.1161 / 01.HYP.0000056768.03657.B4. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86. Цзоу Дж, Ли Й, Ли Ф.Х., Вэй Ф.Ф., Ван Дж. Экскреция ангиотензиногена с мочой и амбулаторное артериальное давление. J Hypertens. 2012; 30: 2000–6. DOI: 10.1097 / HJH.0b013e3283576928. Проблема. [PubMed] [CrossRef] [Google Scholar] 87. Тирьяки О., Усалан С. Связь между скоростью экскреции ангиотензиногена с мочой и индексом массы левого желудочка и толщиной интимы-медиа сонной артерии у реципиентов трансплантата почки с гипертонией.Clin Transpl. 2015; 29: 351–8. DOI: 10.1111 / ctr.12521. Проблема. [PubMed] [CrossRef] [Google Scholar] 88. Рафик К., Нома Т., Фудзисава И., Исихара Ю., Араи Ю., Наби А.Х. и др. Симпатическая денервация почек подавляет повреждение подоцитов de novo и альбуминурию у крыс с аортальной регургитацией. Тираж. 2012; 125: 1402–13. DOI: 10.1161 / CIRCULATIONAHA.111.064097. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 89. Satirapoj B, Siritaweesuk N, Supasyndh O. Ангиотензиноген в моче как потенциальный биомаркер диабетической нефропатии.Clin Kidney J. 2014; 7: 354–60. DOI: 10.1093 / ckj / sfu059. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90. Курултак I, Сенгул С., Коджак С., Эрдогмус С., Калайоглу Р., Месцигил П. и др. Ангиотензиноген в моче, связанные факторы и клинические последствия у пациентов с нормотензивной аутосомно-доминантной поликистозной болезнью почек. Ren Fail. 2014; 36: 717–21. DOI: 10.3109 / 0886022X.2014.8. Проблема. [PubMed] [CrossRef] [Google Scholar] 91. Пак Х.С., Кан А.Ю., Чан Дж.Й., Ким Х., Хан М., О К.Х. и др. Повышенное соотношение ангиотензиноген / креатинин (agt / cr) в моче может быть связано со снижением функции почек у пациентов с аутосомно-доминантной поликистозной болезнью почек.BMC Nephrol. 2015; 16:86. DOI: 10.1186 / s12882-015-0075-8. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Тумлин Дж. А., Чавла Л. С. и др. Ангиотензиноген в моче и риск тяжелых аки. Clin J Am Soc Nephrol. 2013; 8: 184–93. DOI: 10.2215 / CJN.06280612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Велес Дж. К., Артур Дж. М. и др. Ангиотензиноген в моче позволяет прогнозировать неблагоприятные исходы у пациентов с острым повреждением почек в отделении интенсивной терапии.Crit Care. 2013; 17: R69. DOI: 10.1186 / cc12612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94. Китао Т., Кимата Т., Яманучи С., Като С., Цуджи С., Канеко К. Мочевые биомаркеры для скрининга почечных рубцов у детей с фебрильной инфекцией мочевыводящих путей: пилотное исследование. J Urol. 2015; 194: 766–71. DOI: 10.1016 / j.juro.2015.04.091. Проблема. [PubMed] [CrossRef] [Google Scholar] 95. Корвол П., Ламанд Н., Круз А., Селерье Дж., Гаск Дж. М.. Ингибирование ангиогенеза: новая функция ангиотензиногена и дез (ангиотензин I) ангиотензиногена.J Urol. 2003. 5: 149–54. Проблема. [PubMed] [Google Scholar]Независимая регуляция ренин-ангиотензин-альдостероновой системы в почках
Clin Exp Nephrol. Авторская рукопись; доступно в PMC 1 декабря 2018 г. 1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
Хироюки Кобори
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
Автор, ответственный за переписку.Эта статья распространяется в соответствии с условиями Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что вы укажете соответствующую ссылку. оригинальному автору (ам) и источнику, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Окончательная отредактированная версия этой статьи издателем доступна в Clin Exp Nephrol. См. другие статьи в PMC, в которых цитируется опубликованная статья. .Abstract
Ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регуляции почечной гемодинамики и функций, а также в патофизиологии гипертонии и почечной недостаточности. В почках производство ангиотензина II (Ang II) контролируется несколькими независимыми механизмами. Ang II отделен в почечной интерстициальной жидкости с гораздо более высокими концентрациями, чем те, которые присутствуют в кровотоке. Неправильная активация внутрипочечного РААС вносит важный вклад в патогенез гипертонии и почечного повреждения.Было обнаружено, что внутрипочечные уровни Ang II преимущественно регулируются ангиотензиногеном и, следовательно, ангиотензиноген в моче может быть биомаркером для внутрипочечного образования Ang II. Кроме того, недавние исследования показали, что альдостерон способствует прогрессированию почечного повреждения посредством прямого воздействия на клубочковые подоциты, мезангиальные клетки, клетки проксимальных канальцев и тубулоинтерстициальные фибробласты посредством активации локально экспрессируемых минералокортикоидных рецепторов. Таким образом, теперь выясняется, что внутрипочечный РААС регулируется независимо, и его несоответствующая активация вносит вклад в патогенез развития гипертонии и почечной недостаточности.В этой короткой обзорной статье основное внимание будет уделено независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена.
Ключевые слова: Ренин-ангиотензин-альдостероновая система (РААС), ангиотензин II (Ang II), ангиотензиноген, почки
Введение
Ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система, которая регулирует кровяное давление и баланс жидкости / электролитов [1]. Ангиотензин II (Ang II) связывается с рецептором Ang II типа 1 (AT 1 ) на гладкомышечных клетках сосудов и канальцах, что вызывает сужение сосудов и реабсорбцию натрия соответственно, что приводит к повышению артериального давления [2].Ang II также связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать продукцию альдостерона, что увеличивает реабсорбцию натрия за счет активации рецептора минералокортикоидов (MR) в дистальном отделе нефрона [3].
В настоящее время выясняется, что местная активация внутрипочечного РААС играет важную роль в патогенезе гипертонии и повреждения почечной ткани [4]. Ряд исследований показал, что прогрессирование протеинурии и повреждения почечной ткани связано с активацией внутрипочечного РААС [5–9].Также было показано, что лечение ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов Ang II AT 1 (БРА) значительно снижает протеинурию у пациентов с ХБП, независимо от изменений артериального давления [10]. Ранее мы показали, что активация внутрипочечного РААС предшествовала возникновению микроальбуминурии у крыс с диабетом 2 типа [11]. Кроме того, раннее лечение БРА уменьшало прогрессирование альбуминурии и почечного повреждения [6, 12]. Эти данные предполагают специфический вклад внутрипочечной активации РААС в патофизиологию протеинурии и почечного повреждения.
Во время лечения БРА накопление Ang II теоретически может конкурировать с БРА в сайте связывания рецептора. С другой стороны, увеличение Ang II во время лечения ARB позволяет стимулировать рецептор AT 2 [4]. Активация рецептора AT 2 связана с повышенным высвобождением оксида азота, гуанилатциклазы и тканевого брадикинина [13]. В отличие от рецептора AT 1 , рецептор AT 2 обладает свойствами, препятствующими росту, и стимулирует запрограммированную гибель клеток.Таким образом, рецептор AT 2 , по-видимому, уравновешивает эффекты рецептора AT 1 [14].
В этом обзоре мы кратко суммируем наше текущее понимание независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена. Механизмы, ответственные за повреждение почек, вызванное альдостероном, были рассмотрены ранее [1, 15, 16] и не будут подробно обсуждаться в этом обзоре.
Регуляция циркулирующих классических путей РААС ()
Краткая схема регуляции циркулирующей ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II, JG клетка юкстагломерулярная клетка, MR минералокортикоидный рецептор
Перед обсуждением регуляции внутрипочечного RAAS в плазме классической регуляцией будет RAAS. обсуждается [1, 4]. Ангиотензиноген — единственный известный субстрат для ренина, который является ферментом, ограничивающим скорость РААС. Ангиотензиноген в основном образуется клетками печени и постоянно секретируется в кровоток [17, 18], тогда как ренин высвобождается в основном из юкстагломерулярных клеток почек [4, 19] и расщепляет ангиотензиноген на N-конце с образованием ангиотензина I (Ang I ) [20].В плазме уровни ангиотензиногена намного выше, чем концентрации Ang I и Ang II более чем в 1000 раз [7]. Поскольку уровни ангиотензиногена в плазме близки к константе Михаэлиса-Ментен для ренина, уровни ангиотензиногена могут контролировать уровни Ang I в плазме [17, 21]. Действительно, было показано, что повышение уровня ангиотензиногена приводит к повышению уровня Ang II в плазме [22, 23]. Однако изменения в синтезе ангиотензиногена происходят медленно и, таким образом, менее ответственны за динамическую регуляцию плазменного Ang I [17, 24].Поэтому было высказано предположение, что изменения в активности ренина плазмы (PRA) играют доминирующую роль в определении скорости образования Ang I из огромных запасов циркулирующего ангиотензиногена в плазме [1, 25]. показаны типичные концентрации ангиотензиногена в плазме, измеренные у анестезированных крыс и выраженные в наномолях на литр, тогда как концентрации Ang I и Ang II выражены в пикомолях на литр. Как показано на фиг.1, концентрации Ang I и Ang II в плазме, по-видимому, представляют собой небольшие доли доступного ангиотензиногена, что подтверждает идею о том, что ренин является критическим фактором для определения генерации Ang II в плазме [1, 18, 25] .Ang I в плазме легко превращается в Ang II не только благодаря циркулирующему растворимому типу АПФ, но также благодаря широко распространенному присутствию АПФ на эндотелиальных клетках многих сосудистых русел, включая легкие [2, 18]. Хотя были идентифицированы другие пути образования Ang II из Ang I [26], циркулирующие уровни Ang II отражают в первую очередь последствия ферментативного каскада ренина и АПФ на ангиотензиноген и Ang I [27, 28]. Циркулирующий Ang II связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать выработку альдостерона, что увеличивает реабсорбцию натрия за счет активации MR в дистальном отделе нефрона [3].
Регуляция локальных путей РААС в почках ()
Краткая схема регуляции внутрипочечной ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II
В почках продукция Ang II контролируется независимыми множественными механизмами [4]. Все компоненты, необходимые для генерации внутрипочечного Ang II, присутствуют вдоль нефрона [2, 7]. Концентрации Ang II в тканях почек намного выше, чем можно объяснить концентрациями, доставляемыми артериальным кровотоком [4, 29].Плазма-ангиотензиноген может не проникать через клубочковую мембрану из-за своего молекулярного размера, но почки также экспрессируют ангиотензиноген [5, 30]. Однако уровни ангиотензиногена в тканях почек намного ниже, чем в плазме [4]. С другой стороны, ренин секретируется клетками юкстагломерулярного аппарата и доставляется в почечный интерстиций, который обеспечивает путь локальной генерации Ang I в почках [19]. В частности, исследования показали, что активность ренина в почечной ткани более чем в 1000 раз выше, чем PRA (пикомолярные уровни Ang I / мл плазмы / час по сравнению снаномолярные уровни Ang I / г ткани / ч) [31]. Таким образом, большое количество ренина может легко расщеплять ангиотензиноген с образованием Ang I. Кроме того, Ang I также может легко превращаться в Ang II в почках [32, 33], потому что ACE обильно экспрессируется в проксимальных и дистальных канальцах, собирательных протоках и др. и почечные эндотелиальные клетки [34]. В совокупности, в отличие от роли ренина в плазме, ангиотензиноген является критическим фактором, регулирующим продукцию Ang II в почках. С другой стороны, подробный механизм, ответственный за индуцированную Ang II продукцию альдостерона в почках, до сих пор не выяснен ().
Исследования показали компартментализацию и независимую регуляцию почечной интерстициальной и канальцевой жидкости Ang II. Концентрации Ang II в почечной интерстициальной жидкости намного выше, чем уровни в плазме [35]. Nishiyama et al. [36] показали, что почечная интерстициальная инфузия ингибиторов АПФ значительно снижает уровни Ang II в почечной интерстициальной жидкости. Эти данные указывают на то, что Ang II генерируется в почечном интерстициальном пространстве. Также было показано, что концентрация Ang II в жидкости проксимальных канальцев в 100–200 раз выше, чем в плазме [37, 38].Эти результаты предполагают, что Ang II также синтезируется в просвете проксимального канальца, по крайней мере частично [39, 40].
Помимо внутрипочечной генерации Ang II, циркулирующий Ang II интернализуется в почках через рецептор AT 1 [41]. Ли и др. [42] показали, что внутрипочечный перенос / накопление Ang II в эндосомах кортикальных канальцев почек усиливается во время развития Ang II-индуцированной гипертензии. Важно отметить, что лечение БРА блокирует интернализацию Ang II в почках.
Специфическая роль ангиотензиногена в регуляции продукции Ang II в почках
В почках мРНК и белок ангиотензиногена в основном локализованы в клетках проксимальных канальцев [43, 44]. Ангиотензиноген, продуцируемый в клетках проксимальных канальцев, по-видимому, секретируется непосредственно в просвет канальцев и почечный интерстиций в дополнение к производству своих метаболитов внутриклеточно [45]. Сообщается, что концентрация ангиотензиногена в проксимальных канальцах у анестезированных крыс находится в диапазоне 300-600 нмоль / л, что значительно превышает уровни Ang I и Ang II в канальцевой жидкости [7].Трансгенные мыши, которые системно экспрессируют человеческий ренин и человеческий ангиотензиноген только в почках, показали повышенные внутрипочечные уровни Ang II, в то время как уровни Ang II в плазме не изменились. Интересно, что у этих мышей также была увеличена экспрессия эндогенного ангиотензиногена мыши [23]. Таким образом, селективная стимуляция внутрипочечной продукции Ang II из человеческого ангиотензиногена дополнительно стимулирует экспрессию эндогенного внутрипочечного ангиотензиногена мыши. Сходным образом внутрипочечная экспрессия ангиотензиногена увеличивается у крыс с гипертензией, которым вводили Ang II [46, 47].Хронические инфузии Ang II также значительно увеличивали скорость экскреции ангиотензиногена с мочой в зависимости от времени и дозы, что было связано с повышением систолического артериального давления и уровней Ang II в почках, но не с концентрациями Ang II в плазме [30]. Кроме того, лечение БРА предотвращало индуцированное Ang II увеличение экспрессии ангиотензиногена в почках и ангиотензиногена мочи [30]. Эти данные предполагают, что продукция ангиотензиногена в почках положительно стимулируется локальным Ang II через активацию рецептора AT 1 .Дальнейшие исследования показали, что высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена в клетках проксимальных канальцев человека [48, 49]. Кроме того, в почечных тканях крыс с диабетом 2 типа [6, 11, 44, 50] и пациентов [51] экспрессия генов ангиотензиногена была значительно увеличена в почках. Таким образом, можно предположить, что во время развития диабета высокий уровень глюкозы первоначально увеличивает внутрипочечные уровни ангиотензиногена, что приводит к образованию Ang II в почках. Затем несоответствующее производство Ang II может дополнительно стимулировать локальную экспрессию ангиотензиногена и связанное с ним образование Ang II в почках.Предполагается, что такой порочный круг внутрипочечной активации РААС является критическим фактором прогрессирования диабетической нефропатии [52, 53]. Исследования также показали, что лечение БРА значительно снижает как экспрессию ангиотензиногена, так и уровни Ang II в почках [6, 10, 12, 54, 55]. Таким образом, фармакологические ренопротекторные эффекты БРА можно частично объяснить ингибированием продукции внутрипочечного ангиотензиногена и Ang II. Хотя почечный ангиотензиноген преимущественно локализуется в проксимальных канальцах [44, 46, 47], слабая экспрессия также обнаруживается в клубочках.Поскольку гломерулярный ангиотензиноген повышен в поврежденных клубочках [56–58], локальная активация RAAS в клубочках может играть роль в патофизиологии повреждения клубочков. Недавно Eriguchi et al. [56] показали, что ангиотензиноген вырабатывается в поврежденных подоцитах клубочков у нефротических крыс, индуцированных пуромицином. Эти данные предполагают потенциальный вклад генерации ангиотензиногена подоцитами в прогрессирование протеинурии.
Помимо двух факторов, Ang II и высокого уровня глюкозы, другие факторы, такие как митоген-активированные протеинкиназы (MAPK), активные формы кислорода (ROS) и ядерный фактор, усиливающий легкую каппа-цепь активированных B-клеток (NFkB ), как сообщалось, также активируют экспрессию ангиотензиногена.Zhang et al. [59] показали, что экспрессия гена ангиотензиногена стимулируется через путь киназы p38 в иммортализованных клетках проксимальных канальцев почки крысы. Hsieh et al. [60] обнаружили, что экспрессия гена ангиотензиногена активируется через ROS в клеточной линии проксимальных канальцев. Кроме того, Kobori и Nishiyama [61] представили доказательства in vivo, что АФК стимулируют экспрессию гена ангиотензиногена в почках чувствительных к соли крыс Даля, которым вводят диету с высоким содержанием соли. Наконец, экспрессия гена ангиотензиногена активируется фактором транскрипции NFkB p65 в гепатоцитах [62].Также было высказано предположение о возможной связи между активацией MAPK и путями NFkB [63, 64].
Ангиотензиноген мочи как биомаркер внутрипочечного РААС и повреждения почек
Как упоминалось ранее, ангиотензиноген плазмы не может легко проникать через клубочковую мембрану из-за своего молекулярного размера. Ding et al. [65] получили мышей со сверхэкспрессией человеческого ангиотензиногена, специфичной для почек, и обнаружили большое количество человеческого ангиотензиногена в моче, но лишь незначительные следы в системном кровотоке.Kobori et al. [30] крысам внутривенно вводили человеческий ангиотензиноген; однако циркулирующий ангиотензиноген человека в моче не обнаруживался. Дальнейшие исследования с помощью двухфотонной микроскопии визуализировали гломерулярную динамику in vivo и показали, что клубочковая фильтрация циркулирующего ангиотензиногена человека намного меньше по сравнению с альбумином у мышей, что свидетельствует об ограниченной проницаемости клубочков [66].
Поскольку ангиотензиноген является белком, можно подумать, что у субъектов с протеинурией повышенная экскреция ангиотензиногена с мочой является неспецифическим следствием повышенной экскреции белков плазмы с мочой [67, 68].Однако уровень ангиотензиногена в моче не увеличивался, хотя уровень белка в моче повышен у крыс, получавших дезоксикортикостерон ацетат, что является моделью RAAS-независимой гипертензии [30]. Кроме того, соотношение ангиотензиноген / креатинин в моче у пациентов с незначительной патологией клубочков (8,3 ± 3,7 мкг / г Cr) было таким же, как и у здоровых субъектов (10,8 ± 3,4 мкг / г Cr), даже несмотря на то, что у этих пациентов наблюдалась тяжелая протеинурия [9 ]. У пациентов с преальбуминурией и диабетом 1 типа уровни ангиотензиногена в моче были уже выше, чем у контрольных субъектов [69].Zhuang et al. [70] показали, что повышенный уровень ангиотензиногена в моче предшествует развитию альбуминурии у пациентов с диабетом 2 типа. Точно так же ангиотензиноген с мочой и экскреция натрия значительно увеличиваются у детей с нормальным альбуминурием и диабетом [71]. Эти данные предполагают, что повышенный уровень ангиотензиногена в моче у пациентов с протеинурией нельзя просто объяснить неспецифическими последствиями протеинурии.
Однако циркулирующий ангиотензиноген может фильтроваться через клубочковую мембрану при некоторых патофизиологических условиях.Действительно, несколько клинических исследований показали, что уровни ангиотензиногена в моче достоверно коррелируют с альбуминурией у пациентов с артериальной гипертензией [72] и ХБП [67, 73, 74]. Matsusaka et al. [75, 76] показали, что у мышей с тяжелым повреждением подоцитов и потерей макромолекулярной барьерной функции стенки клубочковых капилляров внутрипочечная генерация Ang II увеличивается за счет фильтрованного ангиотензиногена, происходящего из печени. Eriguchi et al. [56] показали, что во время прогрессирования повреждения подоцитов отфильтрованный ангиотензиноген обильно реабсорбируется проксимальными канальцами, что приводит к снижению генерации ангиотензиногена в проксимальных канальцах.Также было высказано предположение, что клубочковые подоциты являются важным источником ангиотензиногена мочи при этом патологическом состоянии [9]. Эти данные предполагают, что фильтрованный циркулирующий ангиотензиноген также может быть источником и / или триггером генерации внутрипочечного Ang II у субъектов с тяжелым повреждением барьера клубочковой фильтрации, что может играть важную роль в активации внутрипочечного RAAS во время прогрессирования ХБП.
Растущее количество доказательств показывает, что ангиотензиноген в моче является специфическим биомаркером состояния внутрипочечного РААС, гипертонии и почечной недостаточности.Kobori et al. [30, 77] провели эксперименты на животных и показали, что повышение уровня ангиотензиногена в моче связано с увеличением экспрессии почечного ангиотензиногена и уровня Ang II в почках. У пациентов с незначительной патологией клубочков и IgA-нефропатией соотношение ангиотензиноген / креатинин в моче сильно коррелирует с экспрессией гена ангиотензиногена в тканях почечной биопсии [9]. Эти данные показали, что ангиотензиноген мочи является полезным маркером для прогнозирования уровней ангиотензиногена в почках этих пациентов.Сэндвич-твердофазный иммуноферментный анализ (ELISA) на человеческий ангиотензиноген был разработан Katsurada et al. [78], и теперь он коммерчески доступен, что позволило легко измерить большое количество образцов с течением времени. Также было показано, что обычные условия хранения не влияют на измеренные значения ангиотензиногена мочи [79]. Кроме того, экскреция ангиотензиногена с мочой не имеет циркадного ритма [80]. Таким образом, исследования ангиотензиногена в моче получили широкое распространение в мире, и растущее количество клинических данных указывает на то, что повышенные уровни ангиотензиногена в моче коррелируют с клиническими параметрами у пациентов с артериальной гипертензией [71, 72, 81] и ХБП [55, 73, 82–84].
Kobori et al. [81] показали, что ангиотензиноген в моче значительно коррелировал с артериальным давлением у пациентов с артериальной гипертензией, которые не получали антигипертензивные препараты. Они также обнаружили, что эта корреляция была высокой у чернокожих мужчин, что позволяет предположить возможный вклад ангиотензиногена мочи в солевую гипертензию. Интересно, что Kobori et al. [85] также показали, что как экспрессия ангиотензиногена в тканях почек, так и ангиотензиноген в моче заметно увеличивались у крыс с гипертензией, чувствительных к соли Даля.Кониши и др. [55] показали, что натрий-чувствительный индекс артериального давления сильно коррелирует с ангиотензиногеном мочи у пациентов с нефропатией IgA, у которых наблюдается натрий-зависимое повышение артериального давления. Аналогичным образом Zou et al. [86] показали, что экскреция ангиотензиногена с мочой выше при большей экскреции натрия с мочой и связана как с клиническим, так и с амбулаторным артериальным давлением. Дальнейшие исследования показали, что повышение уровня ангиотензиногена в моче значительно коррелирует с уровнем натрия в моче и предшествует гипертензии у детей с нормальным альбуминурием и диабетом 1 типа [71].Эти данные позволяют предположить, что ангиотензиноген мочи является полезным биомаркером для выявления натрийзависимой гипертензии. Савагути и др. [84] показали, что ангиотензиноген в моче сильно коррелировал с частотой сердечно-сосудистых осложнений у пациентов с диабетической нефропатией 2 типа. Недавние исследования также показали, что ангиотензиноген в моче значительно коррелирует с индексом массы левого желудочка и толщиной интима-медиа у пациентов с гипертонической болезнью, перенесших трансплантацию почки [87]. Мы также показали, что уровни ангиотензиногена в моче и внутрипочечного ангиотензиногена значительно увеличиваются у крыс с аортальной регургитацией [88], что указывает на потенциальную роль внутрипочечного ангиотензиногена в патофизиологии кардио-почечного синдрома.
Несколько клинических исследований показали, что ангиотензиноген в моче значительно повышен у пациентов с ХБП, включая IgA-нефропатию [55], диабетическую нефропатию [84, 87, 89], поликистоз почек [90, 91], фокальный сегментарный гломерулосклероз [56]. У этих пациентов с ХБП уровень ангиотензиногена в моче положительно коррелирует с уровнем белка или альбумина в моче, тогда как он отрицательно коррелирует с расчетной скоростью клубочковой фильтрации. Недавние исследования также показали, что ангиотензиноген мочи является прогностическим биомаркером острого повреждения почек [92, 93] и рубцевания почек [94].Однако важно отметить, что антитела, используемые в коммерчески доступных наборах для анализа ангиотензиногена ELISA, распознают как интактный ангиотензиноген, так и ангиотензиноген des-Ang I [78]. Схематически ангиотензиноген можно рассматривать как состоящий из комбинации функции Ang I, расположенной на N-конце, и присутствия структуры серпина (ингибитора сериновой протеазы) на противоположном конце. Таким образом, необходимы дальнейшие исследования с использованием нового набора ELISA для интактного ангиотензиногена.Кобори и Нишияма недавно предположили, что соотношение между ангиотензиногеном des-Ang I и интактным ангиотензиногеном может быть стабильным маркером активности ренина (был зарегистрирован патент PCT / JP2014 / 078751). Поскольку уровни ангиотензиногена в плазме очень высоки, мы предполагаем, что острые изменения в активации ренина могут не отражать соотношение ангиотензиноген des-Ang I / интактный ангиотензиноген в плазме. Чтобы проверить эту идею, мы электрически стимулировали почечный симпатический нерв с частотой 1 Гц (5 В, 1 мс) в течение 20 минут у анестезированных крыс и собрали образцы плазмы и мочи.Все экспериментальные процедуры проводились в соответствии с руководящими принципами по уходу и использованию животных, установленными Университетом Кагава (Кагава, Япония). Наши предварительные данные показали, что активация почечного симпатического нерва значительно увеличила PRA, но не изменила соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в плазме (). Интересно, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче вскоре увеличивалось при стимуляции почечного симпатического нерва. Эти данные позволяют предположить, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче является потенциальным биомаркером активности ренина в почках.
Влияние электрической стимуляции почечного симпатического нерва с частотой 1 Гц (5 В, 1 мс) в течение 20 минут на PRA, соотношение Des-Ang I-AGT / интактный AGT в плазме и соотношение Des-Ang I-AGT / интактный AGT в моче у анестезированных крыс ( n = 12–15). PRA активность ренина плазмы, AGT ангиотензиноген, Ang I ангиотензин I. * P <0,05 по сравнению с контролем
Ангиотензиноген Des-Ang I, составляющий более 97% молекулы, по-видимому, не имеет функция.Недавно было показано, что некоторые серпины (антитромбин, маспин, фактор пигментного эпителия и каллистатин) обладают антиангиогенной активностью, что свидетельствует об общем механизме пролиферации и миграции эндотелиальных клеток. Ангиотензиноген и его продукт расщепления ренин, ангиотензиноген des-Ang I, также являются ингибиторами ангиогенеза как in vitro, так и in vivo в концентрациях в диапазоне концентраций, наблюдаемых в плазме. Это свойство, скорее всего, является следствием структурной аналогии ангиотензиногена с серпинами.Патологическое значение этой новой функции все еще не известно, но ангиотензиноген, продуцируемый глиальными клетками, может играть роль в стабилизации гематоэнцефалического барьера. Эти новые данные следует рассматривать в свете общего действия ренин-ангиотензиновой системы на ангиогенез [95].
Выводы
Внутрипочечный RAAS независимо регулируется, и его несоответствующая активация вносит свой вклад в патогенез развития гипертонии и почечной недостаточности. В этом кратком обзоре обсуждалась особая роль ангиотензиногена в регуляции внутрипочечной активности РААС.Локально экспрессируемый ангиотензиноген является основным фактором контроля внутрипочечных уровней Ang II, но фильтрованный циркулирующий ангиотензиноген также может быть источником образования внутрипочечного Ang II, если барьер клубочковой фильтрации серьезно поврежден. В любом случае ангиотензиноген мочи является полезным биомаркером для определения статуса внутрипочечного РААС, гипертензии и почечной недостаточности.
Благодарности
Финансирование Это исследование было частично поддержано Японским обществом содействия науке (JSPS) по грантам на научные исследования (KAKENHI) (26460343 Акире Нишияме и 15K08237 Хироюки Кобори).
Сноски
Соблюдение этических стандартов
Конфликт интересов Авторы заявили, что конфликта интересов не существует.
Этическое разрешение Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам учреждения или практики, в которой проводились исследования (номер одобрения Университета Кагава: # 15,031).
Ссылки
1. Нишияма А., Ким-Мицуяма С.Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: Обзор регуляции системы ренин-ангиотензин-альдостерон. J Pharmacol Sci. 2010. 113: 289–91. Проблема. [PubMed] [Google Scholar] 2. Navar LG, Inscho EW, Majid SA, Imig JD, Harrison-Bernard LM, Mitchell KD. Паракринная регуляция почечной микроциркуляции. Physiol Rev.1996; 76: 425–536. DOI: 10.1152 / Physrev.1996.76.2.425. Проблема. [PubMed] [CrossRef] [Google Scholar] 3. Нишияма А., Хитоми Х., Рахман А., Киемото Х. Открытие лекарств для преодоления хронической болезни почек (ХБП): Фармакологические эффекты блокаторов минералокортикоидных рецепторов.J Pharmacol Sci. 2009; 109: 1–6. Проблема. [PubMed] [Google Scholar] 4. Кобори Х., Нангаку М., Навар Л.Г., Нишияма А. Внутрипочечная ренин-ангиотензиновая система: от физиологии к патобиологии гипертонии и болезней почек. Pharmacol Rev.2007; 59: 251–87. DOI: 10.1124 / pr.59.3.3. Проблема. [PubMed] [CrossRef] [Google Scholar] 5. Кобори Х., Одзава Й., Сузаки Й., Прието-Карраскеро М.С., Нишияма А., Сёдзи Т. и др. Лекция молодых ученых: «Внутритрубчатый ангиотензиноген при гипертонии и заболеваниях почек»Am J Hypertens. 2006; 19: 541–50. DOI: 10.1016 / j.amjhyper.2005.11.014. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Нагаи Ю., Яо Л., Кобори Х., Мията К., Одзава Ю., Миятаке А. и др. Временная блокада ангиотензина II на преддиабетической стадии ослабляет развитие повреждения почек у крыс с диабетом 2 типа. J Am Soc Nephrol. 2005; 16: 703–11. DOI: 10.1681 / ASN.2004080649. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Навар Л.Г., Нишияма А. Внутрипочечное образование ангиотензина II.Contrib Nephrol. 2001; (135): 1–15. [PubMed] [Google Scholar] 8. Нишияма А., Кобори Х., Фукуи Т., Чжан Г.Х., Яо Л., Рахман М. и др. Роль ангиотензина II и активных форм кислорода в циклоспорин А-зависимой гипертензии. Гипертония. 2003. 42: 754–60. DOI: 10.1161 / 01.HYP.0000085195.38870.44. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Нишияма А., Кониси Ю., Охаши Н., Морикава Т., Урушихара М., Маеда И. и др. Ангиотензиноген мочи отражает активность внутрипочечной ренин-ангиотензиновой системы у пациентов с нефропатией iga.Nephrol Dial Transpl. 2011; 26: 170–7. DOI: 10.1093 / ndt / gfq371. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Fan YY, Kobori H, Nakano D, Hitomi H, Mori H, Masaki T и др. Аберрантная активация внутрипочечной ренин-ангиотензиновой системы в развивающихся почках крыс с диабетом 2 типа. Horm Metab Res. 2013; 45: 338–43. DOI: 10,1055 / с-0032-1331256. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Нишияма А., Накагава Т., Кобори Х., Нагаи Ю., Окада Н., Кониси И. и др.Строгая блокада ангиотензина предотвращает увеличение внутрипочечного ангиотензина II и аномалии подоцитов у крыс с диабетом 2 типа с микроальбуминурией. J Hypertens. 2008; 26: 1849–59. DOI: 10.1097 / HJH.0b013e3283060efa. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13. Сираджи Х.М., Кэри РМ. Защитная роль рецептора ангиотензина AT2 в модели почечной гипертензии. Гипертония. 1999; 33: 1237–42. Проблема. [PubMed] [Google Scholar] 14. Навар Л.Г., Митчелл К.Д., Харрисон-Бернард Л.М., Кобори Х., Нишияма А.Рассмотрение. Уровни внутрипочечного ангиотензина II в норме и при гипертонии. J Renin Angiotensin Aldosterone Syst. 2001; 2: S176 – S84. DOI: 10.1177 / 14703203010020013001. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Нишияма А., Хасегава К., Диах С., Хитоми Х. Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: блокаторы минералокортикоидных рецепторов оказывают антигипертензивное и ренопротекторное действие независимо от системы ренин-ангиотензин. J Pharmacol Sci. 2010; 113: 310–4.Проблема. [PubMed] [Google Scholar] 16. Рафик К., Хитоми Х, Накано Д., Нишияма А. Патофизиологические роли альдостерона и рецептора минералокортикоидов в почках. J Pharmacol Sci. 2011; 115: 1–7. Проблема. [PubMed] [Google Scholar] 17. Brasier AR, Li J. Механизмы индуцируемого контроля транскрипции гена ангиотензиногена. Гипертония. 1996; 27: 465–75. Проблема. [PubMed] [Google Scholar] 18. Пол М., Поян Мехр А., Кройц Р. Физиология местных ренин-ангиотензиновых систем. Physiol Rev.2006; 86: 747–803. DOI: 10.1152 / Physrev.00036.2005. Проблема. [PubMed] [CrossRef] [Google Scholar] 19. Hackenthal E, Paul M, Ganten D, Taugner R. Морфология, физиология и молекулярная биология секреции ренина. Physiol Rev.1990; 70: 1067–116. DOI: 10.1152 / Physrev.1990.70.4.1067. Проблема. [PubMed] [CrossRef] [Google Scholar] 20. Бейлис К., Энгельс К., Химел А., Навар Л.Г. Активность ренина в плазме и скорость метаболического клиренса ангиотензина II у стареющих крыс без стресса. Mech Aging Dev. 1997. 97: 163–72. Проблема. [PubMed] [Google Scholar] 21.Гулд А.Б., Грин Д. Кинетика реакции человеческого ренина и человеческого субстрата. Cardiovasc Res. 1971; 5: 86–9. Проблема. [PubMed] [Google Scholar] 22. Kim HS, Krege JH, Kluckman KD, Hagaman JR, Hodgin JB, Best CF, et al. Генетический контроль артериального давления и локуса ангиотензиногена. Proc Natl Acad Sci USA. 1995; 92: 2735–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Кобори Х., Одзава Ю., Сато Р., Кацурада А., Мията К., Охаши Н. и др. Почечно-специфическое усиление ang II стимулирует эндогенный внутрипочечный ангиотензиноген у мышей, нацеленных на ген.Am J Physiol Renal Physiol. 2007; 293: F938–45. DOI: 10.1152 / ajprenal.00146.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Deschepper CF. Ангиотензиноген. Гормональная регуляция и относительное значение в генерации ангиотензина II. Kidney Int. 1994; 46: 1561–3. Проблема. [PubMed] [Google Scholar] 26. Девараджан С., Яхиро Э., Уехара Й., Хабе С., Нишияма А., Миура С. и др. Депрессорный эффект ингибитора химазы у мышей с умеренной гипертензией, вызванной высоким содержанием соли. Am J Physiol Heart Circ Physiol.2015; 309: h2987–96. DOI: 10.1152 / ajpheart.00721.2014. Проблема. [PubMed] [CrossRef] [Google Scholar] 27. Erdos EG. Фермент, преобразующий ангиотензин I, и изменения в наших представлениях с годами. Льюис К. Мемориальная лекция Даля. Гипертония. 1990; 16: 363–70. Проблема. [PubMed] [Google Scholar] 28. Джонстон CI. Тканевый ангиотензин-превращающий фермент при сердечной и сосудистой гипертрофии, восстановлении и ремоделировании. Гипертония. 1994; 23: 258–68. Проблема. [PubMed] [Google Scholar] 29. Ингерт С, Грима М, Кокард С, Бартелмебс М, Имбс Дж.Вклад интернализации ангиотензина II в уровни внутрипочечного ангиотензина II у крыс. Am J Physiol Renal Physiol. 2002; 283: F1003–10. DOI: 10.1152 / ajprenal.00322.2001. Проблема. [PubMed] [CrossRef] [Google Scholar] 30. Кобори Х., Нишияма А., Харрисон-Бернард Л. М., Навар Л. Г.. Ангиотензиноген в моче как индикатор внутрипочечного ангиотензинового статуса при артериальной гипертензии. Гипертония. 2003; 41: 42–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Кэмпбелл Д. Д., Лоуренс А. С., Таури А., Кладис А., Валентийн А. Дж..Дифференциальная регуляция уровней пептида ангиотензина в плазме и почках крысы. Гипертония. 1991; 18: 763–73. Проблема. [PubMed] [Google Scholar] 32. Komlosi P, Fuson AL, Fintha A, Peti-Peterdi J, Rosivall L, Warnock DG, et al. Превращение ангиотензина I в ангиотензин II стимулирует транспорт натрия в собирательных протоках коры головного мозга. Гипертония. 2003; 42: 195–9. DOI: 10.1161 / 01.HYP.0000081221.36703.01. Проблема. [PubMed] [CrossRef] [Google Scholar] 33. Rosivall L, Navar LG. Влияние на почечную гемодинамику внутриартериальных инфузий ангиотензинов I и II.Am J Physiol. 1983; 245: F181–7. DOI: 10.1152 / ajprenal.1983.245.2.F181. Проблема. [PubMed] [CrossRef] [Google Scholar] 34. Casarini DE, Boim MA, Stella RC, Krieger-Azzolini MH, Krieger JE, Schor N. Активность ангиотензин-превращающего фермента в канальцевой жидкости вдоль нефрона крысы. Am J Physiol. 1997; 272: F405–9. DOI: 10.1152 / ajprenal.1997.272.3.F405. Проблема. [PubMed] [CrossRef] [Google Scholar] 35. Нишияма А., Сет Д.М., Навар Л.Г. Концентрация ангиотензинов I и II в почечной интерстициальной жидкости у анестезированных крыс.Гипертония. 2002; 39: 129–34. Проблема. [PubMed] [Google Scholar] 36. Нишияма А., Сет Д.М., Навар Л.Г. Концентрации ангиотензина I и ангиотензина II в интерстициальной жидкости почек во время местного ингибирования ангиотензинпревращающего фермента. J Am Soc Nephrol. 2002; 13: 2207–12. Проблема. [PubMed] [Google Scholar] 37. Браам Б., Митчелл К.Д., Фокс Дж., Навар Л.Г. Проксимальная канальцевая секреция ангиотензина II у крыс. Am J Physiol. 1993; 264: F891–8. DOI: 10.1152 / ajprenal.1993.264.5.F891. Проблема. [PubMed] [CrossRef] [Google Scholar] 38.Seikaly MG, Arant BS, Jr, Seney FD., Jr. Концентрации эндогенного ангиотензина в определенных компартментах внутрипочечной жидкости крысы. J Clin Invest. 1990; 86: 1352–7. DOI: 10,1172 / JCI114846. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Хираньячаттада С., Харрис П.Дж. Модуляция локально продуцируемого люминального ангиотензина II реабсорбции натрия в проксимальных канальцах через рецептор AT1. Br J Pharmacol. 1996. 119: 617–8. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Куан А, Баум М.Эндогенная продукция ангиотензина II модулирует транспорт проксимальных канальцев крысы. J Clin Invest. 1996; 97: 2878–82. DOI: 10,1172 / JCI118745. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Гонсалес-Вильялобос Р.А., Сет Д.М., Сато Р., Хортон Х., Охаши Н., Мията К. и др. Интраренальное увеличение ангиотензина II и ангиотензиногена у мышей, которым вводили хронический ангиотензин II. Am J Physiol Renal Physiol. 2008; 295: F772–9. DOI: 10.1152 / ajprenal.00019.2008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42.Ли XC, Карретеро О.А., Navar LG, Zhuo JL. Опосредованное рецептором AT1 накопление внеклеточного ангиотензина II в клетках проксимальных канальцев: роль микротрубочек цитоскелета и тирозинфосфатаз. Am J Physiol Renal Physiol. 2006; 291: F375–83. DOI: 10.1152 / ajprenal.00405.2005. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Дарби И.А., Серния С. Гибридизация in situ и иммуногистохимия почечного ангиотензиногена в почках новорожденных и взрослых крыс. Cell Tissue Res. 1995; 281: 197–206.Проблема. [PubMed] [Google Scholar] 44. Камияма М., Гарнер М.К., Фаррагут К.М., Софуэ Т., Хара Т., Морикава Т. и др. Детальная локализация увеличенной мРНК ангиотензиногена и белка в проксимальных сегментах канальцев диабетических почек у крыс и людей. Int J Biol Sci. 2014; 10: 530–42. DOI: 10.7150 / ijbs.8450. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Lantelme P, Rohrwasser A, Gociman B, Hillas E, Cheng T, Petty G, et al. Влияние диетического натрия и генетического фона на ангиотензиноген и ренин у мышей.Гипертония. 2002; 39: 1007–14. Проблема. [PubMed] [Google Scholar] 46. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Повышение экспрессии ангиотензиногена при ангиотензин II-зависимой гипертензии. Гипертония. 2001; 37: 1329–35. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экспрессия мРНК ангиотензиногена и белка при ангиотензин II-зависимой гипертензии. J Am Soc Nephrol. 2001; 12: 431–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ван Дж., Шибаяма Й., Кобори Х., Лю Й., Кобара Х., Масаки Т. и др.Высокий уровень глюкозы увеличивает ангиотензиноген в клетках проксимальных канальцев почек человека за счет ядерного фактора-5 гепатоцитов. PLoS One. 2017; 12: e0185600. DOI: 10.1371 / journal.pone.0185600. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Чжан С.Л., Филеп Дж. Г., Хохман Т. К., Тан СС, Ингельфингер Дж. Р., Чан Дж. С.. Молекулярные механизмы действия глюкозы на экспрессию гена ангиотензиногена в клетках проксимальных канальцев крыс. Kidney Int. 1999; 55: 454–64. DOI: 10.1046 / j.1523-1755.1999.00271.x. Проблема. [PubMed] [CrossRef] [Google Scholar] 50.Мията К., Охаши Н., Сузаки Ю., Кацурада А., Кобори Х. Последовательная активация оси реактивных форм кислорода / ангиотензиногена / ренин-ангиотензиновой системы при повреждении почек у крыс с диабетом 2 типа. Clin Exp Pharmacol Physiol. 2008; 35: 922–7. DOI: 10.1111 / j.1440-1681.2008.04938.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Kamiyama M, Urushihara M, Morikawa T., Konishi Y, Imanishi M, Nishiyama A, et al. Оксидативный стресс / ангиотензиноген / ренин-ангиотензиновая система у пациентов с диабетической нефропатией.Int J Mol Sci. 2013; 14: 23045–62. DOI: 10.3390 / ijms141123045. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Огава С., Мацусима М., Мори Т., Окамура М., Сенда М., Сакамото Т. и др. Выявление стадий диабетической нефропатии, при которых блокаторы рецепторов ангиотензина II наиболее эффективно подавляют альбуминурию. Am J Hypertens. 2013; 26: 1064–9. DOI: 10,1093 / ajh / hpt085. Проблема. [PubMed] [CrossRef] [Google Scholar] 53. Сато Э., Мори Т., Сато М., Фудзивара М., Накамичи Ю., Оба И. и др. Экскреция ангиотензиногена с мочой связана с артериальным давлением у молодых людей с ожирением.Clin Exp Hypertens. 2016; 38: 203–8. DOI: 10.3109 / 10641963.2015.1081219. Проблема. [PubMed] [CrossRef] [Google Scholar] 54. Ихара Г., Киемото Х., Кобори Х., Нагаи Й., Охаши Н., Хитоми Х. и др. Регрессия повреждения поверхностных клубочковых подоцитов у крыс с диабетом 2 типа с явной альбуминурией: эффект блокады ангиотензина II. J Hypertens. 2010; 28: 2289–98. DOI: 10.1097 / HJH.0b013e32833dfcda. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Кониси Ю., Нишияма А., Морикава Т., Китабаяси С., Сибата М., Хамада М. и др.Связь между ангиотензиногеном мочи и солевой чувствительностью артериального давления у пациентов с нефропатией ига. Гипертония. 2011; 58: 205–11. DOI: 10.1161 / HYPERTENSIONAHA.110.166843. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Эригути М., Йотсуэда Р., Торису К., Кавай Й., Хасэгава С., Танака С. и др. Оценка ангиотензиногена мочи как маркера повреждения подоцитов при протеинурических нефропатиях. Am J Physiol Renal Physiol. 2016; 310: F322–33. DOI: 10.1152 / ajprenal.00260.2015. Вып. [PubMed] [CrossRef] [Google Scholar] 57. Охаши Н., Урушихара М., Сато Р., Кобори Х. Гломерулярный ангиотензиноген индуцируется в мезангиальных клетках диабетических крыс через пути реактивных форм кислорода — erk / jnk. Hypertens Res. 2010; 33: 1174–81. DOI: 10.1038 / ч. 2010.143. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Такамацу М., Урушихара М., Кондо С., Симидзу М., Мориока Т., Оите Т. и др. Гломерулярный белок ангиотензиногена усиливается при педиатрической нефропатии. Педиатр Нефрол.2008; 23: 1257–67. DOI: 10.1007 / s00467-008-0801-6. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Чжан С.Л., Тан СС, Чен Х, Филеп Дж. Г., Ингельфингер Дж. Р., Чан Дж. С.. Высокие уровни глюкозы стимулируют экспрессию гена ангиотензиногена через путь митоген-активируемой протеинкиназы p38 в клетках проксимальных канальцев почек крысы. Эндокринология. 2000; 141: 4637–46. DOI: 10.1210 / endo.141.12.7844. Проблема. [PubMed] [CrossRef] [Google Scholar] 60. Се Т.Дж., Чжан С.Л., Филеп Дж. Г., Тан СС, Ингельфингер-младший, Чан Дж. С..Высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена за счет генерации активных форм кислорода в клетках проксимальных канальцев почек крысы. Эндокринология. 2002. 143: 2975–85. DOI: 10.1210 / endo.143.8.8931. Проблема. [PubMed] [CrossRef] [Google Scholar] 61. Кобори Х., Нишияма А. Влияние темпола на продукцию почечного ангиотензиногена у чувствительных к соли крыс. Biochem Biophys Res Commun. 2004; 315: 746–50. DOI: 10.1016 / j.bbrc.2004.01.120. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 62. Ли Дж., Brasier AR.Активация гена ангиотензиногена ангиотензином II опосредуется фактором транскрипции rel a (ядерный фактор-каппаб p65): одним из механизмов петли положительной обратной связи ренин-ангиотензиновой системы в гепатоцитах. Мол Эндокринол. 1996. 10: 252–64. DOI: 10.1210 / исправление.10.3.8833654. Проблема. [PubMed] [CrossRef] [Google Scholar] 63. Бринкманн М.М., Гленн М., Радуга Л., Кизер А., Хенке-Гендо С., Шульц Т.Ф. Активация митоген-активируемой протеинкиназы и путей nf-каппаб мембранным белком k15 герпеса, ассоциированным с саркомой Капоши.J Virol. 2003. 77: 9346–58. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Hoffmann E, Thiefes A, Buhrow D, Dittrich-Breiholz O, Schneider H, Resch K и др. Mek1-зависимая отсроченная экспрессия fos-родственного антигена-1 противодействует c-fos и p65 nf-kappab-опосредованной транскрипции интерлейкина-8 в ответ на цитокины или факторы роста. J Biol Chem. 2005; 280: 9706–18. DOI: 10.1074 / jbc.M407071200. Проблема. [PubMed] [CrossRef] [Google Scholar] 65. Дин И, Дэвиссон Р.Л., Харди Д.О., Чжу Л.Дж., Меррилл, округ Колумбия, Кэттералл Дж.Ф. и др.Промотор белка, регулируемого андрогенами почек, обеспечивает специфичную для клеток проксимального канальца почек и высокую андроген-чувствительную экспрессию гена ангиотензиногена человека у трансгенных мышей. J Biol Chem. 1997. 272: 28142–8. Проблема. [PubMed] [Google Scholar] 66. Накано Д., Кобори Х., Берфорд Дж. Л., Геворгян Х., Зайдель С., Хитоми Х и др. Мультифотонная визуализация клубочковой проницаемости ангиотензиногена. J Am Soc Nephrol. 2012; 23: 1847–56. DOI: 10.1681 / ASN.2012010078. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Roksnoer LC, Verdonk K, van den Meiracker AH, Hoorn EJ, Zietse R, Danser AH. Мочевые маркеры активности внутрипочечной ренин-ангиотензиновой системы in vivo. Curr Hypertens Rep., 2013; 15: 81–8. DOI: 10.1007 / s11906-012-0326-z. Проблема. [PubMed] [CrossRef] [Google Scholar] 68. Zhuang Z, Bai Q, Lata A, Liang Y, Zheng D, Wang Y. Изменения концентрации ангиотензиногена в моче и его связь с белками мочи у крыс с диабетом. Int J Clin Exp Pathol. 2015; 8: 11946–56. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Сайто Т., Урушихара М., Котани Ю., Кагами С., Кобори Х. Повышенный ангиотензиноген в моче является прецедентом повышения уровня альбумина в моче у пациентов с диабетом 1 типа. Am J Med Sci. 2009; 338: 478–80. DOI: 10.1097 / MAJ.0b013e3181b90c25. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Чжуанг З., Бай Ц., Лян А.Л., Чжэн Ю., Ван ДЙ. Повышение уровня ангиотензиногена в моче предшествует развитию альбуминурии у нормотензивных пациентов с диабетом 2 типа. Int J Clin Exp Pathol. 2015; 8: 11464–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71.Солтысяк Дж., Сковронска Б., Фична П., Остальска-Новицка Д., Станкевич В., Левандовска-Стаховяк М. и др. Ангиотензиноген и натрий в моче связаны с артериальным давлением у детей с нормоальбуминурией и диабетом. Педиатр Нефрол. 2014; 29: 2373–8. DOI: 10.1007 / s00467-014-2861-0. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Кобори Х., Альпер А.Б., младший, Шенава Р., Кацурада А., Сайто Т., Охаши Н. и др. Ангиотензиноген мочи как новый биомаркер состояния внутрипочечной ренин-ангиотензиновой системы у пациентов с артериальной гипертензией.Гипертония. 2009; 53: 344–50. DOI: 10.1161 / HYPERTENSIONAHA.108.123802. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Кобори Х., Охаши Н., Кацурада А., Мията К., Сато Р., Сайто Т. и др. Ангиотензиноген мочи как потенциальный биомаркер тяжести хронических заболеваний почек. J Am Soc Hyperten. 2008; 2: 349–54. DOI: 10.1016 / j.jash.2008.04.008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. ван ден Хеувел М., Батенбург В. В., Джайнандунсинг С., Гаррелдс И. М., ван Гул Дж. М., Фелдерс Р. А. и др.Ренин в моче, но не ангиотензиноген или альдостерон, отражает активность почечной ренин-ангиотензин-альдостероновой системы и эффективность блокады ренин-ангиотензин-альдостероновой системы в почках. J Hypertens. 2011; 29: 2147–55. DOI: 10.1097 / HJH.0b013e32834bbcbf. Проблема. [PubMed] [CrossRef] [Google Scholar] 75. Мацусака Т., Ниймура Ф., Пастан I, Шинтани А., Нишияма А., Итикава И. Повреждение подоцитов усиливает фильтрацию печеночного ангиотензиногена и почечного ангиотензина II поколения. Kidney Int.2014; 85: 1068–77. DOI: 10.1038 / ki.2013.453. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Мацусака Т., Ниймура Ф., Симидзу А., Пастан I, Сайто А., Кобори Х. и др. Ангиотензиноген печени является основным источником почечного ангиотензина II. J Am Soc Nephrol. 2012; 23: 1181–9. DOI: 10.1681 / ASN.2011121159. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экскреция ангиотензиногена с мочой отражает внутрипочечную продукцию ангиотензиногена.Почки. 2002. 61: 579–85. DOI: 10.1046 / j.1523-1755.2002.00155.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Кацурада А., Хагивара Ю., Мияшита К., Сато Р., Мията К., Охаши Н. и др. Новый сэндвич-элиза для ангиотензиногена человека. Am J Physiol Renal Physiol. 2007; 293: F956–60. DOI: 10.1152 / айпренал.00090.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Нисидзима Ю., Кобори Х., Софуэ Т., Кайфу К., Мориваки К., Хара Т. и др. Важные аспекты забора мочи для измерения ангиотензиногена: время и условия хранения у здоровых людей.Tohoku J Exp Med. 2012; 228: 333–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Nishijima Y, Kobori H, Kaifu K, Mizushige T., Hara T., Nishiyama A, et al. Циркадный ритм ангиотензиногена плазмы и мочи у здоровых добровольцев и пациентов с хронической болезнью почек. J Renin Angiotensin Aldosterone Syst. 2014; 15: 505–8. DOI: 10.1177 / 1470320314557584. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 81. Кобори Х., Урушихара М, Сюй Дж. Х., Беренсон Г.С., Навар Л.Г. Ангиотензиноген в моче коррелирует с артериальным давлением у мужчин (исследование сердца) J Гипертензия.2010; 28: 1422–8. DOI: 10.1097 / HJH.0b013e3283392673. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 82. Миллс К.Т., Кобори Х., Хамм Л.Л., Альпер А.Б., Хан И.Е., Рахман М. и др. Повышенная экскреция ангиотензиногена с мочой связана с риском хронического заболевания почек. Nephrol Dial Transpl. 2012; 27: 3176–81. DOI: 10.1093 / ndt / gfs011. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Мидзусигэ Т., Кобори Х., Нисидзима Й., Яно Й., Саката К., Хаякава М. и др. Ангиотензиноген в моче может быть прогностическим маркером ренопротекторного действия алоглиптина у пациентов с диабетом 2 типа.J Diabetes Res. 2015; 2015: 517472. DOI: 10.1155 / 2015/517472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Савагути М., Араки С.И., Кобори Х., Урушихара М., Ханеда М., Коя Д. и др. Связь между уровнем ангиотензиногена в моче и прогнозом почек и сердечно-сосудистой системы у пациентов с сахарным диабетом 2 типа. J. Исследование диабета. 2012; 3: 318–24. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Кобори Х., Нишияма А., Абэ Й., Навар Л.Г. Повышение внутрипочечного ангиотензиногена у чувствительных к соли крыс на диете с высоким содержанием соли.Гипертония. 2003. 41: 592–7. DOI: 10.1161 / 01.HYP.0000056768.03657.B4. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86. Цзоу Дж, Ли Й, Ли Ф.Х., Вэй Ф.Ф., Ван Дж. Экскреция ангиотензиногена с мочой и амбулаторное артериальное давление. J Hypertens. 2012; 30: 2000–6. DOI: 10.1097 / HJH.0b013e3283576928. Проблема. [PubMed] [CrossRef] [Google Scholar] 87. Тирьяки О., Усалан С. Связь между скоростью экскреции ангиотензиногена с мочой и индексом массы левого желудочка и толщиной интимы-медиа сонной артерии у реципиентов трансплантата почки с гипертонией.Clin Transpl. 2015; 29: 351–8. DOI: 10.1111 / ctr.12521. Проблема. [PubMed] [CrossRef] [Google Scholar] 88. Рафик К., Нома Т., Фудзисава И., Исихара Ю., Араи Ю., Наби А.Х. и др. Симпатическая денервация почек подавляет повреждение подоцитов de novo и альбуминурию у крыс с аортальной регургитацией. Тираж. 2012; 125: 1402–13. DOI: 10.1161 / CIRCULATIONAHA.111.064097. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 89. Satirapoj B, Siritaweesuk N, Supasyndh O. Ангиотензиноген в моче как потенциальный биомаркер диабетической нефропатии.Clin Kidney J. 2014; 7: 354–60. DOI: 10.1093 / ckj / sfu059. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90. Курултак I, Сенгул С., Коджак С., Эрдогмус С., Калайоглу Р., Месцигил П. и др. Ангиотензиноген в моче, связанные факторы и клинические последствия у пациентов с нормотензивной аутосомно-доминантной поликистозной болезнью почек. Ren Fail. 2014; 36: 717–21. DOI: 10.3109 / 0886022X.2014.8. Проблема. [PubMed] [CrossRef] [Google Scholar] 91. Пак Х.С., Кан А.Ю., Чан Дж.Й., Ким Х., Хан М., О К.Х. и др. Повышенное соотношение ангиотензиноген / креатинин (agt / cr) в моче может быть связано со снижением функции почек у пациентов с аутосомно-доминантной поликистозной болезнью почек.BMC Nephrol. 2015; 16:86. DOI: 10.1186 / s12882-015-0075-8. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Тумлин Дж. А., Чавла Л. С. и др. Ангиотензиноген в моче и риск тяжелых аки. Clin J Am Soc Nephrol. 2013; 8: 184–93. DOI: 10.2215 / CJN.06280612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Велес Дж. К., Артур Дж. М. и др. Ангиотензиноген в моче позволяет прогнозировать неблагоприятные исходы у пациентов с острым повреждением почек в отделении интенсивной терапии.Crit Care. 2013; 17: R69. DOI: 10.1186 / cc12612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94. Китао Т., Кимата Т., Яманучи С., Като С., Цуджи С., Канеко К. Мочевые биомаркеры для скрининга почечных рубцов у детей с фебрильной инфекцией мочевыводящих путей: пилотное исследование. J Urol. 2015; 194: 766–71. DOI: 10.1016 / j.juro.2015.04.091. Проблема. [PubMed] [CrossRef] [Google Scholar] 95. Корвол П., Ламанд Н., Круз А., Селерье Дж., Гаск Дж. М.. Ингибирование ангиогенеза: новая функция ангиотензиногена и дез (ангиотензин I) ангиотензиногена.J Urol. 2003. 5: 149–54. Проблема. [PubMed] [Google Scholar]Независимая регуляция ренин-ангиотензин-альдостероновой системы в почках
Clin Exp Nephrol. Авторская рукопись; доступно в PMC 1 декабря 2018 г. 1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
Хироюки Кобори
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
1 Кафедра фармакологии медицинского факультета Университета Кагава, 1750-1 Мики-тё, Кита-гун, Кагава 761-0793, Япония
2 Кафедры фармакологии и нефрологии, Медицинский факультет, Международный университет здоровья и социального обеспечения, Нарита, Япония
Автор, ответственный за переписку.Эта статья распространяется в соответствии с условиями Международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что вы укажете соответствующую ссылку. оригинальному автору (ам) и источнику, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Окончательная отредактированная версия этой статьи издателем доступна в Clin Exp Nephrol. См. другие статьи в PMC, в которых цитируется опубликованная статья. .Abstract
Ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регуляции почечной гемодинамики и функций, а также в патофизиологии гипертонии и почечной недостаточности. В почках производство ангиотензина II (Ang II) контролируется несколькими независимыми механизмами. Ang II отделен в почечной интерстициальной жидкости с гораздо более высокими концентрациями, чем те, которые присутствуют в кровотоке. Неправильная активация внутрипочечного РААС вносит важный вклад в патогенез гипертонии и почечного повреждения.Было обнаружено, что внутрипочечные уровни Ang II преимущественно регулируются ангиотензиногеном и, следовательно, ангиотензиноген в моче может быть биомаркером для внутрипочечного образования Ang II. Кроме того, недавние исследования показали, что альдостерон способствует прогрессированию почечного повреждения посредством прямого воздействия на клубочковые подоциты, мезангиальные клетки, клетки проксимальных канальцев и тубулоинтерстициальные фибробласты посредством активации локально экспрессируемых минералокортикоидных рецепторов. Таким образом, теперь выясняется, что внутрипочечный РААС регулируется независимо, и его несоответствующая активация вносит вклад в патогенез развития гипертонии и почечной недостаточности.В этой короткой обзорной статье основное внимание будет уделено независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена.
Ключевые слова: Ренин-ангиотензин-альдостероновая система (РААС), ангиотензин II (Ang II), ангиотензиноген, почки
Введение
Ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система, которая регулирует кровяное давление и баланс жидкости / электролитов [1]. Ангиотензин II (Ang II) связывается с рецептором Ang II типа 1 (AT 1 ) на гладкомышечных клетках сосудов и канальцах, что вызывает сужение сосудов и реабсорбцию натрия соответственно, что приводит к повышению артериального давления [2].Ang II также связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать продукцию альдостерона, что увеличивает реабсорбцию натрия за счет активации рецептора минералокортикоидов (MR) в дистальном отделе нефрона [3].
В настоящее время выясняется, что местная активация внутрипочечного РААС играет важную роль в патогенезе гипертонии и повреждения почечной ткани [4]. Ряд исследований показал, что прогрессирование протеинурии и повреждения почечной ткани связано с активацией внутрипочечного РААС [5–9].Также было показано, что лечение ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов Ang II AT 1 (БРА) значительно снижает протеинурию у пациентов с ХБП, независимо от изменений артериального давления [10]. Ранее мы показали, что активация внутрипочечного РААС предшествовала возникновению микроальбуминурии у крыс с диабетом 2 типа [11]. Кроме того, раннее лечение БРА уменьшало прогрессирование альбуминурии и почечного повреждения [6, 12]. Эти данные предполагают специфический вклад внутрипочечной активации РААС в патофизиологию протеинурии и почечного повреждения.
Во время лечения БРА накопление Ang II теоретически может конкурировать с БРА в сайте связывания рецептора. С другой стороны, увеличение Ang II во время лечения ARB позволяет стимулировать рецептор AT 2 [4]. Активация рецептора AT 2 связана с повышенным высвобождением оксида азота, гуанилатциклазы и тканевого брадикинина [13]. В отличие от рецептора AT 1 , рецептор AT 2 обладает свойствами, препятствующими росту, и стимулирует запрограммированную гибель клеток.Таким образом, рецептор AT 2 , по-видимому, уравновешивает эффекты рецептора AT 1 [14].
В этом обзоре мы кратко суммируем наше текущее понимание независимой регуляции внутрипочечного РААС с акцентом на особую роль ангиотензиногена. Механизмы, ответственные за повреждение почек, вызванное альдостероном, были рассмотрены ранее [1, 15, 16] и не будут подробно обсуждаться в этом обзоре.
Регуляция циркулирующих классических путей РААС ()
Краткая схема регуляции циркулирующей ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II, JG клетка юкстагломерулярная клетка, MR минералокортикоидный рецептор
Перед обсуждением регуляции внутрипочечного RAAS в плазме классической регуляцией будет RAAS. обсуждается [1, 4]. Ангиотензиноген — единственный известный субстрат для ренина, который является ферментом, ограничивающим скорость РААС. Ангиотензиноген в основном образуется клетками печени и постоянно секретируется в кровоток [17, 18], тогда как ренин высвобождается в основном из юкстагломерулярных клеток почек [4, 19] и расщепляет ангиотензиноген на N-конце с образованием ангиотензина I (Ang I ) [20].В плазме уровни ангиотензиногена намного выше, чем концентрации Ang I и Ang II более чем в 1000 раз [7]. Поскольку уровни ангиотензиногена в плазме близки к константе Михаэлиса-Ментен для ренина, уровни ангиотензиногена могут контролировать уровни Ang I в плазме [17, 21]. Действительно, было показано, что повышение уровня ангиотензиногена приводит к повышению уровня Ang II в плазме [22, 23]. Однако изменения в синтезе ангиотензиногена происходят медленно и, таким образом, менее ответственны за динамическую регуляцию плазменного Ang I [17, 24].Поэтому было высказано предположение, что изменения в активности ренина плазмы (PRA) играют доминирующую роль в определении скорости образования Ang I из огромных запасов циркулирующего ангиотензиногена в плазме [1, 25]. показаны типичные концентрации ангиотензиногена в плазме, измеренные у анестезированных крыс и выраженные в наномолях на литр, тогда как концентрации Ang I и Ang II выражены в пикомолях на литр. Как показано на фиг.1, концентрации Ang I и Ang II в плазме, по-видимому, представляют собой небольшие доли доступного ангиотензиногена, что подтверждает идею о том, что ренин является критическим фактором для определения генерации Ang II в плазме [1, 18, 25] .Ang I в плазме легко превращается в Ang II не только благодаря циркулирующему растворимому типу АПФ, но также благодаря широко распространенному присутствию АПФ на эндотелиальных клетках многих сосудистых русел, включая легкие [2, 18]. Хотя были идентифицированы другие пути образования Ang II из Ang I [26], циркулирующие уровни Ang II отражают в первую очередь последствия ферментативного каскада ренина и АПФ на ангиотензиноген и Ang I [27, 28]. Циркулирующий Ang II связывается с рецептором AT 1 на надпочечниках, чтобы стимулировать выработку альдостерона, что увеличивает реабсорбцию натрия за счет активации MR в дистальном отделе нефрона [3].
Регуляция локальных путей РААС в почках ()
Краткая схема регуляции внутрипочечной ренин-ангиотензин-альдостероновой системы (РААС). AGT ангиотензиноген, Ang I ангиотензин I, Ang II ангиотензин II
В почках продукция Ang II контролируется независимыми множественными механизмами [4]. Все компоненты, необходимые для генерации внутрипочечного Ang II, присутствуют вдоль нефрона [2, 7]. Концентрации Ang II в тканях почек намного выше, чем можно объяснить концентрациями, доставляемыми артериальным кровотоком [4, 29].Плазма-ангиотензиноген может не проникать через клубочковую мембрану из-за своего молекулярного размера, но почки также экспрессируют ангиотензиноген [5, 30]. Однако уровни ангиотензиногена в тканях почек намного ниже, чем в плазме [4]. С другой стороны, ренин секретируется клетками юкстагломерулярного аппарата и доставляется в почечный интерстиций, который обеспечивает путь локальной генерации Ang I в почках [19]. В частности, исследования показали, что активность ренина в почечной ткани более чем в 1000 раз выше, чем PRA (пикомолярные уровни Ang I / мл плазмы / час по сравнению снаномолярные уровни Ang I / г ткани / ч) [31]. Таким образом, большое количество ренина может легко расщеплять ангиотензиноген с образованием Ang I. Кроме того, Ang I также может легко превращаться в Ang II в почках [32, 33], потому что ACE обильно экспрессируется в проксимальных и дистальных канальцах, собирательных протоках и др. и почечные эндотелиальные клетки [34]. В совокупности, в отличие от роли ренина в плазме, ангиотензиноген является критическим фактором, регулирующим продукцию Ang II в почках. С другой стороны, подробный механизм, ответственный за индуцированную Ang II продукцию альдостерона в почках, до сих пор не выяснен ().
Исследования показали компартментализацию и независимую регуляцию почечной интерстициальной и канальцевой жидкости Ang II. Концентрации Ang II в почечной интерстициальной жидкости намного выше, чем уровни в плазме [35]. Nishiyama et al. [36] показали, что почечная интерстициальная инфузия ингибиторов АПФ значительно снижает уровни Ang II в почечной интерстициальной жидкости. Эти данные указывают на то, что Ang II генерируется в почечном интерстициальном пространстве. Также было показано, что концентрация Ang II в жидкости проксимальных канальцев в 100–200 раз выше, чем в плазме [37, 38].Эти результаты предполагают, что Ang II также синтезируется в просвете проксимального канальца, по крайней мере частично [39, 40].
Помимо внутрипочечной генерации Ang II, циркулирующий Ang II интернализуется в почках через рецептор AT 1 [41]. Ли и др. [42] показали, что внутрипочечный перенос / накопление Ang II в эндосомах кортикальных канальцев почек усиливается во время развития Ang II-индуцированной гипертензии. Важно отметить, что лечение БРА блокирует интернализацию Ang II в почках.
Специфическая роль ангиотензиногена в регуляции продукции Ang II в почках
В почках мРНК и белок ангиотензиногена в основном локализованы в клетках проксимальных канальцев [43, 44]. Ангиотензиноген, продуцируемый в клетках проксимальных канальцев, по-видимому, секретируется непосредственно в просвет канальцев и почечный интерстиций в дополнение к производству своих метаболитов внутриклеточно [45]. Сообщается, что концентрация ангиотензиногена в проксимальных канальцах у анестезированных крыс находится в диапазоне 300-600 нмоль / л, что значительно превышает уровни Ang I и Ang II в канальцевой жидкости [7].Трансгенные мыши, которые системно экспрессируют человеческий ренин и человеческий ангиотензиноген только в почках, показали повышенные внутрипочечные уровни Ang II, в то время как уровни Ang II в плазме не изменились. Интересно, что у этих мышей также была увеличена экспрессия эндогенного ангиотензиногена мыши [23]. Таким образом, селективная стимуляция внутрипочечной продукции Ang II из человеческого ангиотензиногена дополнительно стимулирует экспрессию эндогенного внутрипочечного ангиотензиногена мыши. Сходным образом внутрипочечная экспрессия ангиотензиногена увеличивается у крыс с гипертензией, которым вводили Ang II [46, 47].Хронические инфузии Ang II также значительно увеличивали скорость экскреции ангиотензиногена с мочой в зависимости от времени и дозы, что было связано с повышением систолического артериального давления и уровней Ang II в почках, но не с концентрациями Ang II в плазме [30]. Кроме того, лечение БРА предотвращало индуцированное Ang II увеличение экспрессии ангиотензиногена в почках и ангиотензиногена мочи [30]. Эти данные предполагают, что продукция ангиотензиногена в почках положительно стимулируется локальным Ang II через активацию рецептора AT 1 .Дальнейшие исследования показали, что высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена в клетках проксимальных канальцев человека [48, 49]. Кроме того, в почечных тканях крыс с диабетом 2 типа [6, 11, 44, 50] и пациентов [51] экспрессия генов ангиотензиногена была значительно увеличена в почках. Таким образом, можно предположить, что во время развития диабета высокий уровень глюкозы первоначально увеличивает внутрипочечные уровни ангиотензиногена, что приводит к образованию Ang II в почках. Затем несоответствующее производство Ang II может дополнительно стимулировать локальную экспрессию ангиотензиногена и связанное с ним образование Ang II в почках.Предполагается, что такой порочный круг внутрипочечной активации РААС является критическим фактором прогрессирования диабетической нефропатии [52, 53]. Исследования также показали, что лечение БРА значительно снижает как экспрессию ангиотензиногена, так и уровни Ang II в почках [6, 10, 12, 54, 55]. Таким образом, фармакологические ренопротекторные эффекты БРА можно частично объяснить ингибированием продукции внутрипочечного ангиотензиногена и Ang II. Хотя почечный ангиотензиноген преимущественно локализуется в проксимальных канальцах [44, 46, 47], слабая экспрессия также обнаруживается в клубочках.Поскольку гломерулярный ангиотензиноген повышен в поврежденных клубочках [56–58], локальная активация RAAS в клубочках может играть роль в патофизиологии повреждения клубочков. Недавно Eriguchi et al. [56] показали, что ангиотензиноген вырабатывается в поврежденных подоцитах клубочков у нефротических крыс, индуцированных пуромицином. Эти данные предполагают потенциальный вклад генерации ангиотензиногена подоцитами в прогрессирование протеинурии.
Помимо двух факторов, Ang II и высокого уровня глюкозы, другие факторы, такие как митоген-активированные протеинкиназы (MAPK), активные формы кислорода (ROS) и ядерный фактор, усиливающий легкую каппа-цепь активированных B-клеток (NFkB ), как сообщалось, также активируют экспрессию ангиотензиногена.Zhang et al. [59] показали, что экспрессия гена ангиотензиногена стимулируется через путь киназы p38 в иммортализованных клетках проксимальных канальцев почки крысы. Hsieh et al. [60] обнаружили, что экспрессия гена ангиотензиногена активируется через ROS в клеточной линии проксимальных канальцев. Кроме того, Kobori и Nishiyama [61] представили доказательства in vivo, что АФК стимулируют экспрессию гена ангиотензиногена в почках чувствительных к соли крыс Даля, которым вводят диету с высоким содержанием соли. Наконец, экспрессия гена ангиотензиногена активируется фактором транскрипции NFkB p65 в гепатоцитах [62].Также было высказано предположение о возможной связи между активацией MAPK и путями NFkB [63, 64].
Ангиотензиноген мочи как биомаркер внутрипочечного РААС и повреждения почек
Как упоминалось ранее, ангиотензиноген плазмы не может легко проникать через клубочковую мембрану из-за своего молекулярного размера. Ding et al. [65] получили мышей со сверхэкспрессией человеческого ангиотензиногена, специфичной для почек, и обнаружили большое количество человеческого ангиотензиногена в моче, но лишь незначительные следы в системном кровотоке.Kobori et al. [30] крысам внутривенно вводили человеческий ангиотензиноген; однако циркулирующий ангиотензиноген человека в моче не обнаруживался. Дальнейшие исследования с помощью двухфотонной микроскопии визуализировали гломерулярную динамику in vivo и показали, что клубочковая фильтрация циркулирующего ангиотензиногена человека намного меньше по сравнению с альбумином у мышей, что свидетельствует об ограниченной проницаемости клубочков [66].
Поскольку ангиотензиноген является белком, можно подумать, что у субъектов с протеинурией повышенная экскреция ангиотензиногена с мочой является неспецифическим следствием повышенной экскреции белков плазмы с мочой [67, 68].Однако уровень ангиотензиногена в моче не увеличивался, хотя уровень белка в моче повышен у крыс, получавших дезоксикортикостерон ацетат, что является моделью RAAS-независимой гипертензии [30]. Кроме того, соотношение ангиотензиноген / креатинин в моче у пациентов с незначительной патологией клубочков (8,3 ± 3,7 мкг / г Cr) было таким же, как и у здоровых субъектов (10,8 ± 3,4 мкг / г Cr), даже несмотря на то, что у этих пациентов наблюдалась тяжелая протеинурия [9 ]. У пациентов с преальбуминурией и диабетом 1 типа уровни ангиотензиногена в моче были уже выше, чем у контрольных субъектов [69].Zhuang et al. [70] показали, что повышенный уровень ангиотензиногена в моче предшествует развитию альбуминурии у пациентов с диабетом 2 типа. Точно так же ангиотензиноген с мочой и экскреция натрия значительно увеличиваются у детей с нормальным альбуминурием и диабетом [71]. Эти данные предполагают, что повышенный уровень ангиотензиногена в моче у пациентов с протеинурией нельзя просто объяснить неспецифическими последствиями протеинурии.
Однако циркулирующий ангиотензиноген может фильтроваться через клубочковую мембрану при некоторых патофизиологических условиях.Действительно, несколько клинических исследований показали, что уровни ангиотензиногена в моче достоверно коррелируют с альбуминурией у пациентов с артериальной гипертензией [72] и ХБП [67, 73, 74]. Matsusaka et al. [75, 76] показали, что у мышей с тяжелым повреждением подоцитов и потерей макромолекулярной барьерной функции стенки клубочковых капилляров внутрипочечная генерация Ang II увеличивается за счет фильтрованного ангиотензиногена, происходящего из печени. Eriguchi et al. [56] показали, что во время прогрессирования повреждения подоцитов отфильтрованный ангиотензиноген обильно реабсорбируется проксимальными канальцами, что приводит к снижению генерации ангиотензиногена в проксимальных канальцах.Также было высказано предположение, что клубочковые подоциты являются важным источником ангиотензиногена мочи при этом патологическом состоянии [9]. Эти данные предполагают, что фильтрованный циркулирующий ангиотензиноген также может быть источником и / или триггером генерации внутрипочечного Ang II у субъектов с тяжелым повреждением барьера клубочковой фильтрации, что может играть важную роль в активации внутрипочечного RAAS во время прогрессирования ХБП.
Растущее количество доказательств показывает, что ангиотензиноген в моче является специфическим биомаркером состояния внутрипочечного РААС, гипертонии и почечной недостаточности.Kobori et al. [30, 77] провели эксперименты на животных и показали, что повышение уровня ангиотензиногена в моче связано с увеличением экспрессии почечного ангиотензиногена и уровня Ang II в почках. У пациентов с незначительной патологией клубочков и IgA-нефропатией соотношение ангиотензиноген / креатинин в моче сильно коррелирует с экспрессией гена ангиотензиногена в тканях почечной биопсии [9]. Эти данные показали, что ангиотензиноген мочи является полезным маркером для прогнозирования уровней ангиотензиногена в почках этих пациентов.Сэндвич-твердофазный иммуноферментный анализ (ELISA) на человеческий ангиотензиноген был разработан Katsurada et al. [78], и теперь он коммерчески доступен, что позволило легко измерить большое количество образцов с течением времени. Также было показано, что обычные условия хранения не влияют на измеренные значения ангиотензиногена мочи [79]. Кроме того, экскреция ангиотензиногена с мочой не имеет циркадного ритма [80]. Таким образом, исследования ангиотензиногена в моче получили широкое распространение в мире, и растущее количество клинических данных указывает на то, что повышенные уровни ангиотензиногена в моче коррелируют с клиническими параметрами у пациентов с артериальной гипертензией [71, 72, 81] и ХБП [55, 73, 82–84].
Kobori et al. [81] показали, что ангиотензиноген в моче значительно коррелировал с артериальным давлением у пациентов с артериальной гипертензией, которые не получали антигипертензивные препараты. Они также обнаружили, что эта корреляция была высокой у чернокожих мужчин, что позволяет предположить возможный вклад ангиотензиногена мочи в солевую гипертензию. Интересно, что Kobori et al. [85] также показали, что как экспрессия ангиотензиногена в тканях почек, так и ангиотензиноген в моче заметно увеличивались у крыс с гипертензией, чувствительных к соли Даля.Кониши и др. [55] показали, что натрий-чувствительный индекс артериального давления сильно коррелирует с ангиотензиногеном мочи у пациентов с нефропатией IgA, у которых наблюдается натрий-зависимое повышение артериального давления. Аналогичным образом Zou et al. [86] показали, что экскреция ангиотензиногена с мочой выше при большей экскреции натрия с мочой и связана как с клиническим, так и с амбулаторным артериальным давлением. Дальнейшие исследования показали, что повышение уровня ангиотензиногена в моче значительно коррелирует с уровнем натрия в моче и предшествует гипертензии у детей с нормальным альбуминурием и диабетом 1 типа [71].Эти данные позволяют предположить, что ангиотензиноген мочи является полезным биомаркером для выявления натрийзависимой гипертензии. Савагути и др. [84] показали, что ангиотензиноген в моче сильно коррелировал с частотой сердечно-сосудистых осложнений у пациентов с диабетической нефропатией 2 типа. Недавние исследования также показали, что ангиотензиноген в моче значительно коррелирует с индексом массы левого желудочка и толщиной интима-медиа у пациентов с гипертонической болезнью, перенесших трансплантацию почки [87]. Мы также показали, что уровни ангиотензиногена в моче и внутрипочечного ангиотензиногена значительно увеличиваются у крыс с аортальной регургитацией [88], что указывает на потенциальную роль внутрипочечного ангиотензиногена в патофизиологии кардио-почечного синдрома.
Несколько клинических исследований показали, что ангиотензиноген в моче значительно повышен у пациентов с ХБП, включая IgA-нефропатию [55], диабетическую нефропатию [84, 87, 89], поликистоз почек [90, 91], фокальный сегментарный гломерулосклероз [56]. У этих пациентов с ХБП уровень ангиотензиногена в моче положительно коррелирует с уровнем белка или альбумина в моче, тогда как он отрицательно коррелирует с расчетной скоростью клубочковой фильтрации. Недавние исследования также показали, что ангиотензиноген мочи является прогностическим биомаркером острого повреждения почек [92, 93] и рубцевания почек [94].Однако важно отметить, что антитела, используемые в коммерчески доступных наборах для анализа ангиотензиногена ELISA, распознают как интактный ангиотензиноген, так и ангиотензиноген des-Ang I [78]. Схематически ангиотензиноген можно рассматривать как состоящий из комбинации функции Ang I, расположенной на N-конце, и присутствия структуры серпина (ингибитора сериновой протеазы) на противоположном конце. Таким образом, необходимы дальнейшие исследования с использованием нового набора ELISA для интактного ангиотензиногена.Кобори и Нишияма недавно предположили, что соотношение между ангиотензиногеном des-Ang I и интактным ангиотензиногеном может быть стабильным маркером активности ренина (был зарегистрирован патент PCT / JP2014 / 078751). Поскольку уровни ангиотензиногена в плазме очень высоки, мы предполагаем, что острые изменения в активации ренина могут не отражать соотношение ангиотензиноген des-Ang I / интактный ангиотензиноген в плазме. Чтобы проверить эту идею, мы электрически стимулировали почечный симпатический нерв с частотой 1 Гц (5 В, 1 мс) в течение 20 минут у анестезированных крыс и собрали образцы плазмы и мочи.Все экспериментальные процедуры проводились в соответствии с руководящими принципами по уходу и использованию животных, установленными Университетом Кагава (Кагава, Япония). Наши предварительные данные показали, что активация почечного симпатического нерва значительно увеличила PRA, но не изменила соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в плазме (). Интересно, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче вскоре увеличивалось при стимуляции почечного симпатического нерва. Эти данные позволяют предположить, что соотношение дез-Ang I ангиотензиноген / интактный ангиотензиноген в моче является потенциальным биомаркером активности ренина в почках.
Влияние электрической стимуляции почечного симпатического нерва с частотой 1 Гц (5 В, 1 мс) в течение 20 минут на PRA, соотношение Des-Ang I-AGT / интактный AGT в плазме и соотношение Des-Ang I-AGT / интактный AGT в моче у анестезированных крыс ( n = 12–15). PRA активность ренина плазмы, AGT ангиотензиноген, Ang I ангиотензин I. * P <0,05 по сравнению с контролем
Ангиотензиноген Des-Ang I, составляющий более 97% молекулы, по-видимому, не имеет функция.Недавно было показано, что некоторые серпины (антитромбин, маспин, фактор пигментного эпителия и каллистатин) обладают антиангиогенной активностью, что свидетельствует об общем механизме пролиферации и миграции эндотелиальных клеток. Ангиотензиноген и его продукт расщепления ренин, ангиотензиноген des-Ang I, также являются ингибиторами ангиогенеза как in vitro, так и in vivo в концентрациях в диапазоне концентраций, наблюдаемых в плазме. Это свойство, скорее всего, является следствием структурной аналогии ангиотензиногена с серпинами.Патологическое значение этой новой функции все еще не известно, но ангиотензиноген, продуцируемый глиальными клетками, может играть роль в стабилизации гематоэнцефалического барьера. Эти новые данные следует рассматривать в свете общего действия ренин-ангиотензиновой системы на ангиогенез [95].
Выводы
Внутрипочечный RAAS независимо регулируется, и его несоответствующая активация вносит свой вклад в патогенез развития гипертонии и почечной недостаточности. В этом кратком обзоре обсуждалась особая роль ангиотензиногена в регуляции внутрипочечной активности РААС.Локально экспрессируемый ангиотензиноген является основным фактором контроля внутрипочечных уровней Ang II, но фильтрованный циркулирующий ангиотензиноген также может быть источником образования внутрипочечного Ang II, если барьер клубочковой фильтрации серьезно поврежден. В любом случае ангиотензиноген мочи является полезным биомаркером для определения статуса внутрипочечного РААС, гипертензии и почечной недостаточности.
Благодарности
Финансирование Это исследование было частично поддержано Японским обществом содействия науке (JSPS) по грантам на научные исследования (KAKENHI) (26460343 Акире Нишияме и 15K08237 Хироюки Кобори).
Сноски
Соблюдение этических стандартов
Конфликт интересов Авторы заявили, что конфликта интересов не существует.
Этическое разрешение Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам учреждения или практики, в которой проводились исследования (номер одобрения Университета Кагава: # 15,031).
Ссылки
1. Нишияма А., Ким-Мицуяма С.Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: Обзор регуляции системы ренин-ангиотензин-альдостерон. J Pharmacol Sci. 2010. 113: 289–91. Проблема. [PubMed] [Google Scholar] 2. Navar LG, Inscho EW, Majid SA, Imig JD, Harrison-Bernard LM, Mitchell KD. Паракринная регуляция почечной микроциркуляции. Physiol Rev.1996; 76: 425–536. DOI: 10.1152 / Physrev.1996.76.2.425. Проблема. [PubMed] [CrossRef] [Google Scholar] 3. Нишияма А., Хитоми Х., Рахман А., Киемото Х. Открытие лекарств для преодоления хронической болезни почек (ХБП): Фармакологические эффекты блокаторов минералокортикоидных рецепторов.J Pharmacol Sci. 2009; 109: 1–6. Проблема. [PubMed] [Google Scholar] 4. Кобори Х., Нангаку М., Навар Л.Г., Нишияма А. Внутрипочечная ренин-ангиотензиновая система: от физиологии к патобиологии гипертонии и болезней почек. Pharmacol Rev.2007; 59: 251–87. DOI: 10.1124 / pr.59.3.3. Проблема. [PubMed] [CrossRef] [Google Scholar] 5. Кобори Х., Одзава Й., Сузаки Й., Прието-Карраскеро М.С., Нишияма А., Сёдзи Т. и др. Лекция молодых ученых: «Внутритрубчатый ангиотензиноген при гипертонии и заболеваниях почек»Am J Hypertens. 2006; 19: 541–50. DOI: 10.1016 / j.amjhyper.2005.11.014. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Нагаи Ю., Яо Л., Кобори Х., Мията К., Одзава Ю., Миятаке А. и др. Временная блокада ангиотензина II на преддиабетической стадии ослабляет развитие повреждения почек у крыс с диабетом 2 типа. J Am Soc Nephrol. 2005; 16: 703–11. DOI: 10.1681 / ASN.2004080649. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Навар Л.Г., Нишияма А. Внутрипочечное образование ангиотензина II.Contrib Nephrol. 2001; (135): 1–15. [PubMed] [Google Scholar] 8. Нишияма А., Кобори Х., Фукуи Т., Чжан Г.Х., Яо Л., Рахман М. и др. Роль ангиотензина II и активных форм кислорода в циклоспорин А-зависимой гипертензии. Гипертония. 2003. 42: 754–60. DOI: 10.1161 / 01.HYP.0000085195.38870.44. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Нишияма А., Кониси Ю., Охаши Н., Морикава Т., Урушихара М., Маеда И. и др. Ангиотензиноген мочи отражает активность внутрипочечной ренин-ангиотензиновой системы у пациентов с нефропатией iga.Nephrol Dial Transpl. 2011; 26: 170–7. DOI: 10.1093 / ndt / gfq371. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Fan YY, Kobori H, Nakano D, Hitomi H, Mori H, Masaki T и др. Аберрантная активация внутрипочечной ренин-ангиотензиновой системы в развивающихся почках крыс с диабетом 2 типа. Horm Metab Res. 2013; 45: 338–43. DOI: 10,1055 / с-0032-1331256. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Нишияма А., Накагава Т., Кобори Х., Нагаи Ю., Окада Н., Кониси И. и др.Строгая блокада ангиотензина предотвращает увеличение внутрипочечного ангиотензина II и аномалии подоцитов у крыс с диабетом 2 типа с микроальбуминурией. J Hypertens. 2008; 26: 1849–59. DOI: 10.1097 / HJH.0b013e3283060efa. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13. Сираджи Х.М., Кэри РМ. Защитная роль рецептора ангиотензина AT2 в модели почечной гипертензии. Гипертония. 1999; 33: 1237–42. Проблема. [PubMed] [Google Scholar] 14. Навар Л.Г., Митчелл К.Д., Харрисон-Бернард Л.М., Кобори Х., Нишияма А.Рассмотрение. Уровни внутрипочечного ангиотензина II в норме и при гипертонии. J Renin Angiotensin Aldosterone Syst. 2001; 2: S176 – S84. DOI: 10.1177 / 14703203010020013001. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Нишияма А., Хасегава К., Диах С., Хитоми Х. Новые подходы к блокаде системы ренин-ангиотензин-альдостерон: блокаторы минералокортикоидных рецепторов оказывают антигипертензивное и ренопротекторное действие независимо от системы ренин-ангиотензин. J Pharmacol Sci. 2010; 113: 310–4.Проблема. [PubMed] [Google Scholar] 16. Рафик К., Хитоми Х, Накано Д., Нишияма А. Патофизиологические роли альдостерона и рецептора минералокортикоидов в почках. J Pharmacol Sci. 2011; 115: 1–7. Проблема. [PubMed] [Google Scholar] 17. Brasier AR, Li J. Механизмы индуцируемого контроля транскрипции гена ангиотензиногена. Гипертония. 1996; 27: 465–75. Проблема. [PubMed] [Google Scholar] 18. Пол М., Поян Мехр А., Кройц Р. Физиология местных ренин-ангиотензиновых систем. Physiol Rev.2006; 86: 747–803. DOI: 10.1152 / Physrev.00036.2005. Проблема. [PubMed] [CrossRef] [Google Scholar] 19. Hackenthal E, Paul M, Ganten D, Taugner R. Морфология, физиология и молекулярная биология секреции ренина. Physiol Rev.1990; 70: 1067–116. DOI: 10.1152 / Physrev.1990.70.4.1067. Проблема. [PubMed] [CrossRef] [Google Scholar] 20. Бейлис К., Энгельс К., Химел А., Навар Л.Г. Активность ренина в плазме и скорость метаболического клиренса ангиотензина II у стареющих крыс без стресса. Mech Aging Dev. 1997. 97: 163–72. Проблема. [PubMed] [Google Scholar] 21.Гулд А.Б., Грин Д. Кинетика реакции человеческого ренина и человеческого субстрата. Cardiovasc Res. 1971; 5: 86–9. Проблема. [PubMed] [Google Scholar] 22. Kim HS, Krege JH, Kluckman KD, Hagaman JR, Hodgin JB, Best CF, et al. Генетический контроль артериального давления и локуса ангиотензиногена. Proc Natl Acad Sci USA. 1995; 92: 2735–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Кобори Х., Одзава Ю., Сато Р., Кацурада А., Мията К., Охаши Н. и др. Почечно-специфическое усиление ang II стимулирует эндогенный внутрипочечный ангиотензиноген у мышей, нацеленных на ген.Am J Physiol Renal Physiol. 2007; 293: F938–45. DOI: 10.1152 / ajprenal.00146.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Deschepper CF. Ангиотензиноген. Гормональная регуляция и относительное значение в генерации ангиотензина II. Kidney Int. 1994; 46: 1561–3. Проблема. [PubMed] [Google Scholar] 26. Девараджан С., Яхиро Э., Уехара Й., Хабе С., Нишияма А., Миура С. и др. Депрессорный эффект ингибитора химазы у мышей с умеренной гипертензией, вызванной высоким содержанием соли. Am J Physiol Heart Circ Physiol.2015; 309: h2987–96. DOI: 10.1152 / ajpheart.00721.2014. Проблема. [PubMed] [CrossRef] [Google Scholar] 27. Erdos EG. Фермент, преобразующий ангиотензин I, и изменения в наших представлениях с годами. Льюис К. Мемориальная лекция Даля. Гипертония. 1990; 16: 363–70. Проблема. [PubMed] [Google Scholar] 28. Джонстон CI. Тканевый ангиотензин-превращающий фермент при сердечной и сосудистой гипертрофии, восстановлении и ремоделировании. Гипертония. 1994; 23: 258–68. Проблема. [PubMed] [Google Scholar] 29. Ингерт С, Грима М, Кокард С, Бартелмебс М, Имбс Дж.Вклад интернализации ангиотензина II в уровни внутрипочечного ангиотензина II у крыс. Am J Physiol Renal Physiol. 2002; 283: F1003–10. DOI: 10.1152 / ajprenal.00322.2001. Проблема. [PubMed] [CrossRef] [Google Scholar] 30. Кобори Х., Нишияма А., Харрисон-Бернард Л. М., Навар Л. Г.. Ангиотензиноген в моче как индикатор внутрипочечного ангиотензинового статуса при артериальной гипертензии. Гипертония. 2003; 41: 42–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Кэмпбелл Д. Д., Лоуренс А. С., Таури А., Кладис А., Валентийн А. Дж..Дифференциальная регуляция уровней пептида ангиотензина в плазме и почках крысы. Гипертония. 1991; 18: 763–73. Проблема. [PubMed] [Google Scholar] 32. Komlosi P, Fuson AL, Fintha A, Peti-Peterdi J, Rosivall L, Warnock DG, et al. Превращение ангиотензина I в ангиотензин II стимулирует транспорт натрия в собирательных протоках коры головного мозга. Гипертония. 2003; 42: 195–9. DOI: 10.1161 / 01.HYP.0000081221.36703.01. Проблема. [PubMed] [CrossRef] [Google Scholar] 33. Rosivall L, Navar LG. Влияние на почечную гемодинамику внутриартериальных инфузий ангиотензинов I и II.Am J Physiol. 1983; 245: F181–7. DOI: 10.1152 / ajprenal.1983.245.2.F181. Проблема. [PubMed] [CrossRef] [Google Scholar] 34. Casarini DE, Boim MA, Stella RC, Krieger-Azzolini MH, Krieger JE, Schor N. Активность ангиотензин-превращающего фермента в канальцевой жидкости вдоль нефрона крысы. Am J Physiol. 1997; 272: F405–9. DOI: 10.1152 / ajprenal.1997.272.3.F405. Проблема. [PubMed] [CrossRef] [Google Scholar] 35. Нишияма А., Сет Д.М., Навар Л.Г. Концентрация ангиотензинов I и II в почечной интерстициальной жидкости у анестезированных крыс.Гипертония. 2002; 39: 129–34. Проблема. [PubMed] [Google Scholar] 36. Нишияма А., Сет Д.М., Навар Л.Г. Концентрации ангиотензина I и ангиотензина II в интерстициальной жидкости почек во время местного ингибирования ангиотензинпревращающего фермента. J Am Soc Nephrol. 2002; 13: 2207–12. Проблема. [PubMed] [Google Scholar] 37. Браам Б., Митчелл К.Д., Фокс Дж., Навар Л.Г. Проксимальная канальцевая секреция ангиотензина II у крыс. Am J Physiol. 1993; 264: F891–8. DOI: 10.1152 / ajprenal.1993.264.5.F891. Проблема. [PubMed] [CrossRef] [Google Scholar] 38.Seikaly MG, Arant BS, Jr, Seney FD., Jr. Концентрации эндогенного ангиотензина в определенных компартментах внутрипочечной жидкости крысы. J Clin Invest. 1990; 86: 1352–7. DOI: 10,1172 / JCI114846. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Хираньячаттада С., Харрис П.Дж. Модуляция локально продуцируемого люминального ангиотензина II реабсорбции натрия в проксимальных канальцах через рецептор AT1. Br J Pharmacol. 1996. 119: 617–8. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Куан А, Баум М.Эндогенная продукция ангиотензина II модулирует транспорт проксимальных канальцев крысы. J Clin Invest. 1996; 97: 2878–82. DOI: 10,1172 / JCI118745. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Гонсалес-Вильялобос Р.А., Сет Д.М., Сато Р., Хортон Х., Охаши Н., Мията К. и др. Интраренальное увеличение ангиотензина II и ангиотензиногена у мышей, которым вводили хронический ангиотензин II. Am J Physiol Renal Physiol. 2008; 295: F772–9. DOI: 10.1152 / ajprenal.00019.2008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42.Ли XC, Карретеро О.А., Navar LG, Zhuo JL. Опосредованное рецептором AT1 накопление внеклеточного ангиотензина II в клетках проксимальных канальцев: роль микротрубочек цитоскелета и тирозинфосфатаз. Am J Physiol Renal Physiol. 2006; 291: F375–83. DOI: 10.1152 / ajprenal.00405.2005. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Дарби И.А., Серния С. Гибридизация in situ и иммуногистохимия почечного ангиотензиногена в почках новорожденных и взрослых крыс. Cell Tissue Res. 1995; 281: 197–206.Проблема. [PubMed] [Google Scholar] 44. Камияма М., Гарнер М.К., Фаррагут К.М., Софуэ Т., Хара Т., Морикава Т. и др. Детальная локализация увеличенной мРНК ангиотензиногена и белка в проксимальных сегментах канальцев диабетических почек у крыс и людей. Int J Biol Sci. 2014; 10: 530–42. DOI: 10.7150 / ijbs.8450. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Lantelme P, Rohrwasser A, Gociman B, Hillas E, Cheng T, Petty G, et al. Влияние диетического натрия и генетического фона на ангиотензиноген и ренин у мышей.Гипертония. 2002; 39: 1007–14. Проблема. [PubMed] [Google Scholar] 46. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Повышение экспрессии ангиотензиногена при ангиотензин II-зависимой гипертензии. Гипертония. 2001; 37: 1329–35. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экспрессия мРНК ангиотензиногена и белка при ангиотензин II-зависимой гипертензии. J Am Soc Nephrol. 2001; 12: 431–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ван Дж., Шибаяма Й., Кобори Х., Лю Й., Кобара Х., Масаки Т. и др.Высокий уровень глюкозы увеличивает ангиотензиноген в клетках проксимальных канальцев почек человека за счет ядерного фактора-5 гепатоцитов. PLoS One. 2017; 12: e0185600. DOI: 10.1371 / journal.pone.0185600. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Чжан С.Л., Филеп Дж. Г., Хохман Т. К., Тан СС, Ингельфингер Дж. Р., Чан Дж. С.. Молекулярные механизмы действия глюкозы на экспрессию гена ангиотензиногена в клетках проксимальных канальцев крыс. Kidney Int. 1999; 55: 454–64. DOI: 10.1046 / j.1523-1755.1999.00271.x. Проблема. [PubMed] [CrossRef] [Google Scholar] 50.Мията К., Охаши Н., Сузаки Ю., Кацурада А., Кобори Х. Последовательная активация оси реактивных форм кислорода / ангиотензиногена / ренин-ангиотензиновой системы при повреждении почек у крыс с диабетом 2 типа. Clin Exp Pharmacol Physiol. 2008; 35: 922–7. DOI: 10.1111 / j.1440-1681.2008.04938.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Kamiyama M, Urushihara M, Morikawa T., Konishi Y, Imanishi M, Nishiyama A, et al. Оксидативный стресс / ангиотензиноген / ренин-ангиотензиновая система у пациентов с диабетической нефропатией.Int J Mol Sci. 2013; 14: 23045–62. DOI: 10.3390 / ijms141123045. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Огава С., Мацусима М., Мори Т., Окамура М., Сенда М., Сакамото Т. и др. Выявление стадий диабетической нефропатии, при которых блокаторы рецепторов ангиотензина II наиболее эффективно подавляют альбуминурию. Am J Hypertens. 2013; 26: 1064–9. DOI: 10,1093 / ajh / hpt085. Проблема. [PubMed] [CrossRef] [Google Scholar] 53. Сато Э., Мори Т., Сато М., Фудзивара М., Накамичи Ю., Оба И. и др. Экскреция ангиотензиногена с мочой связана с артериальным давлением у молодых людей с ожирением.Clin Exp Hypertens. 2016; 38: 203–8. DOI: 10.3109 / 10641963.2015.1081219. Проблема. [PubMed] [CrossRef] [Google Scholar] 54. Ихара Г., Киемото Х., Кобори Х., Нагаи Й., Охаши Н., Хитоми Х. и др. Регрессия повреждения поверхностных клубочковых подоцитов у крыс с диабетом 2 типа с явной альбуминурией: эффект блокады ангиотензина II. J Hypertens. 2010; 28: 2289–98. DOI: 10.1097 / HJH.0b013e32833dfcda. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Кониси Ю., Нишияма А., Морикава Т., Китабаяси С., Сибата М., Хамада М. и др.Связь между ангиотензиногеном мочи и солевой чувствительностью артериального давления у пациентов с нефропатией ига. Гипертония. 2011; 58: 205–11. DOI: 10.1161 / HYPERTENSIONAHA.110.166843. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Эригути М., Йотсуэда Р., Торису К., Кавай Й., Хасэгава С., Танака С. и др. Оценка ангиотензиногена мочи как маркера повреждения подоцитов при протеинурических нефропатиях. Am J Physiol Renal Physiol. 2016; 310: F322–33. DOI: 10.1152 / ajprenal.00260.2015. Вып. [PubMed] [CrossRef] [Google Scholar] 57. Охаши Н., Урушихара М., Сато Р., Кобори Х. Гломерулярный ангиотензиноген индуцируется в мезангиальных клетках диабетических крыс через пути реактивных форм кислорода — erk / jnk. Hypertens Res. 2010; 33: 1174–81. DOI: 10.1038 / ч. 2010.143. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Такамацу М., Урушихара М., Кондо С., Симидзу М., Мориока Т., Оите Т. и др. Гломерулярный белок ангиотензиногена усиливается при педиатрической нефропатии. Педиатр Нефрол.2008; 23: 1257–67. DOI: 10.1007 / s00467-008-0801-6. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Чжан С.Л., Тан СС, Чен Х, Филеп Дж. Г., Ингельфингер Дж. Р., Чан Дж. С.. Высокие уровни глюкозы стимулируют экспрессию гена ангиотензиногена через путь митоген-активируемой протеинкиназы p38 в клетках проксимальных канальцев почек крысы. Эндокринология. 2000; 141: 4637–46. DOI: 10.1210 / endo.141.12.7844. Проблема. [PubMed] [CrossRef] [Google Scholar] 60. Се Т.Дж., Чжан С.Л., Филеп Дж. Г., Тан СС, Ингельфингер-младший, Чан Дж. С..Высокий уровень глюкозы стимулирует экспрессию гена ангиотензиногена за счет генерации активных форм кислорода в клетках проксимальных канальцев почек крысы. Эндокринология. 2002. 143: 2975–85. DOI: 10.1210 / endo.143.8.8931. Проблема. [PubMed] [CrossRef] [Google Scholar] 61. Кобори Х., Нишияма А. Влияние темпола на продукцию почечного ангиотензиногена у чувствительных к соли крыс. Biochem Biophys Res Commun. 2004; 315: 746–50. DOI: 10.1016 / j.bbrc.2004.01.120. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 62. Ли Дж., Brasier AR.Активация гена ангиотензиногена ангиотензином II опосредуется фактором транскрипции rel a (ядерный фактор-каппаб p65): одним из механизмов петли положительной обратной связи ренин-ангиотензиновой системы в гепатоцитах. Мол Эндокринол. 1996. 10: 252–64. DOI: 10.1210 / исправление.10.3.8833654. Проблема. [PubMed] [CrossRef] [Google Scholar] 63. Бринкманн М.М., Гленн М., Радуга Л., Кизер А., Хенке-Гендо С., Шульц Т.Ф. Активация митоген-активируемой протеинкиназы и путей nf-каппаб мембранным белком k15 герпеса, ассоциированным с саркомой Капоши.J Virol. 2003. 77: 9346–58. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Hoffmann E, Thiefes A, Buhrow D, Dittrich-Breiholz O, Schneider H, Resch K и др. Mek1-зависимая отсроченная экспрессия fos-родственного антигена-1 противодействует c-fos и p65 nf-kappab-опосредованной транскрипции интерлейкина-8 в ответ на цитокины или факторы роста. J Biol Chem. 2005; 280: 9706–18. DOI: 10.1074 / jbc.M407071200. Проблема. [PubMed] [CrossRef] [Google Scholar] 65. Дин И, Дэвиссон Р.Л., Харди Д.О., Чжу Л.Дж., Меррилл, округ Колумбия, Кэттералл Дж.Ф. и др.Промотор белка, регулируемого андрогенами почек, обеспечивает специфичную для клеток проксимального канальца почек и высокую андроген-чувствительную экспрессию гена ангиотензиногена человека у трансгенных мышей. J Biol Chem. 1997. 272: 28142–8. Проблема. [PubMed] [Google Scholar] 66. Накано Д., Кобори Х., Берфорд Дж. Л., Геворгян Х., Зайдель С., Хитоми Х и др. Мультифотонная визуализация клубочковой проницаемости ангиотензиногена. J Am Soc Nephrol. 2012; 23: 1847–56. DOI: 10.1681 / ASN.2012010078. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Roksnoer LC, Verdonk K, van den Meiracker AH, Hoorn EJ, Zietse R, Danser AH. Мочевые маркеры активности внутрипочечной ренин-ангиотензиновой системы in vivo. Curr Hypertens Rep., 2013; 15: 81–8. DOI: 10.1007 / s11906-012-0326-z. Проблема. [PubMed] [CrossRef] [Google Scholar] 68. Zhuang Z, Bai Q, Lata A, Liang Y, Zheng D, Wang Y. Изменения концентрации ангиотензиногена в моче и его связь с белками мочи у крыс с диабетом. Int J Clin Exp Pathol. 2015; 8: 11946–56. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Сайто Т., Урушихара М., Котани Ю., Кагами С., Кобори Х. Повышенный ангиотензиноген в моче является прецедентом повышения уровня альбумина в моче у пациентов с диабетом 1 типа. Am J Med Sci. 2009; 338: 478–80. DOI: 10.1097 / MAJ.0b013e3181b90c25. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Чжуанг З., Бай Ц., Лян А.Л., Чжэн Ю., Ван ДЙ. Повышение уровня ангиотензиногена в моче предшествует развитию альбуминурии у нормотензивных пациентов с диабетом 2 типа. Int J Clin Exp Pathol. 2015; 8: 11464–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71.Солтысяк Дж., Сковронска Б., Фична П., Остальска-Новицка Д., Станкевич В., Левандовска-Стаховяк М. и др. Ангиотензиноген и натрий в моче связаны с артериальным давлением у детей с нормоальбуминурией и диабетом. Педиатр Нефрол. 2014; 29: 2373–8. DOI: 10.1007 / s00467-014-2861-0. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 72. Кобори Х., Альпер А.Б., младший, Шенава Р., Кацурада А., Сайто Т., Охаши Н. и др. Ангиотензиноген мочи как новый биомаркер состояния внутрипочечной ренин-ангиотензиновой системы у пациентов с артериальной гипертензией.Гипертония. 2009; 53: 344–50. DOI: 10.1161 / HYPERTENSIONAHA.108.123802. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Кобори Х., Охаши Н., Кацурада А., Мията К., Сато Р., Сайто Т. и др. Ангиотензиноген мочи как потенциальный биомаркер тяжести хронических заболеваний почек. J Am Soc Hyperten. 2008; 2: 349–54. DOI: 10.1016 / j.jash.2008.04.008. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 74. ван ден Хеувел М., Батенбург В. В., Джайнандунсинг С., Гаррелдс И. М., ван Гул Дж. М., Фелдерс Р. А. и др.Ренин в моче, но не ангиотензиноген или альдостерон, отражает активность почечной ренин-ангиотензин-альдостероновой системы и эффективность блокады ренин-ангиотензин-альдостероновой системы в почках. J Hypertens. 2011; 29: 2147–55. DOI: 10.1097 / HJH.0b013e32834bbcbf. Проблема. [PubMed] [CrossRef] [Google Scholar] 75. Мацусака Т., Ниймура Ф., Пастан I, Шинтани А., Нишияма А., Итикава И. Повреждение подоцитов усиливает фильтрацию печеночного ангиотензиногена и почечного ангиотензина II поколения. Kidney Int.2014; 85: 1068–77. DOI: 10.1038 / ki.2013.453. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Мацусака Т., Ниймура Ф., Симидзу А., Пастан I, Сайто А., Кобори Х. и др. Ангиотензиноген печени является основным источником почечного ангиотензина II. J Am Soc Nephrol. 2012; 23: 1181–9. DOI: 10.1681 / ASN.2011121159. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 77. Кобори Х., Харрисон-Бернар Л.М., Навар Л.Г. Экскреция ангиотензиногена с мочой отражает внутрипочечную продукцию ангиотензиногена.Почки. 2002. 61: 579–85. DOI: 10.1046 / j.1523-1755.2002.00155.x. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78. Кацурада А., Хагивара Ю., Мияшита К., Сато Р., Мията К., Охаши Н. и др. Новый сэндвич-элиза для ангиотензиногена человека. Am J Physiol Renal Physiol. 2007; 293: F956–60. DOI: 10.1152 / айпренал.00090.2007. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 79. Нисидзима Ю., Кобори Х., Софуэ Т., Кайфу К., Мориваки К., Хара Т. и др. Важные аспекты забора мочи для измерения ангиотензиногена: время и условия хранения у здоровых людей.Tohoku J Exp Med. 2012; 228: 333–9. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Nishijima Y, Kobori H, Kaifu K, Mizushige T., Hara T., Nishiyama A, et al. Циркадный ритм ангиотензиногена плазмы и мочи у здоровых добровольцев и пациентов с хронической болезнью почек. J Renin Angiotensin Aldosterone Syst. 2014; 15: 505–8. DOI: 10.1177 / 1470320314557584. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 81. Кобори Х., Урушихара М, Сюй Дж. Х., Беренсон Г.С., Навар Л.Г. Ангиотензиноген в моче коррелирует с артериальным давлением у мужчин (исследование сердца) J Гипертензия.2010; 28: 1422–8. DOI: 10.1097 / HJH.0b013e3283392673. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 82. Миллс К.Т., Кобори Х., Хамм Л.Л., Альпер А.Б., Хан И.Е., Рахман М. и др. Повышенная экскреция ангиотензиногена с мочой связана с риском хронического заболевания почек. Nephrol Dial Transpl. 2012; 27: 3176–81. DOI: 10.1093 / ndt / gfs011. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Мидзусигэ Т., Кобори Х., Нисидзима Й., Яно Й., Саката К., Хаякава М. и др. Ангиотензиноген в моче может быть прогностическим маркером ренопротекторного действия алоглиптина у пациентов с диабетом 2 типа.J Diabetes Res. 2015; 2015: 517472. DOI: 10.1155 / 2015/517472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Савагути М., Араки С.И., Кобори Х., Урушихара М., Ханеда М., Коя Д. и др. Связь между уровнем ангиотензиногена в моче и прогнозом почек и сердечно-сосудистой системы у пациентов с сахарным диабетом 2 типа. J. Исследование диабета. 2012; 3: 318–24. Проблема. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Кобори Х., Нишияма А., Абэ Й., Навар Л.Г. Повышение внутрипочечного ангиотензиногена у чувствительных к соли крыс на диете с высоким содержанием соли.Гипертония. 2003. 41: 592–7. DOI: 10.1161 / 01.HYP.0000056768.03657.B4. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86. Цзоу Дж, Ли Й, Ли Ф.Х., Вэй Ф.Ф., Ван Дж. Экскреция ангиотензиногена с мочой и амбулаторное артериальное давление. J Hypertens. 2012; 30: 2000–6. DOI: 10.1097 / HJH.0b013e3283576928. Проблема. [PubMed] [CrossRef] [Google Scholar] 87. Тирьяки О., Усалан С. Связь между скоростью экскреции ангиотензиногена с мочой и индексом массы левого желудочка и толщиной интимы-медиа сонной артерии у реципиентов трансплантата почки с гипертонией.Clin Transpl. 2015; 29: 351–8. DOI: 10.1111 / ctr.12521. Проблема. [PubMed] [CrossRef] [Google Scholar] 88. Рафик К., Нома Т., Фудзисава И., Исихара Ю., Араи Ю., Наби А.Х. и др. Симпатическая денервация почек подавляет повреждение подоцитов de novo и альбуминурию у крыс с аортальной регургитацией. Тираж. 2012; 125: 1402–13. DOI: 10.1161 / CIRCULATIONAHA.111.064097. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 89. Satirapoj B, Siritaweesuk N, Supasyndh O. Ангиотензиноген в моче как потенциальный биомаркер диабетической нефропатии.Clin Kidney J. 2014; 7: 354–60. DOI: 10.1093 / ckj / sfu059. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 90. Курултак I, Сенгул С., Коджак С., Эрдогмус С., Калайоглу Р., Месцигил П. и др. Ангиотензиноген в моче, связанные факторы и клинические последствия у пациентов с нормотензивной аутосомно-доминантной поликистозной болезнью почек. Ren Fail. 2014; 36: 717–21. DOI: 10.3109 / 0886022X.2014.8. Проблема. [PubMed] [CrossRef] [Google Scholar] 91. Пак Х.С., Кан А.Ю., Чан Дж.Й., Ким Х., Хан М., О К.Х. и др. Повышенное соотношение ангиотензиноген / креатинин (agt / cr) в моче может быть связано со снижением функции почек у пациентов с аутосомно-доминантной поликистозной болезнью почек.BMC Nephrol. 2015; 16:86. DOI: 10.1186 / s12882-015-0075-8. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Тумлин Дж. А., Чавла Л. С. и др. Ангиотензиноген в моче и риск тяжелых аки. Clin J Am Soc Nephrol. 2013; 8: 184–93. DOI: 10.2215 / CJN.06280612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Алдж Дж. Л., Каракала Н., Нили Б. А., Джанеч М. Г., Велес Дж. К., Артур Дж. М. и др. Ангиотензиноген в моче позволяет прогнозировать неблагоприятные исходы у пациентов с острым повреждением почек в отделении интенсивной терапии.Crit Care. 2013; 17: R69. DOI: 10.1186 / cc12612. Проблема. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94. Китао Т., Кимата Т., Яманучи С., Като С., Цуджи С., Канеко К. Мочевые биомаркеры для скрининга почечных рубцов у детей с фебрильной инфекцией мочевыводящих путей: пилотное исследование. J Urol. 2015; 194: 766–71. DOI: 10.1016 / j.juro.2015.04.091. Проблема. [PubMed] [CrossRef] [Google Scholar] 95. Корвол П., Ламанд Н., Круз А., Селерье Дж., Гаск Дж. М.. Ингибирование ангиогенеза: новая функция ангиотензиногена и дез (ангиотензин I) ангиотензиногена.J Urol. 2003. 5: 149–54. Проблема. [PubMed] [Google Scholar]Ренин-ангиотензин-альдостероновая система и ее подавление
Abstract
Хроническая активация ренин-ангиотензин-альдостероновой системы (РААС) способствует развитию и закреплению синдромов застойной сердечной недостаточности, системной гипертензии и хроническое заболевание почек. Избыточные уровни циркулирующего и тканевого ангиотензина II (AngII) и альдостерона приводят к профибротической, воспалительной и гипертрофической среде, которая вызывает ремоделирование и дисфункцию в сердечно-сосудистой и почечной тканях.Понимание роли РААС в этом аномальном патологическом ремоделировании выросло за последние несколько десятилетий, и были разработаны многочисленные медицинские методы лечения, направленные на подавление РААС. Несмотря на это, заболеваемость этими заболеваниями остается высокой. Продолжение исследований сложности RAAS должно помочь клиницистам модулировать (подавлять или усиливать) компоненты этой системы и улучшать качество жизни и выживаемость. Этот обзор посвящен обновлению нашего понимания РААС и патофизиологии избытка AngII и альдостерона, а также обзор того, что известно о его подавлении при сердечно-сосудистых и почечных заболеваниях, особенно у кошек и собак.
Ключевые слова: ингибитор ангиотензинпревращающего фермента, блокатор рецепторов ангиотензина, хроническая болезнь почек, сердечная недостаточность, блокатор минералокортикоидных рецепторов, протеинурическая болезнь почек, системная гипертензия
1. ВВЕДЕНИЕ
Хотя активация ренин-ангиотензин-альдостероновой системы (РААС) может быть компенсаторным на ранних стадиях сердечно-сосудистых и почечных заболеваний, длительная активация неадекватна. У пациентов с сердечной недостаточностью относительное повышение активности ренина в плазме и концентрации альдостерона в крови считаются маркерами гемодинамических и анатомических нарушений этого синдрома и вносят в них свой вклад.1, 2, 3, 4, 5 Неблагоприятные эффекты хронического воздействия высоких концентраций ангиотензина II (AngII) и альдостерона изложены в Таблице. 6, 7, 8, 9, 10, 11, 12, 13, 14 Подавление Таким образом, РААС является ключевой стратегией лечения хронических сердечно-сосудистых и почечных заболеваний и достигается путем введения ингибиторов ангиотензинпревращающего фермента (ИАПФ), блокаторов рецепторов AngII типа 1 (БРА) и антагонистов минералокортикоидных рецепторов (MRA), отдельно или в комбинации. Однако чем больше мы узнаем об этой системе, тем шире и сложнее она становится.Избыточности, которые обходят нашу терапевтическую блокаду или непреднамеренное подавление полезных компонентов этой системы, могут снизить эффективность наших супрессивных методов лечения РААС. Например, уровни ангиотензина II и альдостерона иногда повышаются, несмотря на фармакологическое подавление РААС, а лежащие в основе механизмы все еще недостаточно понятны.15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 , 28, 29, 30, 31, 32 Кроме того, некоторые лекарства и стратегии, используемые для лечения сердечно-сосудистых заболеваний, включая фуросемид, амлодипин, гидралазин и ограничение натрия в пище, стимулируют РААС (вспомогательная информация, рисунок S1).5, 33, 34, 35, 36, 37, 38, 39 Необходимы дальнейшие исследования этой сложной системы для улучшения медицинских методов лечения сердечно-сосудистых и почечных заболеваний, что позволит нам более эффективно модулировать эту систему и улучшить клинические результаты.
Таблица 1
Альдостерон и ангиотензин II: вредные сердечно-сосудистые и почечные эффекты
| Неблагоприятные эффекты | Прямые эффекты ангиотензина II | Прямые эффекты альдостерона | |||
|---|---|---|---|---|---|
| ремоделирование миокарда, немоделирование миокарда: , апоптоз | Да | Да | |||
| Ремоделирование сосудов: гипертрофия, фиброз | Да | Да | |||
| Повышение ROS | Да | Да | |||
| Pro ‐ ROS (цитокины) | Да | Да | |||
| Аритмогенный | Да | Да | |||
| Сосудистая эндотелиальная дисфункция (ЕТ-1, вазопрессин, ацетилхолин-опосредованная вазодилататорная дисфункция) | Да 070 | Да | Да 070 | Да 900 | Есть |
| Повреждение клубочков | Да | Да | |||
| Дисфункция клубочков: протеинурия | Да | Да | |||
| Повышенное внутриклубочковое давление | +++ (вазоконстрикция) | + (задержка жидкости | и SNS)Тубулоинтерстициальная травма | Да | Да |
| Дисфункция барорецептора Повышение ЧСС | Возможно | Да | |||
| Повышенный тонус SNS | Да | Да | |||
| 9 | |||||
| Прямое увеличение ЧСС | Да | Нет | |||
| Солевой аппетит | Да | Да | |||
| Повышенная жажда | Да | Нет | |||
| Na + и H 2 O удержание , скопление | Да | Да | K + впустую | Нет | Да |
2.ЦИРКУЛЯЦИЯ И ТКАНИ RAAS
Ренин синтезируется в виде препренина в юкстагломерулярных эпителиоидных клетках, расщепляется до проренина и либо высвобождается в виде проренина, либо подвергается дальнейшей переработке с образованием активного ренина, который хранится в гранулах. Гранулы ренина затем высвобождаются контролируемым образом, делая ренин лимитирующей стадией ренин-ангиотензин-альдостеронового каскада у большинства видов. Напротив, ангиотензиноген постоянно высвобождается из печени (рисунок) и обычно присутствует в избытке по сравнению с ренином.Повышенный синтез и высвобождение ренина происходит в ситуациях низкого системного артериального давления, гиповолемии, дефицита натрия и симпатической стимуляции. В кровотоке ренин метаболизирует ангиотензиноген, высвобождая ангиотензин I (AngI). Фермент, превращающий ангиотензин (АПФ), который высвобождается из эндотелиальных клеток, превращает AngI в AngII. Ангиотензин II действует на 2 рецептора: рецепторы ангиотензина типа 1 и типа 2 (AT 1 R и AT 2 R). Действие ангиотензина II на AT 1 R приводит к увеличению задержки натрия, сужению сосудов (включая преимущественное сужение эфферентной артериолы почки), стимуляции жажды и желания соли, усилению активности симпатической нервной системы и высвобождению альдостерона надпочечниками. клубочковая зона железы.Взаимодействие AngII с этим рецептором опосредует большую часть изменений заболевания, связанных с хронической активацией RAAS, суммированных в таблице. Действия стимуляции AT 2 R противоречат таковым из AT 1 R, где стимуляция рецептора 2 типа приводит к противовоспалительному, антифиброзному и сосудорасширяющему эффекту. AT 2 R является доминирующим типом рецепторов у плода и играет ключевую роль в развитии, но менее актуален для нормального взрослого человека. Однако активность AT 2 R может быть повышена при определенных болезненных состояниях.40, 41, 42
Схема ренин-ангиотензин-альдостероновой системы (РААС): факторы, которые приводят к высвобождению ренина из юкстагломерулярных клеток почек и «органов-мишеней» AngII, действие которых (как патофизиологическое, так и патологическое) в первую очередь опосредовано AT 1 R. Считается, что действие AngII на AT 2 R противодействует действиям AT 1 R. AT 2 R, вероятно, имеет большее значение для развивающегося плода, но все же может активироваться при определенных болезненных состояниях у взрослых.Ангиотензин II также является основным стимулятором секреции альдостерона, который действует через MR, увеличивая задержку натрия в почках, а также усиливает патофизиологические эффекты AngII в сердце, почках и сосудистой сети. AngI, ангиотензин I; AngII, ангиотензин II, AT 1 R, рецептор ангиотензина типа 1; AT 2 R, рецептор ангиотензина 2 типа; СО — сердечный выброс; MR, рецептор минералокортикоидов; SNS, симпатическая нервная система
Альдостерон, конечный гормон РААС, обеспечивает 90% минералокортикоидной активности секреции надпочечников и является ключевым регулятором натрия, калия и баланса жидкости в организме.43, 44 Ангиотензин II и повышенная концентрация внеклеточного K + , сильнейшие стимуляторы секреции альдостерона, увеличивают экспрессию гена CYP11B2, который кодирует альдостерон-синтазу.45 Действуя через минералокортикоидный рецептор (MR), альдостерон модулирует экспрессию ионных каналов, насосы и обменники в эпителиальных тканях (почки, толстая кишка, слюнные и потовые железы). В конечном итоге это приводит к увеличению трансэпителиального Na + , реабсорбции воды и экскреции K + .Минералокортикоидные рецепторы также обнаруживаются в неэпителиальных тканях, таких как сетчатка, мозг, миокард, гладкомышечные клетки сосудов, макрофаги, фибробласты и адпиоциты.46, 47, 48, 49, 50 Эффекты альдостерона, таким образом, широко распространены и выходят далеко за рамки его роль как «почечного гормона». В частности, считается, что альдостерон опосредует воспаление и влияет на энергетический метаболизм в неэпителиальных тканях.
Несвязанный MR в основном расположен в цитоплазме, и когда он связан лигандом, он перемещается в ядро, где он действует как фактор транскрипции.51 Некоторые действия альдостерона негеномны и происходят относительно быстро. Эти действия, вероятно, опосредуются активацией небольшой фракции локализованного на клеточной мембране MR и MR-взаимодействия с другими рецепторами, такими как рецептор эстрогена, связанный с G-белком, AT 1 R и рецептор эпидермального фактора роста.52 Альдостерон является основным физиологическим фактором. лиганд MR, хотя глюкокортикоиды, такие как кортизол, имеют аналогичное сродство к рецепторам. В эпителиальных клетках и клетках гладких мышц сосудов фермент 11β-гидроксистероид дегидрогеназа типа 2 (11β-HSD2) изменяет глюкокортикоиды и предотвращает их связывание с MR.Таким образом, более распространенные глюкокортикоиды не могут превзойти минералокортикоиды в МР. В тканях, таких как миокард, где мало 11β-HSD2, связывание кортизола с МР, вероятно, важно.
Пептиды ангиотензина и альдостерон также продуцируются в таких тканях, как мозг, кровеносные сосуды, почки и сердце. 40, 54, 55, 56, 57 Местно продуцируемые гормоны РААС играют важную роль в нормальной сердечно-сосудистой функции и гомеостазе электролитной жидкости. но также опосредуют аномальное ремоделирование тканей.Работа in vitro на культивируемых клетках гладких мышц сосудов и кардиомиоцитах показала, что альдостерон активирует компоненты РААС, включая активность АПФ и стимулируемую AngII передачу сигнала, что приводит к увеличению локальной (тканевой) активности РААС.58, 59, 60, 61, 62 Тканевые компоненты РААС также регулируются механическим растяжением миокарда и сосудов, секрецией адипоцитов, присутствием активных форм кислорода (АФК) и воспалением.63, 64 Хотя количество альдостерона, продуцируемого в тканях, обычно составляет <1% из количества, продуцируемого надпочечниками, 56, 65 местно продуцируемый альдостерон, вероятно, играет роль в аномальном ремоделировании (гипертрофии и фиброзе), и управление тканевым RAAS, вероятно, будет частью будущей фармакотерапевтической стратегии.11, 12, 40
В последнее время внимание было обращено на рецептор проренина ((P) RR), который связывает как ренин, так и проренин, и представляет собой многофункциональный рецептор, обнаруженный в нескольких местах в почках, а также в сердце, жировой ткани и мозге. 66 Разнообразные функции этого рецептора включают поддержание внутри- и внеклеточного pH, центральную регуляцию артериального давления и гомеостаз натрия в почках. Роль этого рецептора в патофизиологии сердечно-сосудистых и почечных заболеваний остается невыясненной, однако известно, что (P) RR связывает проренин и делает его активным в тканях, обеспечивая локальное образование пептидов ангиотензина.54, 66, 67
Поиски новых / альтернативных путей образования и метаболизма ангиотензина привели к открытию ангиотензина (1,12) и (1,25), которые обнаруживаются в сердечно-сосудистой и почечной тканях и служат предшественниками пептидов ангиотензина, таких как AngII (рисунок) .68, 69 Химаза, сериновая протеаза, катализирует образование AngII как из ангиотензина (1,12), так и из AngI, что делает возможным ACE-независимое образование AngII в ткани, и этот путь, вероятно, является первичным генератором ткань AngII.69, 70, 71 Фактически, химаза была названа «наиболее эффективным AngII-образующим ферментом» и высвобождается из тучных клеток, сердечных фибробластов и эндотелиальных клеток сосудов во время острого и хронического повреждения тканей и ремоделирования.72, 73, 74 Химаза активация приводит к профибротическим, антифиброзным или провоспалительным фенотипам, причем точный фенотип или комбинация фенотипов зависит от ткани, природы и времени стресса.75 Химаза играет важную роль в формировании AngII (и профиброзный фенотип) при сердечных заболеваниях.76, 77 Также предполагается, что химаза усугубляет гибель клеток и повреждение митохондрий после сердечной ишемии / реперфузии.78 Кроме того, активация тучных клеток и повышенное высвобождение медиаторов, таких как химаза, вовлечены в патофизиологию кардиометаболических заболеваний, таких как сахарный диабет и ожирение. .79 Фенотип активации химазы отличается в моделях гемодинамической перегрузки у собак и может вносить вклад как в деградацию внеклеточного матрикса, так и в фиброз, способствуя или уравновешивая дилатацию желудочков.80, 81, 82, 83, 84
Пептидный каскад ренин-ангиотензин-альдостероновой системы (RAAS Fingerprint) проиллюстрирован как родословная, начинающаяся с ангиотензина I. Каждое пересечение представляет собой конкретный пептидный фрагмент, обозначенный цветными сферами; ферменты, участвующие в реакциях, отмечены на соединительных линиях. Размер сфер и числа рядом с ними представляют собой абсолютные концентрации ангиотензинов (пг / мл, медианные значения) в образцах сыворотки от 6 здоровых мужчин-гончих среднего возраста; концентрации анализировали масс-спектрометрией.Ангиотензин (1,7) и (1,5) являются продуктами распада как ангиотензина I, так и ангиотензина II. Новые пептиды ангиотензин (1,12) и (1,25) могут быть непосредственно получены из ангиотензиногена и служить предшественниками пептидов ангиотензина, таких как AngII. Альдо, альдостерон; AngI, ангиотензин I; AngII, ангиотензин II; AngIII, ангиотензин III; Ang IV, ангиотензин IV; AP, аминопептидаза; AT 1 R, рецептор ангиотензина типа 1; NEP, нейтральная эндопептидаза
Метаболизм / деградация пептидов ангиотензина представляет интерес, поскольку эти пути могут снижать уровни AngI и AngII и приводить к пептидам, которые являются «активными» и, в некоторых случаях, противоречат активации RAAS.Контррегуляторный путь, ось ACE2-Ангиотензин (1,7) -Mas, в настоящее время исследуется, поскольку он, по-видимому, вызывает защитные действия, включая вазодилатацию и усиление синтеза оксида азота.40, 54 Образование ангиотензина (1, 7) [Ang (1,7)] в сердце и головном мозге возникает в результате процессинга AngII ACE2, тогда как в кровообращении и почках Ang (1,7) возникает в результате процессинга ангиотензина I эндопептидазами, такими как неприлизин.54, 85 Ангиотензин (1,7) и его метаболит Ala 1 -Ang (1,7) связывают Mas- и Mas-связанные рецепторы G-белков и вызывают эффекты, отмеченные выше.86 Экспрессия рецепторов Mas наиболее тщательно изучена на крысах и мышах, где она экспрессируется в головном мозге, семенниках, почках, сердце и сосудах, причем паттерны экспрессии меняются с возрастом.87 Текущие исследования изучают роль этого счетчика -Регуляторный путь в патофизиологии сердечно-сосудистых и почечных заболеваний.
Действие других недавно открытых пептидов ангиотензина также изучается и может выявить фармакологические мишени как для повышающей, так и для понижающей регуляции.Например, AngI также может метаболизироваться ACE2 с образованием Ang (1,9), который, по-видимому, связывается в AT 2 R.88. Кроме того, AngII метаболизируется аминопептидазой A с образованием ангиотензина III, который, как и его родительский пептид способен связывать как AT 1 R, так и AT 2 R.89 Ангиотензин III может затем метаболизироваться до ангиотензина IV через аминопептидазу N. Оба этих пептида ангиотензина приводят к увеличению секреции предсердного натрийуретического пептида, индуцированной растяжением предсердий. на животных моделях с помощью AT 2 R и регулируемой инсулином аминопептидазы соответственно.90, 91 Для более полного обзора RAAS тканей, новых компонентов RAAS и продукции альдостерона в тканях читателя отсылают к другим источникам.40, 42, 54, 55
2.1. Хронобиология пептидов RAAS
и антидиуретических гормонов колеблется с циркадной (примерно 24-часовой) периодичностью.92, 93, 94 Это приводит к дневным и ночным колебаниям скорости потока мочи, экскреции электролитов с мочой и артериального давления. Циркадные «часы» начинаются на клеточном уровне, где регуляторы транскрипции и трансляции вызывают экспрессию множества генов, которые в конечном итоге определяют скорость метаболизма и гомеостаз организма.95 Центральные часы, находящиеся в головном мозге, и локальные клеточные часы реагируют на сигналы окружающей среды и метаболические сигналы, позволяя организму адаптироваться к меняющимся обстоятельствам. Изменчивые во времени колебания гормонов РААС у собак92, 96 аналогичны таковым у людей, и поток мочи и экскреция натрия имеют дневные пики, тогда как осмоляльность мочи и экскреция калия имеют ночные пики. Более поздняя и подробная характеристика хронобиологии этих пептидов показывает, что у собак, которых кормили один раз в день (a.м.) при нормальном приеме пищи с натрием активность ренина и соотношение альдостерона к креатинину в моче (UAldo: C) снижаются после кормления, затем повышаются в течение дня, достигая пика к вечеру.97 Системное артериальное давление колеблется параллельно с пептидами RAAS, увеличиваясь. в первой половине ночи, снижаясь по мере приближения к утру, что противоположно тому, что описано у здоровых взрослых людей.98 Время кормления также влияет на циркадный ритм как РААС, так и системного артериального давления, что позволяет предположить, что диетический натрий является ключевым фактором. посредник этой модуляции.97, 99 Улучшенное понимание хронобиологии РААС имеет значение как для характеристики, так и для количественной оценки активности РААС и, вероятно, будет влиять на время введения лекарственного средства100, 101
2.2. РААС, почечная гемодинамика и функция канальцев
Основные эффекты AngII в почках включают вазоконстрикцию межлобулярной артерии, афферентных и эфферентных артериол (наибольшее влияние на последние), усиленный ответ афферентных артериол на обратную связь по канальцам и клубочкам и сужение клубочков. мезангиум.Конечным результатом этих изменений является увеличение фракции фильтрации. Активация ренин-ангиотензин-альдостероновой системы усиливает реабсорбцию натрия в почечных канальцах с наибольшими эффектами AngII в проксимальном канальце и петле Генле, а эффекты альдостерона наиболее сильны в дистальных извитых канальцах и собирательном канальце. Изменения перфузионного давления почек также могут вызывать биофизические и паракринные эффекты, такие как повышенное образование АТФ, оксида азота и ROS, а также индукция ферментов циклооксигеназы, которые приводят к натрийурезу под давлением.102, 103, 104 Это позволяет почкам «ускользнуть» от удерживающих натрий эффектов избытка AngII (и увеличения продукции альдостерона) .105 Натрийуретические пептиды также уравновешивают увеличение объема крови и высвобождаются как из предсердий, так и из желудочков в присутствии повышенная растяжка. Недавние исследования хронобиологии РААС, а также исследования экспериментальной нагрузки натрия у собак показывают, что циркулирующий и местный РААС может играть более важную роль, чем натрийурез под давлением в физиологическом гомеостазе натрия у этого вида.106, 107, 108
2.3. Оценка активности RAAS
Обычно оцениваемые компоненты RAAS включают в себя активность ренина в плазме, прямые уровни ренина в плазме, концентрации альдостерона в плазме или сыворотке и концентрации AngII, активность АПФ в плазме, соотношение Na + / K + в плазме, 24‐ часовая экскреция альдостерона с мочой и UAldo: C. Совсем недавно жидкостная хроматография-масс-спектрометрия была использована для создания комплексной системы Fingerprint ренин-ангиотензиновой системы (Attoquant Diagnostics GmbH, Вена, Австрия) как по образцам крови, так и по образцам тканей (рисунок).109, 110 Такая комплексная оценка полезна, поскольку рассмотрение только одного или двух компонентов этой системы может ввести в заблуждение. Например, оценка только активности АПФ во время лечения ИАПФ может указывать на очень эффективное подавление, однако AngII и альдостерон действительно «прорывают» это лечение у некоторых пациентов.15, 17, 31, 106, 111, 112 Дополнительная информация относительно метаболизма альдостерона и оценку активности РААС у собак и кошек можно найти во вспомогательной информации этого обзора.
Генетическое профилирование конкретных популяций и людей, вероятно, также будет играть роль в разработке будущих стратегий модуляции RAAS. Оценка генотипа ренин-ангиотензин-альдостероновой системы привела к открытию таких полиморфизмов, как вставка или делеция пары оснований в интрон 16 гена АПФ у людей и собак. Эти инсерционные и делеционные генотипы влияют на исходную активность АПФ и могут влиять на индивидуальный ответ на лечение ИАПФ. Более индивидуальный и комплексный подход к будущей модуляции RAAS должен включать профиль RAAS, генотип RAAS, метаболический профиль и обследование диеты.
3. AngII И ИЗБЫТОК АЛЬДОСТЕРОНА
3.1. AngII и альдостерон как сердечно-сосудистые и почечные токсины
Существует значительный объем доказательств того, что AngII и альдостерон, вероятно, действуя согласованно, являются «кардио- и нефротоксичными» (таблица) .48, 113, 114 Это основано на непосредственном (инфузия гормона, трансгенные животные модели) и косвенные (подавление РААС) доказательства (рисунок и вспомогательная информационная таблица S1). Эти исследования связывают фиброз, который сопровождает аномальное ремоделирование, вызванное избытком AngII и альдостерона, с дисфункцией миокарда, сосудов и почек (особенно клубочков).Механизмы, с помощью которых повышенные уровни AngII и альдостерона приводят к фиброзу, являются многофакторными и, вероятно, включают стимуляцию фибробластов, генерацию ROS, воспаление и активацию факторов транскрипции, таких как ядерный фактор каппа B, цитокинов, таких как трансформирующий фактор роста бета и фактор некроза опухоли. альфа и повышающая регуляция молекул, таких как ингибитор активатора плазминогена-1.12, 115, 116, 117, 118, 119, 120, 121, 122, в конечном итоге, эти изменения приводят к увеличению экспрессии и синтеза гена коллагена, а также к снижению фибринолиза.Избыток AngII и альдостерона также напрямую приводят к дисфункции эндотелия сосудов через сосудосуживающие эффекты AngII, повышенную экспрессию эндотелина, ингибирование синтазы оксида азота, активацию циклооксигеназы-2, усиленное образование ROS и негеномные эффекты, такие как активация протеинкиназы. C.11, 123, 124, 125, 126, 127
Схематическое изображение экспериментов, проведенных Брилла и Вебер7, 268, 269, 270, 271 на крысах с различной функцией почек и экспериментальной гипертензией.A, Нормотензивное контрольное сердце крысы, аорта, почечные артерии, почки и нормальная продукция ангиотензина II и альдостерона; B — модель односторонней ишемии почек (одностороннее бандажирование почечной артерии) с инфраренальным бандажированием аорты; C, инфузия альдостерона с диетой с высоким содержанием натрия; и D — инфраренальное бандажирование. Повышенный уровень циркулирующего ангиотензина II, альдостерона или того и другого наблюдается в моделях B и C, которые характеризуются интерстициальным и периваскулярным фиброзом как гипертрофированного левого, так и негипертрофированного правого желудочка.В модели B ингибитор ангиотензинпревращающего фермента, каптоприл, предотвращал интерстициальный и периваскулярный фиброз у крыс с ишемией почек, но не предотвращал это ремоделирование у крыс, получавших инфузию альдостерона и диету с высоким содержанием натрия (модель C). Когда модели B и C обрабатывались спиронолактоном до и после индукции гипертензии, у крыс развивалась гипертрофия левого желудочка, как и ожидалось, но при этом наблюдался значительно меньший интерстициальный и периваскулярный фиброз миокарда по сравнению с необработанными контрольными животными.ИАПФ, ингибитор ангиотензинпревращающего фермента; Альдо, альдостерон; AngII, ангиотензин II; LV, левый желудочек; ГЛЖ, гипертрофия левого желудочка; MRA, антагонист минералокортикоидных рецепторов; ПЖ, правый желудочек
Активация ренин-ангиотензин-альдостероновой системы также способствует инфильтрации иммунных клеток, что способствует воспалению и фиброзу, которые сопровождают ишемию почек, инфаркт миокарда и системную гипертензию (АГ) .128, 129, 130 Более конкретно, MR на макрофагах участвует в поляризации популяции макрофагов от противовоспалительного подтипа M2 к воспалительному подтипу M1, сохраняя воспаление и ремоделирование тканей.130, 131, 132, 133 Антагонизм или делеция MR макрофага защищает от ремоделирования сердечно-сосудистой системы, даже в ситуациях, когда уровень альдостерона в норме. 130, 131, 132 Окислительный стресс также, по-видимому, усиливает воспаление и напрямую активирует MR или позволяет глюкокортикоидам расти. активировать MR.134, 135 Наконец, избыток альдостерона снижает чувствительность барорецепторов у здоровых людей и собак с экспериментально индуцированной сердечной недостаточностью, что приводит к нежелательному увеличению частоты сердечных сокращений.8, 136, 137 Механизмы, с помощью которых нейрогормональная активация снижает чувствительность барорецепторов, полностью не изучены.136, 138 Снижение чувствительности барорецепторов к частоте сердечных сокращений является ключевой особенностью синдрома сердечной недостаточности139 и является независимым предиктором плохого прогноза у людей с сердечной недостаточностью. .140, 141
Вредные эффекты избытка альдостерона усиливаются, когда соотношение между натрием и альдостероном является ненормальным. В вышеупомянутых исследованиях на животных (таблица, дополнительная информация) натрий варьировался без ограничений или давался в избытке.В нормальных физиологических условиях добавление натрия приводит к ингибированию высвобождения альдостерона, позволяя избытку натрия выводиться почками. Поэтому перед лицом высокого или даже нормального содержания натрия в организме высокий уровень альдостерона неуместен. Дальнейшее обсуждение взаимодействия между альдостероном, уровнем натрия, состоянием метаболизма, воспалением и окислительным стрессом можно найти во вспомогательной информации.
4. ПОДАВЛЕНИЕ РААС
Ингибиторы ангиотензинпревращающего фермента широко используются при лечении сердечно-сосудистых и почечных заболеваний у многих видов.ИАПФ, наиболее часто используемые в ветеринарии, были рассмотрены и суммированы в вспомогательных информационных таблицах S2 и S3.142. Большинство ИАПФ вводятся в качестве пролекарств, требующих этерификации в печени, чтобы стать активными. Лекарства этого класса ингибируют АПФ и не только уменьшают образование AngII, но также уменьшают деградацию вазодилататорного соединения брадикинина. Фармакокинетические свойства ИАПФ сложны, и их распределение при повторном дозировании не может быть охарактеризовано классической некомпартментной моделью.143 Профиль концентрация в плазме — время имеет начальную и длительную фазы выведения из-за клиренса свободного лекарственного средства и высвобождения лекарственного средства из участков связывания с тканью, соответственно.144 Используя активность АПФ в циркулирующей плазме в качестве суррогата эффективности, дозировки были определены для нескольких ACEI у животных (вспомогательные информационные таблицы S2 и S3). Хотя активность циркулирующего АПФ значительно подавляется при этих рекомендуемых дозировках, необходимы клинические испытания для определения эффективности и наличия различий в результатах между ИАПФ.Различная эффективность ИАПФ в снижении сердечно-сосудистых и почечных конечных точек может возникать из-за различий в структуре активных компонентов, их липофильности и биодоступности, аффинности к тканевому АПФ и методах удаления. Однако клиническая значимость этих различий неизвестна. Поскольку АПФ прикреплен к клеточной мембране таким образом, что его каталитический сайт обращен во внеклеточное пространство, 145, 146 различия в липофильности должны быть менее важными, за исключением случая некоторых ИАПФ центрального действия.147 Предполагается, что у людей различия в клинической эффективности ИАПФ связаны с вариациями сродства тканей к АПФ57, и это также может быть верным для собак и кошек. Химаза имеет большую каталитическую эффективность, чем АПФ, и, как полагают, служит основным генератором AngII в тканях и, вероятно, способствует очевидной неэффективности АПФ.74, 148, 149, 150 Дополнительные объяснения спорадической неспособности ИАПФ предотвратить Аномальное ремоделирование как класс включает неадекватное подавление альдостерона (прорыв альдостерона), недостаточное дозирование и плохое соблюдение режима лечения.Как обсуждалось ранее, новые подходы к лечению РААС в тканях-мишенях, вероятно, станут частью будущих фармакотерапевтических стратегий.11, 12, 40 Наиболее частые побочные эффекты ИАПФ у людей включают кашель или ангионевротический отек, или и то, и другое, из-за накопления брадикинина, а также повышенное образование простациклина и оксида азота. Эти побочные эффекты редко, если вообще обнаруживаются у собак и кошек.
Блокаторы рецепторов ангиотензина II препятствуют связыванию AngII его рецептора AT 1 и были разработаны из-за побочных эффектов кашля и ангионевротического отека, наблюдаемых при ингибировании АПФ у людей.Теоретические преимущества БРА включают блокаду действия AngII на AT 1 R, независимо от пути его образования (через АПФ или не-АПФ пути, такие как химаза). Кроме того, повышенный циркулирующий AngII, возникающий в результате блокады AT 1 R, может стимулировать AT 2 R, что, как считается, противоречит дезадаптивным действиям, опосредованным AT 1 R.151. Обычно используемые БРА описаны в разделе «Поддержка». Информационная таблица S4. Как и ИАПФ, некоторые БРА вводят в качестве пролекарств, которые требуют метаболизма до активной молекулы.Неизвестно, превосходят ли БРА над ИАПФ у собак и кошек с сердечно-сосудистыми или почечными заболеваниями, хотя ранний опыт применения телмисартана у кошек с артериальной гипертензией, хроническим заболеванием почек (ХБП) и протеинурией позволяет предположить, что это может иметь место (см. Ниже). ). Недавний метаанализ исследований152, 153, 154, 155 двойного (ИАПФ и БРА) лечения пациентов с сердечной недостаточностью показал, что до тех пор, пока не будут проведены дальнейшие клинические испытания, двойное лечение не следует назначать рутинно.156 Контролируемых клинических испытаний на собаках и кошках, оценивающих комбинацию лечения ИАПФ и БРА, не проводилось.
Спиронолактон и эплеренон являются синтетическими стероидными MRA. Антагонизм к минералокортикоидным рецепторам в клетках дистальных отделов почечных канальцев вызывает увеличение экскреции Na + с мочой и снижение экскреции K + . У нормальной собаки спиронолактон снижает выведение K + , но не увеличивает выведение Na + с мочой и объем мочи даже при высокой дозировке 8 мг / кг / день.157 Однако у собак с хронической сердечной недостаточностью и хроническим избытком альдостерона спиронолактон, вероятно, увеличивает экскрецию натрия с мочой и объем мочи. У собак спиронолактон быстро всасывается через желудочно-кишечный тракт в плазму и затем превращается в несколько активных метаболитов.158, 159 Биодоступность у собак наиболее высока при приеме с пищей, достигая 80-90% .160 Во время экспериментальной модели. При гиперальдостеронизме дозировка спиронолактона 2 мг / кг перорально один раз в день восстанавливала соотношение Na + / K + в моче почти до нормального, и это, вероятно, оптимальная доза для собак.160 Из-за способности спиронолактона связывать рецепторы других стероидных гормонов побочные эффекты у людей включают снижение выработки тестостерона, ингибирование связывания тестостероном его рецептора и повышение уровня эстрадиола, что может вызвать гинекомастию у мужчин и нарушения менструального цикла у женщин161, 162, 163 По этой причине был разработан более селективный МРА — эплеренон. Спиронолактон относительно недорог и является наиболее часто используемым МРА в ветеринарии. Дополнительные фармакологические методы лечения, нацеленные на путь альдостерона / МР, в настоящее время активно исследуются.MRA третьего поколения (финеренон) является многообещающим, поскольку он также модифицирует ко-регуляторы передачи сигналов MR.164 MRA четвертого поколения может обеспечивать еще большую селективность MR, нацеливаясь на MR в определенных тканях и, возможно, модулируя только определенные транскрипционные функции.
Прямые ингибиторы ренина (DRI), такие как алискирен, теоретически предотвращают инициирование ренин-ангиотензинового каскада. Доказано, что DRI первого поколения не являются панацеей от сердечно-сосудистых и почечных заболеваний, однако были разработаны DRI следующего поколения, и в настоящее время проводится оценка их эффективности.165, 166 В настоящее время нет исследований DRI у ветеринарных пациентов. К сожалению, ингибиторы альдостерон-синтазы первого поколения не обладают селективностью и снижают выработку кортизола.167 По этой причине разрабатываются более специфические ингибиторы альдостерон-синтазы следующего поколения.168
Новые модуляторы RAAS включают ингибиторы неприлизина, рекомбинантный человеческий ACE2 и ингибиторы химазы. Ингибирование нейтральной эндопептидазы, неприлизина, снижает распад эндогенных вазоактивных пептидов, включая натрийуретические пептиды, брадикинин и адреномедуллин.Когда ингибитор неприлизина, сакубитрил, был объединен с ИАПФ, частота ангионевротического отека и кашля у людей была неприемлемо высокой.169 Таким образом, новый комбинированный продукт (Entresto) сочетает сакубитрил и ARB валсартан. Эта комбинация была оценена в большом клиническом испытании на людях, где она превосходила только ингибирование АПФ в снижении риска смерти и госпитализации пациентов с сердечной недостаточностью со сниженной фракцией выброса (HFrEF) .170 Этот новый препарат теперь является рекомендацией класса I. для лечения HFrEF у людей.171 У собак с активацией РААС, вторичной по отношению к ограничению натрия, Entresto (сакубитрил в дозе 15 мг / кг перорально каждые 24 часа) приводил к устойчивому снижению уровней циркулирующего альдостерона по сравнению с собаками, получавшими плацебо или валсартан.172 Эта комбинация также оценивалась. (сакубитрил в дозе 20 мг / кг перорально каждые 12 часов) в небольшом исследовании собак с миксоматозным поражением митрального клапана (MMVD) стадии B2 Американского колледжа ветеринарной медицины (ACVIM) 173 (рисунок) и хорошо переносился в течение 30 дней. пробный.174 Другой новой терапевтической мишенью является фермент ACE2. Этот фермент считается противорегулирующим по отношению к сосудосуживающим и удерживающим жидкость аспектам РААС, поскольку он катализирует превращение AngII в сосудорасширяющий, противовоспалительный, антифиброгенный пептид Ang (1,7) (рисунок) .175, 176, 177 , 178 Человеческий рекомбинантный ACE2 был оценен в одном небольшом исследовании с участием людей с острой и хронической сердечной недостаточностью, где было обнаружено, что он нормализует уровни AngII и увеличивает уровни полезного метаболита Ang (1,7).110 Наконец, основываясь на вероятной роли химазы в локальном образовании пептидов ангиотензина, таких как AngII, ингибиторы химазы предлагают дополнительный подход к модуляции RAAS при сердечно-сосудистых и почечных заболеваниях. Помимо сакубитрила / валсартана, эти новые модуляторы РААС еще не тестировались на ветеринарных пациентах.
Классификация сердечных заболеваний Американского колледжа внутренней ветеринарной медицины (ACVIM). От риска сердечной недостаточности до рефрактерной сердечной недостаточности173
4.1. Сердечные заболевания
Исследования на людях показали преимущества ИАПФ при лечении систолической сердечной недостаточности, связанной с клиническими признаками от умеренной до тяжелой179 и от легкой до умеренной. 180, 181 Ветеринарные клиницисты имели опыт применения эналаприла, каптоприла, беназеприла, лизиноприл, имидаприл, алацеприл и рамиприл (вспомогательные информационные таблицы S2 и S3). Из них только эналаприл и беназеприл и в меньшей степени имидаприл и рамиприл были тщательно изучены. Преимущества ингибирования АПФ как части лечения сердечной недостаточности были продемонстрированы в многочисленных плацебо-контролируемых клинических испытаниях на собаках с сердечной недостаточностью (рисунок).182, 183, 184, 185, 186 Первое рандомизированное плацебо-контролируемое клиническое испытание по оценке эналаприла у собак с застойной сердечной недостаточностью (ЗСН), вызванной естественным сердечным заболеванием (MMVD или дилатационная кардиомиопатия [DCM]), показало улучшение в краткосрочные клинические и гемодинамические переменные (а именно, показатели давления заклинивания легочных капилляров и отека легких) .187 Последующее исследование показало, что эналаприл был связан с улучшением нескольких клинических показателей (включая классификацию сердечной недостаточности, оценку отека легких, подвижность, отношение и частота кашля).185 Улучшение всех этих переменных было значительным в группе DCM, тогда как только улучшение параметров кашля и подвижности достигло значимости в группе MMVD.185 Два рандомизированных плацебо-контролируемых исследования на собаках с CHF, вызванной MMVD или DCM, впоследствии показали улучшение в время выживания и задержка времени до обострения сердечной недостаточности.183, 184 Это преимущество больше не было статистически значимым, когда анализировалась только подгруппа DCM, однако небольшое количество в группах DCM в этих исследованиях затрудняет интерпретацию этого результата и более крупные исследования подавления RAAS в DCM.Дополнительные исследования показали, что имидаприл не уступает эналаприлу и беназеприлу.182, 186 В базовом исследовании FDA США (двойное слепое и активный контроль) исходы у собак при ХСН, вызванной MMVD и DCM, сравнивались между этими результатами. получавших эналаприл плюс стандартную терапию, по сравнению с теми, кто получал стандартное лечение плюс инодилататор, пимобендан (Ветмедин) .188 Не было различий между группами лечения в первичной конечной точке успеха лечения или в оценках сердечной недостаточности и отека легких.Общее количество смертей, вызванных ХСН в конце исследования (56-й день), было идентичным между группами и составляло 14%. Последующее европейское исследование, сравнивающее пимобендан и ИАПФ, беназеприл, показало умеренное улучшение выживаемости у пациентов, получавших пимобендан.189
Семь клинических испытаний по подавлению ренин-ангиотензин-альдостероновой системы (РААС), 6 из которых плацебо-контролируемого, двойного слепого, многоцентрового дизайна, взяты из оригинальных публикаций 37, 182, 183, 184, 185, 186 , 190, 191, 192, 210 Все исследования финансировались фармацевтическими компаниями.
Первые 4 кривые Каплана-Мейера представляют испытания с участием собак с застойной сердечной недостаточностью (Американский колледж внутренней ветеринарной медицины [ACVIM], стадия C2; застойная сердечная недостаточность [CHF]), вызванной миксоматозной болезнью митрального клапана (MMVD) или дилатационная кардиомиопатия (ДКМП). Только 4-я панель состояла исключительно из собак с ММВД. Все исследования в панелях с 5 по 7 были полностью выполнены на собаках с бессимптомными MMVD (ACVIM, стадия B). На панелях 1 и 2 представлены проспективные двойные слепые клинические испытания эналаприла.Хотя третий график содержит данные ретроспективного исследования собак, получавших беназеприл, по сравнению с собаками, которых не лечили в ACVIM стадии B1.
Симптоматическое (панели с 1 по 4)
Панель 1. Исследование LIVE было одним из первых плацебо-контролируемых двойных слепых клинических испытаний в ветеринарной кардиологии. Значительное улучшение выживаемости (смерть или исключение из исследования) было зарегистрировано в популяции собак с ХСН (ACVIM, стадия C2), вызванной MMVD или DCM, при лечении эналаприлом плюс стандартное лечение по сравнению с плацебо плюс стандартное лечение.Плацебо плюс стандартное лечение, пунктирная линия. Эналаприл плюс стандартное лечение, сплошная линия.
Панель 2. В исследовании BENCH сравнивали беназеприл с плацебо у собак с ХСН, вызванной MMVD или DCM, и было продемонстрировано значительное улучшение выживаемости (время до смерти или исключения из исследования в случае ухудшения клинических признаков) и качества жизни в собаки, получающие беназеприл. Плацебо плюс стандартное лечение, пунктирная линия. Беназеприл плюс стандартное лечение, сплошная линия.
Панель 3. В ПЕРВОМ (плацебо-контролируемое, двойное слепое) и EFFIC (открытое) исследованиях, соответственно, сравнивали имидаприл (сплошная линия) или рамиприл (не показан) с установленным ингибитором ангиотензинпревращающего фермента (ИАПФ), эналаприлом (пунктирная линия). линия), при лечении собак с MMVD или DCM, стадия 2-4 NYHA.Данные показаны только для 12-месячного плацебо-контролируемого исследования FIRST. Оба исследования продемонстрировали сопоставимые показатели выживаемости и качества жизни между имидаприлом и контрольным ИАПФ.
Панель 4. Испытание спиронолактона CEVA сравнивало спиронолактон плюс стандартное лечение (включая беназеприл) с плацебо в проспективном двойном слепом исследовании с участием собак по классификации Международного совета по охране здоровья мелких животных ISACHC, II и III, вызванного MMVD. В целом у этих собак была относительно легкая сердечная недостаточность.Как и в исследовании RALES, у собак, получавших спиронолактон наряду со стандартным лечением, было достигнуто значительное улучшение выживаемости. Плацебо плюс стандартное лечение, пунктирная линия. Стандартное лечение плюс спиронолактон, сплошная линия.
Бессимптомно (панели с 5 по 7)
Панель 5. Испытание SVEP включало примерно 50:50 распределение собак с ACVIM Стадия B1 и Стадия B2 (бессимптомная), с обработанными собаками, получавшими эналаприл в дозировке 0,37 мг / кг / сут.190 Из этих 229 собак (все кавалер-кинг-чарльз-спаниели) примерно 45% достигли определенной конечной точки — начала ЗСН. 2% -ное преимущество, наблюдаемое в количестве дней, в течение которых собаки оставались в исследовании без ЗСН, между собаками, получавшими плацебо и эналаприл, было незначительным (лог-ранговый тест, P = 0,85). Плацебо, пунктирная линия. Эналаприл, сплошная линия.
Панель 6. VETPROOF сравнил эналаприл с плацебо в двойном слепом плацебо-контролируемом исследовании собак в ACVIM B2. Представлен график, изображающий комбинированную конечную точку выживаемости (смерть от всех причин и выживаемость без ЗСН), выраженную в виде кривой Каплана-Мейера, для 124 собак, которые соответствовали критериям отбора.Среднее время достижения этой комбинированной конечной точки в группах лечения и плацебо составляло 851 и 534 дня (59% разница в 317 дней [10,6 месяцев] в отношении сердечной недостаточности и выживаемости), соответственно ( P = 0,05). Первичная конечная точка (время до начала ЗСН) увеличивалась при приеме эналаприла по сравнению с плацебо, но не была значимой ( P = 0,06). Однако количество собак, не страдающих ЗСН, значительно различались между группами на 500-й и 1000-й дни, как и кривые, отражающие общую смертность.Плацебо, пунктирная линия. Эналаприл, сплошная линия.
Панель 7. Кривые выживаемости Каплана-Мейера для собак, получавших беназеприл (сплошная линия) или не получавших лечения (плацебо, пунктирная линия), после первоначального диагноза MMVD класса Ia (ACVIM Стадия B1) по ISACHC, с митральным поражением средней и тяжелой степени тяжести. регургитация, продемонстрированная с помощью эхокардиографии. Хотя ретроспективно, это исследование демонстрирует задержку начала ХСН в группе лечения. Это повышает вероятность того, что ИАПФ может быть полезным даже до того, как станет очевидным ремоделирование сердца, и поддерживает использование ИАПФ при MMVD, до начала застойной сердечной недостаточности
Хотя использование ИАПФ при ХСН у собак является общепринятым, данные по ИАПФ менее устойчивы для собак с сердечными заболеваниями до начала ЗСН (стадии A и B ACVIM; рисунок).Было проведено 4 исследования, посвященных этому вопросу, 2 проспективных двойных слепых плацебо-контролируемых исследования (эналаприл по сравнению с плацебо) и 2 ретроспективных исследования (беназеприл по сравнению с отсутствием лечения). Результаты исследований MMVD представлены на рисунке. Первый из них рассматривал собак с MMVD, где примерно половина были ACVIM стадии B1, а половина — стадией B2. Дозировка эналаприла составляла 0,37 мг / кг / сут.190 Из этих 229 собак (все кавалер-кинг-чарльз-спаниели [CKCS]) 43 и 42% в группах лечения и плацебо, соответственно, достигли конечной точки — начала ЗСН.Второе исследование, 191 также являющееся плацебо-контролируемым двойным слепым исследованием на собаках с MMVD, включало 23 породы, при этом у всех 124 собак было выявлено сердечное заболевание ACVIM стадии B2. Группа лечения получала эналаприл в средней дозе 0,45 мг / кг / сут. Результатом было значительное ( P <0,02) улучшение смертности от всех причин.191 Ретроспективное исследование собак с ACVIM стадии B1 MMVD, которые получали либо ИАПФ (беназеприл), либо не получали лечения, пришло к выводу, что собаки, получавшие беназеприл имели значительно более длительное время выживания и меньшее количество сердечных приступов, включая сердечную смерть.192 Ретроспективное исследование 91 добермана-пинчера с оккультным ДКМП, которые получали либо ИАПФ (беназеприл), либо не получали лечения, показало, что у собак, получавших беназеприл, медиана времени до начала явной ДКМП была значительно больше.
В вышеупомянутом ретроспективном исследовании 192 CKCS не выиграла от подавления RAAS по сравнению с другими породами. Это поднимает вопрос о фармакогеномных различиях между породами собак. Недавно был описан однонуклеотидный полиморфизм в интроне 16 гена ACE в группе из 31 собаки (включая 10 CKCS).194 Активность АПФ у собак с полиморфизмом была значительно ниже, чем у собак без него, однако в обеих группах наблюдалось значительное подавление активности АПФ после 2 недель лечения ИАПФ. Шесть из 10 CKCS несут в себе полиморфизм, который обеспечивает поддержку концепции, которой придерживаются некоторые, о том, что RAAS CKCS может не полностью представлять вид в целом. Необходимы дальнейшие исследования, чтобы определить, влияют ли различия в фенотипах РААС на ответ на лечение, подавляющее РААС, и на естественную историю сердечных заболеваний у этой породы.
У собак с экспериментально созданной митральной регургитацией лечение каптоприлом приводило к падению общего индекса периферического сопротивления, уменьшению фракции регургитации и увеличению фракции прямого выброса по сравнению с необработанной контрольной группой.195 И наоборот, использование ИАПФ или БРА. В других исследованиях экспериментально созданной митральной регургитации у собак было обнаружено обострение дилатации левого желудочка и потери внеклеточного матрикса.82, 83 Эти модели от острой до подострой добавляют ценную информацию о патофизиологии перегрузки объемом левого желудочка из-за митральной регургитации, но дальнейшее исследование необходим пациентам с естественным MMVD.В целом эффект ингибирования АПФ при доклиническом MMVD может быть различным у собак. Хотя улучшение может быть результатом уменьшения постнагрузки, уменьшения размера отверстия регургитации и антифиброзного эффекта на более поздних стадиях, пагубные эффекты могут возникать из-за блокады инотропных эффектов AngII и возможного усиления деградации внеклеточного матрикса и нарушения стабильности миоцитов в ранние стадии ремоделирования75.
В недавно завершенном плацебо-контролируемом двойном слепом исследовании EPIC участвовали собаки различных пород с ACVIM стадии B2 MMVD с рентгенографическими и эхокардиографическими доказательствами кардиомегалии.Это исследование показало, что инодилататор пимобендан значительно продлил доклинический период в этой когорте собак.196 По сравнению с ветеринарным испытанием эналаприла, доказывающим снижение частоты сердечной недостаточности (VETPROOF), испытание EPIC имело более строго определенные критерии включения кардиомегалии и было зарегистрировано. более чем в 2,5 раза больше собак. Относительно узкий 95% доверительный интервал отношения рисков для компонента ЗСН первичной конечной точки в исследовании EPIC подтверждает преимущество пимобендана в исследуемой когорте.Аналогичный анализ опасностей недоступен для данных VETPROOF.
Три крупных исследования на людях197, 198, 199 показали явную пользу от включения более широкой супрессивной терапии RAAS в лечение HFrEF с добавлением MRA к стандартному лечению, включая ACEI или ARB. В новаторских рандомизированных исследованиях по оценке альдактона (RALES) (ишемическая и неишемическая болезнь сердца, NYHA III-IV) и EPHESUS (постинфаркт миокарда) оценивали пациентов с тяжелой сердечной недостаточностью.В исследовании EMPHASIS-HF (ишемическая и неишемическая болезнь сердца) оценивались пациенты с HFrEF от легкой до умеренной степени. В этих исследованиях MRA (спиронолактон или эплеренон) был добавлен к оптимальному лечению сердечной недостаточности, включая подавление RAAS (либо ACEI, либо ARB) и бета-блокаду в последних двух исследованиях. Каждое из этих 3 исследований показало снижение смертности и госпитализаций, связанных с кардиологическими заболеваниями. Эти значительно положительные результаты привели к тому, что в недавних рекомендациях было рекомендовано использовать MRA в качестве стандартной терапии при лечении HFrEF.200 Кроме того, клиническая польза, связанная с добавлением MRA в этих исследованиях, была замечена у людей с нормальным, низким и повышенным уровнем альдостерона в крови в начале исследования. Изменения нейрогормональных профилей пациентов во время хронического лечения спиронолактоном отслеживались в подгруппе пациентов в исследовании RALES.201 У пациентов в группе спиронолактона наблюдалось значительное повышение уровней циркулирующего AngII и альдостерона через 3 и 6 месяцев по сравнению с людьми, получавшими плацебо.Предполагалось, что это увеличение является результатом неспособности генерируемой альдостероном петли отрицательной обратной связи снизить секрецию ренина из юкстагломерулярного аппарата, хотя местное тканевое производство AngII и альдостерона также может вносить свой вклад. Поскольку спиронолактон увеличивает выживаемость, влияние этого гормона, вероятно, смягчается антагонизмом MR. В настоящее время неизвестно, имеют ли эти повышенные концентрации циркулирующего AngII и альдостерона, вторичные по отношению к рецепторному антагонизму, какие-либо рецепторнезависимые эффекты.
В среднем, концентрации альдостерона в плазме у собак с естественным MMVD и DCM (как бессимптомным, так и с CHF) выше, чем у контрольной группы.35, 202 У собак с сердечной недостаточностью, вызванной MMVD, одно исследование показало, что в среднем, у собак, получавших эналаприл, было начальное снижение концентрации альдостерона в плазме при первом повторном обследовании через 3 недели лечения. За этим последовало повышение средней концентрации альдостерона в плазме выше исходного уровня через 6 месяцев после начала лечения.37 Другое исследование, однако, показало значительное снижение концентрации альдостерона в плазме у всех, кроме 1 из 7 собак с MMVD и CHF, после начала приема каптоприла.35 Кроме того, исследования на собаках с использованием фармакологической активации RAAS и экспериментально индуцированной сердечной недостаточности обнаружили повышение уровня альдостерона. уровни, несмотря на лечение ИАПФ.38, 203, 204, 205, 206, 207 Независимо от частоты, хроническая нейрогормональная активация имеет последствия и связана с аномальным ремоделированием у собак с естественными сердечными заболеваниями.208 В целом, эти данные добавляют поддержку дополнительному использованию MRA у собак с сердечными заболеваниями. Хотя низкие дозы спиронолактона (0,5 мг / кг перорально каждые 24 часа) не оказали значительного влияния на выживаемость у собак с запущенной ХСН, вызванной либо MMVD, либо DCM, последующее двойное слепое плацебо-контролируемое полевое исследование у 212 собак с MMVD и сердечным ритмом от легкой до умеренной степени. неудача продемонстрировала значительное снижение риска заболеваемости и смертности от сердечных заболеваний при добавлении спиронолактона (2 мг / кг перорально каждые 24 часа) к «стандартной терапии» (ИАПФ, фуросемид ± дигоксин).209, 210
Роль спиронолактона в лечении сердечной недостаточности, вызванной желудочковой диастолической дисфункцией с сохраненной фракцией выброса (HFpEF), является областью постоянных исследований. Патологическая активация РААС и, в частности, гиперальдостеронизм вовлечены в патологическое ремоделирование желудочков и диастолическую дисфункцию миокарда при гипертрофической кардиомиопатии (ГКМП) у людей.122 Небольшие исследования на людях с HFpEF показали, что блокада МР спиронолактоном улучшает диастолическую функцию. .211, 212 Добавление спиронолактона к существующему лечению сердечной недостаточности недавно было оценено в большом плацебо-контролируемом двойном слепом исследовании людей с симптоматической HFpEF (за исключением инфильтративных или гипертрофических кардиомиопатий). Это исследование не привело к значительному увеличению выживаемости или уменьшению количества госпитализаций по поводу сердечной недостаточности. Однако наблюдались существенные различия в реакции пациентов между географическими регионами, и апостериорный анализ подгрупп вызывал опасения по поводу различий в фактическом применении спиронолактона и тяжести сердечной недостаточности (менее тяжелой) у пациентов из России / Грузии.213, 214, 215 В целом частота госпитализаций по поводу сердечной недостаточности была значительно ниже в группе спиронолактона в целом, а использование спиронолактона было связано со значительным улучшением качества жизни. 213, 216 В отдельном исследовании у пациентов с HFpEF спиронолактон был связан с улучшением переносимости физической нагрузки.217 Второе клиническое испытание спиронолактона в лечении HFpEF продолжается (https://clinicaltrials.gov/ct2/show/{«type»:»clinical-trial «, «attrs»: {«текст»: «NCT024″, «term_id»: «NCT024″}} NCT024? term = SPIRRIT & rank = 1).
Концентрация альдостерона в плазме выше нормы у кошек породы мейн-кун с бессимптомным ГКМП. 218 Краткосрочное (4 месяца) применение спиронолактона (2 мг / кг перорально каждые 12 ч) у этих бессимптомных кошек, однако, не привело к снижению левожелудочкового кровотока. масса тела или улучшение эхокардиографических параметров диастолической функции, и у 4 из 13 кошек, получавших спиронолактон, развился язвенный дерматит лица.219 В недавнем двойном слепом плацебо-контролируемом клиническом исследовании была проведена оценка использования спиронолактона (1.От 7 до 3,3 мг / кг перорально каждые 24 часа) у принадлежащих клиенту кошек с сердечной недостаточностью, вызванной кардиомиопатией, большинство из которых страдали HCM220. Все кошки (n = 20) также получали фуросемид и ИАПФ. Значительно меньше кошек, получавших спиронолактон, достигло первичной конечной точки (смерть от сердечно-сосудистых заболеваний) по сравнению с кошками, получавшими плацебо. Кроме того, ни у одной кошки, получавшей спиронолактон, не было язвенного дерматита лица. Из-за небольшого размера выборки и различий в тяжести заболевания между двумя группами на исходном уровне авторы пришли к выводу, что эти результаты являются многообещающими, однако необходимы дополнительные исследования по оценке спиронолактона у кошек с ГКМП и сердечной недостаточностью.
4.2. Системная гипертензия
Было показано, что подавление активности РААС с помощью ИАПФ, БРА и МРА по отдельности или в комбинации улучшает контроль артериального давления у людей с АГ. 221, 222, 223 В то время как у людей АГ обычно является первичной (необходимой), у у собак и кошек это обычно вторично по отношению к основным почечным или эндокринным заболеваниям. У собак АГ, вторичная по отношению к ХБП, часто лечится с помощью подавления РААС (ИАПФ или БРА) .224 Гиперадренокортицизм является распространенным эндокринным заболеванием у собак и часто осложняется АГ, особенно у собак с нелеченными опухолями коры надпочечников.225, 226 Механизмы, задействованные в АГ у собак с гиперадренокортицизмом, являются многофакторными, и общий подход к лечению — применение одного ИАПФ или в комбинации с амлодипином. Собаки с опухолями надпочечников имеют значительно более высокие концентрации альдостерона в плазме по сравнению с нормальными собаками и собаками с гипофизарно-зависимым гиперадренокортицизмом, 226 и могут получить пользу от добавления MRA. Роль гиперальдостеронизма у собак с гипертензией, вторичной по отношению к гипофизозависимому гиперадренокортицизму, неясна, 226, 227, 228, поскольку АГ часто сохраняется, несмотря на медикаментозное лечение и контроль гиперадренокортицизма.225 В этих случаях следует рассмотреть возможность заключения соглашения MRA.
У кошек АГ обычно является вторичной по отношению к заболеванию почек, эндокринной болезни или и того, и другого. У этого вида АГ является частой причиной гипертрофии левого желудочка, диастолической дисфункции и других повреждений органов-мишеней. Было показано, что концентрация альдостерона в плазме и соотношение альдостерона к ренину у кошек с азотемной гипертензией значительно повышены по сравнению с кошками с нормальным АГ. активности ренина плазмы, которая фактически была низкой (подавлена).В этой группе с низким содержанием ренина концентрации альдостерона у кошек были недостаточно высокими, чтобы поддерживать первичный гиперальдостеронизм. Скорее, их нейрогормональный профиль был подобен профилю гипертензии с низким содержанием ренина, которая непропорционально диагностируется у людей африканского происхождения. У людей гипертензия с низким содержанием ренина чаще всего возникает из-за эссенциальной гипертензии с низким содержанием ренина или первичного альдостеронизма. У людей MRA, эплеренон, и ARB, лозартан, эквивалентны по снижению артериального давления у пациентов с высоким содержанием ренина, однако эплеренон превосходит лозартан у пациентов с низким содержанием ренина.230 Несмотря на это, авторам неизвестны исследования, в которых использовалось лечение МРА у кошек с гипертонией.
Недавнее исследование на нормальных лабораторных кошках показало, что БРА, телмисартан и ирбесартан, а также ИАПФ, беназеприл, значительно ослабляли анги-индуцированный ответ артериального давления, тогда как лозартан — нет. 231 Эффект телмисартана был значительно выше, чем эффект от приема лозартана. остальные 3 препарата через 90 минут после перорального приема. Телмисартан и беназеприл также сравнивали через 24 часа после их перорального приема, и телмисартан, опять же, привел к более значительному ослаблению индуцированного AngI повышения артериального давления.Недавнее клиническое полевое исследование показало, что телмисартан переносится и снижает среднее артериальное давление по сравнению с плацебо у кошек с АГ, которая была либо идиопатической, либо вторичной по отношению к ХБП или гипертиреозу.232 В это исследование не включались кошки с артериальным давлением до лечения> 200 мм рт. в этой когорте все еще требуется исследование. Наконец, активация циркулирующего РААС у кошек не всегда связана с развитием гипертонии, как показали исследования кошек с гипертиреозом и ХБП.233, 234 Амлодипин, широко используемый гипотензивный агент как у собак, так и у кошек, как известно, вызывает повышение уровня альдостерона у здоровых собак, 38 однако, по-видимому, этого не происходит у кошек с естественной АГ. Роль РААС при гипертонии у кошек представляется сложной и пока еще недостаточно определена.
Добавление MRA все чаще применяется у людей с резистентной артериальной гипертензией, уже получающих ИАПФ, БРА или и то, и другое.221, 222, 223 Недавно завершенное рандомизированное плацебо-контролируемое клиническое исследование показало, что спиронолактон превосходит добавление любого из них. бета-блокатор или альфа-1-блокатор у пациентов с резистентной АГ (сохраняется, несмотря на тройное лечение АПФ, БРА и блокатором кальциевых каналов).235 Из этого исследования следует, что спиронолактон является лучшим дополнительным препаратом для лечения такой резистентной АГ. Дополнительное лечение антагонистами минералокортикоидных рецепторов у собак и кошек с АГ еще не проводилось.
4.3. Протеинурическая болезнь почек
Протеинурия, маркер повреждения почек, вероятно, является предиктором повышенного риска прогрессирования заболевания и может играть причинную роль в прогрессировании гломерулярной болезни. 236, 237, 238 Клинические испытания, включающие подавление РААС у людей с протеинурией. Заболевания почек обобщены в вспомогательной информационной таблице S5.У людей комбинация ИАПФ и БРА обычно более эффективна для снижения протеинурии при различных формах заболевания почек, чем любое лечение по отдельности. Однако снижение протеинурии не всегда приводит к улучшению почечных исходов (потребность в диализе, повышение креатинина и снижение расчетной скорости клубочковой фильтрации [СКФ]) и иногда связано с увеличением частоты гиперкалиемии и острого повреждения почек по сравнению с монотерапия. 239, 240 Было показано, что добавление MRA к ACE или ARB (отдельно или вместе) увеличивает снижение протеинурии у людей с АГ, диабетической нефропатией или ХБП с и без АГ.241, 242 Однако добавление МРА к ИАПФ или БРА увеличивает риск гиперкалиемии у пациентов с ХБП.113 Влияние финренона на сердечно-сосудистые и почечные исходы у людей с диабетической болезнью почек в настоящее время оценивается в двух крупных исследованиях. Проспективные рандомизированные исследования шкалы (https://clinicaltrials.gov/ct2/show/{«type»:»clinical-trial»,»attrs»:{«text»:»NCT02545049″,»term_id»:»NCT02545049 «} } NCT02545049? Term = figaro & cond = Диабетик + почки + заболевание & rank = 1 и https: // клинические испытания.gov / ct2 / show / {«type»: «клиническое испытание», «attrs»: {«text»: «NCT02540993», «term_id»: «NCT02540993»}} NCT02540993? term = finerenone & cond = Diabetic + Kidney + Disease & rank = 1). Комбинированное подавление РААС и добавление МРА к стандартной фармакотерапии не изучались у собак и кошек с естественным заболеванием почек.
Преимущество супрессивного лечения RAAS при протеинурии у собак, включая идиопатический гломерулонефрит, было продемонстрировано на экспериментальных моделях и небольших клинических исследованиях.243, 244, 245, 246 У собак без нефрэктомии, с экспериментально индуцированным сахарным диабетом и вытекающей из этого протеинурией, лечение лизиноприлом снижало давление в капиллярах клубочков, ослабляло развитие гипертрофии клубочков и значительно снижало протеинурию по сравнению с необработанными собаками. / 6-нефрэктомия на модели ХБП, собаки, получавшие эналаприл, в среднем имели систолическое АД на 5-15 мм рт.ст. ниже, чем у их нелеченых собратьев. Эта разница была значительной через 3 месяца, но не через 6 месяцев.Кроме того, у обработанных собак было более низкое соотношение белка в моче и креатинина (UP: C) и значительно более низкие показатели поражения почечных канальцев и клубочков.243 Беназеприл значительно снижал азотемию и системное кровяное давление в краткосрочном исследовании экспериментальной почечной недостаточности у собак, вызванной Модель нефрэктомии 7/8 при ХБП.247 В двойном слепом рандомизированном клиническом исследовании собак с подтвержденным биопсией, мембранозным и мембранопролиферативным гломерулонефритом лечение эналаприлом значительно снизило артериальное давление, UP: C и UP: C с поправкой на СКФ, тогда как в группе плацебо эти показатели выросли.245 В другом исследовании беназеприла по сравнению с плацебо у собак с ХБП лечение беназеприлом было связано со значительным увеличением СКФ в течение 180-дневного исследования, чего не наблюдалось в группе плацебо.246 В этом исследовании авторы предполагают, что повышение СКФ могло быть из-за снижения клубочковой капиллярной гипертензии, снижения высвобождения внеклеточного матрикса и коллагена из мезангиальных и канальцевых клеток, а также снижения клубочкового и интерстициального фиброза, хотя эти факторы не оценивались напрямую.
Степень протеинурии у собак с впервые диагностированной ХБП, по-видимому, связана с прогнозом, 248 поскольку снижение протеинурии может продлить выживаемость. Известно, что собаки с UP: C> 1.0 имеют относительный риск уремического криза или смерти в 3 раза больше, чем собаки с UP: C <1.0. В небольшом исследовании Х-сцепленного наследственного нефрита у собак, получавших высокие дозы эналаприла (2 мг / кг перорально каждые 12 часов), протеинурия прогрессировала значительно медленнее, и они жили значительно дольше, чем те, которые не получали лечения.249 По этим причинам в настоящее время хорошо известно, что ИАПФ, хронически вводимый как людям, так и ветеринарным пациентам с естественным протеинурическим заболеванием почек, является полезным. 245, 247, 250, 251, 252, 253, 254, 255 Механизмы этого улучшения постулируется, что это антигипертензивный эффект, снижение индуцированной AngII пролиферации мезангиальных клеток и сосудорасширяющее действие ACEI на почки; последнее приводит к вызванному лечением падению почечного фильтрационного давления и протеинурии.250, 252, 253 Следовательно, подавление РААС с помощью ИАПФ или, реже, БРА считается стандартом лечения собак с гломерулярным заболеванием, а снижение протеинурии считается суррогатной терапевтической конечной точкой.256 Ни двойная блокада РААС с помощью ИАПФ и БРА, ни добавление МРА к стандартной фармакотерапии не изучались у собак с естественным заболеванием почек. Для оценки эффекта этих комбинаций необходимы контролируемые исследования. Нет единого мнения в отношении супрессивного лечения РААС у собак с непротеинурической ХБП.
RAAS активируется при экспериментальной и естественной ХБП у кошек. 234, 257 Беназеприл был протестирован на кошках с ХБП (протеинурической и непротеинурической), он хорошо переносится и значительно снижает протеинурию.258 Хотя в этом исследовании не было документально подтверждено положительное влияние лечения беназеприлом на выживаемость почек (конечная точка смерти или эвтаназии, вызванной заболеванием почек или необходимостью парентеральной инфузионной терапии), время выживания почек было обратно пропорционально начальному UP: C. Важно отметить, что протеинурия предсказывает прогрессирование азотемии259 и отрицательно связана с выживаемостью у кошек с хроническим заболеванием почек260 и с АГ.261 Совсем недавно БРА, телмисартан, сравнивали с беназеприлом у кошек с ХБП и протеинурией.262 Телмисартан не уступал беназеприлу в предотвращении увеличения протеинурии в течение 6-месячного периода лечения и приводил к значительному снижению протеинурии во всех временных точках, тогда как снижение, наблюдаемое в группе беназеприла, не достигло значимости. Как и у собак, комбинированная блокада RAAS у кошек не оценивалась. Наконец, было показано, что беназеприл снижает азот мочевины в крови, концентрацию креатинина в сыворотке и артериальное давление у кошек с поликистозом почек.255 Это резко противоречит результатам, полученным при поликистозе почек у человека, при котором пациенты, страдающие таким заболеванием, не получали пользы от лечения. Ингибирование АПФ.253
4.4. Безопасность супрессивного лечения РААС
На основании клинического опыта применения ИАПФ мы узнали, что их негативное влияние на функцию почек минимально, даже в условиях тяжелой сердечной недостаточности. Когда наблюдается азотемия, ИАПФ обычно назначают в сочетании с диуретиками, ограничителями натрия и иногда вазодилататорами, что часто приводит к гипотензии. Обычно прекращение приема диуретиков или уменьшение дозировки приводит к улучшению или разрешению азотемии.263 В исследованиях эналаприла при заболеваниях сердца III и IV фаз по NYHA (сердечная недостаточность от умеренной до тяжелой), вызванных MMVD и DCM, на самом деле частота азотемии в группах, получавших эналаприл, была ниже, чем в группах, получавших плацебо.183, 185 , 187 Кроме того, при плацебо-контролируемой двойной слепой оценке эналаприла (средняя доза 0,45 мг / кг / сут) у пожилых собак мелких пород с MMVD стадии B2 ACVIM (рисунок) не было различий между группами по среднему уровню сыворотки крови. Концентрация креатинина в любой момент времени, количество собак, у которых развивается почечная недостаточность, или изменение сывороточного креатинина (оценивается каждые 3 месяца в течение исследования; вспомогательная информация, рисунок S2).264
Анализ безопасности собак, участвовавших в исследовании Бернея и его коллег, показал, что те, кто получал спиронолактон, в дополнение к стандартному лечению (включая ИАПФ), не подвергались более высокому риску нежелательных явлений (таких как смерть от почечной недостаточности и аномалий в сывороточный натрий, калий, азот мочевины и креатинин) по сравнению с собаками, получавшими плацебо и стандартное лечение.265 Фактически, смертность, вызванная сердечным заболеванием, заболеванием почек или обоими заболеваниями, была ниже в группе, получавшей спиронолактон.Важно отметить, что у собак, получавших спиронолактон в дополнение к традиционному лечению сердечной недостаточности (петлевой диуретик, ИАПФ и пимобендан), не было более высокой частоты гиперкалиемии. В исследовании доберманов-пинчеров с скрытым DCM, значительное увеличение концентрации калия в сыворотке (по сравнению с индивидуальными исходными значениями) было замечено у собак, получавших как спиронолактон, так и ACEI.266 Хотя авторы считали эти изменения клинически незначительными, концентрация калия в сыворотке превышала референтный интервал у 50% собак и регулярный мониторинг сывороточных электролитов и показателей почек (каждые 3 месяца) были рекомендованы доберман-пинчерам, получающим спиронолактон и ИАПФ.В целом, регулярный мониторинг сывороточных электролитов и показателей почек целесообразен у всех животных, получающих вазодилататоры и диуретики, включая спиронолактон и ИАПФ. Наконец, спиронолактон в сочетании с ИАПФ кажется безопасным при использовании для лечения собак с естественным бессимптомным MMVD, а также с скрытым DCM, без предшествующей азотемии.266, 267
Схема системы ренин-ангиотензин-альдостерон и сайты …
Предыстория: SARS-CoV-2 является новым патогеном, а коронавирусная болезнь 2019 (COVID-19) объявлена глобальной пандемией.Мы стремимся обобщить текущие данные о риске смерти и тяжести COVID-19, а также о факторах риска тяжелого COVID-19. Методы: в базах данных PubMed, Embase и Web of Science, а также в некоторых китайских базах данных был проведен поиск клинических и эпидемиологических исследований COVID-19. Мы провели метаанализ для изучения смерти, связанной с COVID-19, и факторов риска тяжести COVID-19. Результаты. Критериям для этого обзора соответствовали 55 исследований. Риск летального исхода колебался от 0 до 61.5% при совокупной оценке 3,3%. Риски поступления в ОИТ, острого респираторного дистресс-синдрома (ОРДС) и тяжелой формы COVID-19 составили 24,9%, 20,9% и 26,6% соответственно. Факторами, связанными с риском тяжелого COVID-19, были пожилой возраст (MD = 10,09, 95% ДИ: 7,03, 13,16), мужской пол (OR = 1,62, 95% CI: 1,32, 1,99), артериальная гипертензия (OR = 2,34, 95 % ДИ: 1,47, 3,73), диабет (ОШ = 2,25, 95% ДИ: 1,68, 3,03), хроническое заболевание почек (ОШ = 3,60, 95% ДИ: 1,53, 8,46), болезни сердца (ОШ = 2,76, 95% ДИ : 1,78, 4,30), респираторное заболевание (OR = 3.



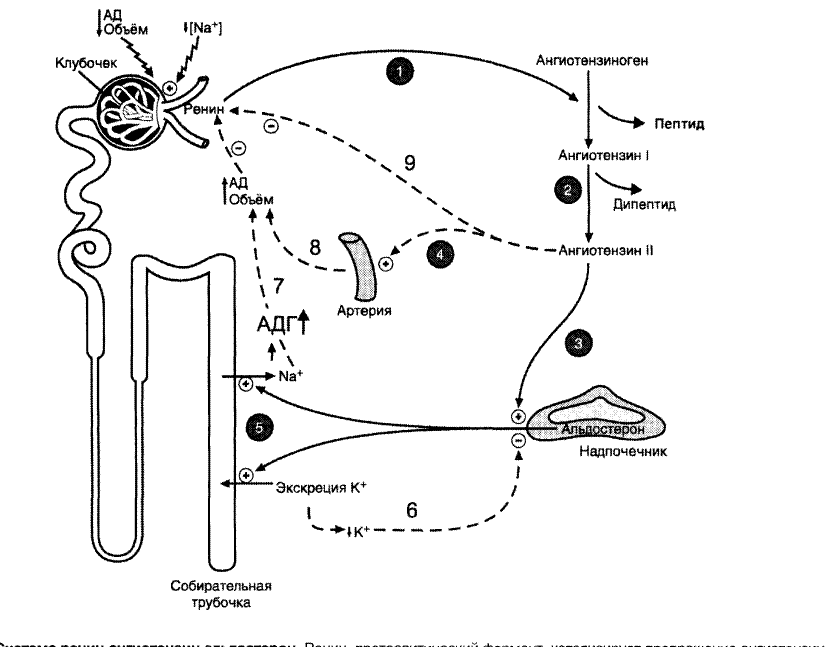 ) Ренин ангиотензиновая система (РАС) или ренин ангиотензин альдостероновая система (РААС) это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в… … Википедия
) Ренин ангиотензиновая система (РАС) или ренин ангиотензин альдостероновая система (РААС) это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в… … Википедия # А … Википедия
# А … Википедия
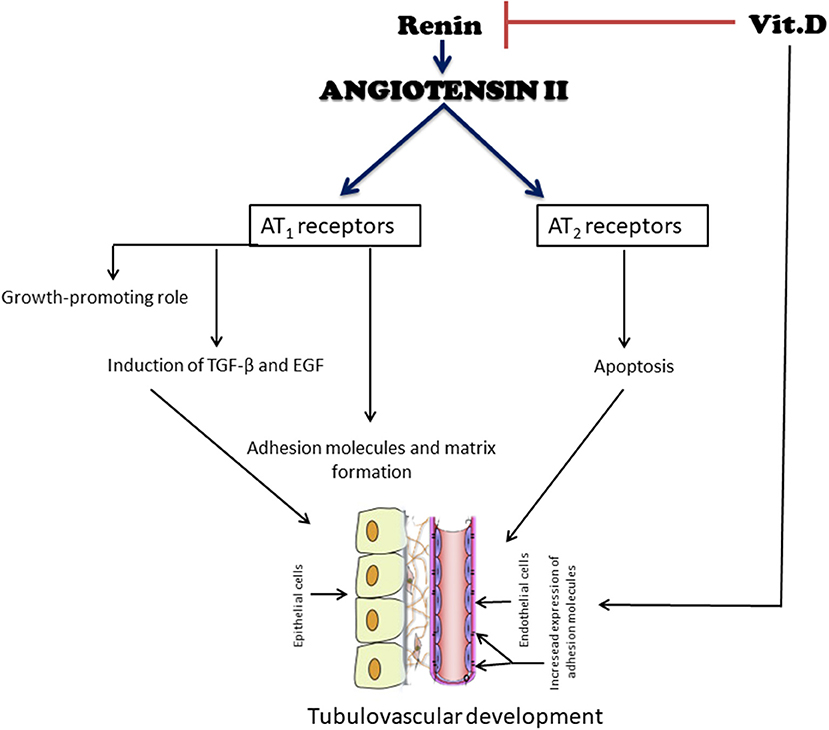 AT1-R рецетор также является посредником в влияниях ангиотензина на клеточный рост, пролиферацию, воспалительные реакции, и оксидативный стресс. Этот рецептор связан с G-белком и содержит семь встроенных в мембрану последовательностей. AT1-R широко представлен во многих типах клеток, являющихся мишенью Ang 2.
AT1-R рецетор также является посредником в влияниях ангиотензина на клеточный рост, пролиферацию, воспалительные реакции, и оксидативный стресс. Этот рецептор связан с G-белком и содержит семь встроенных в мембрану последовательностей. AT1-R широко представлен во многих типах клеток, являющихся мишенью Ang 2.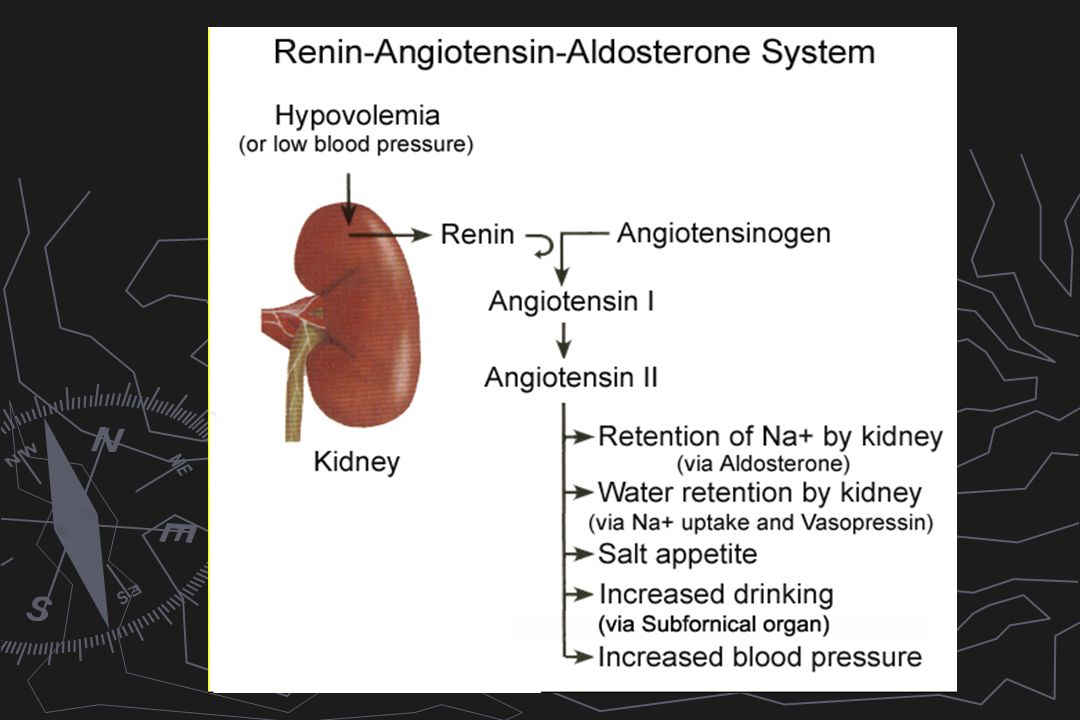
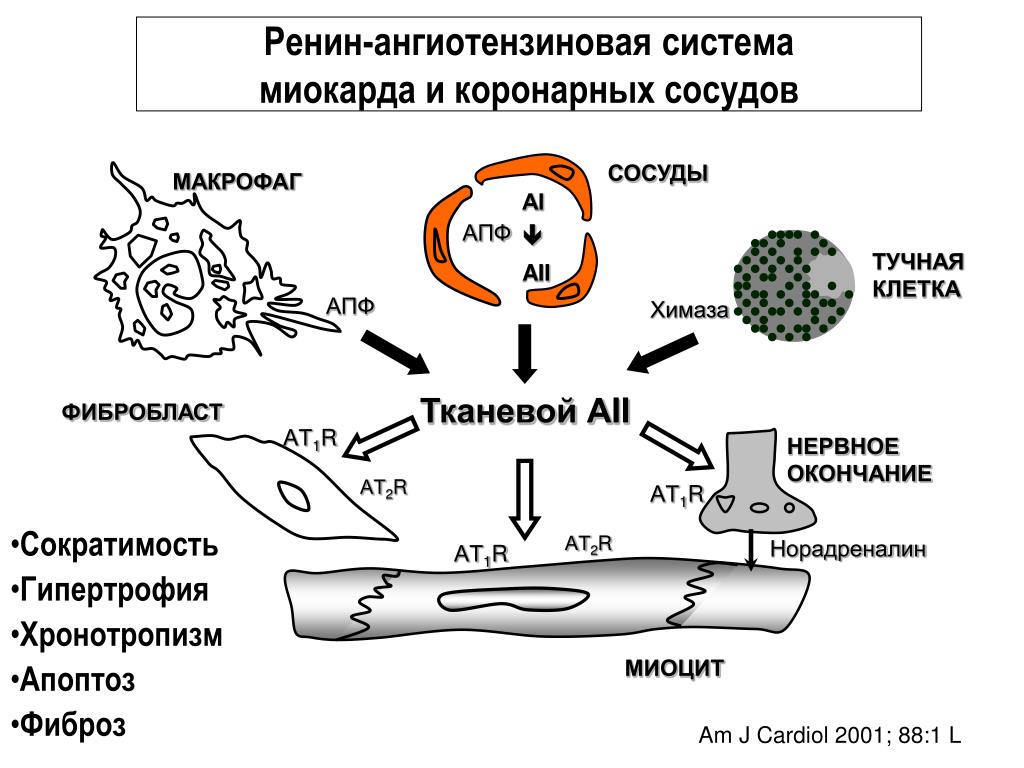

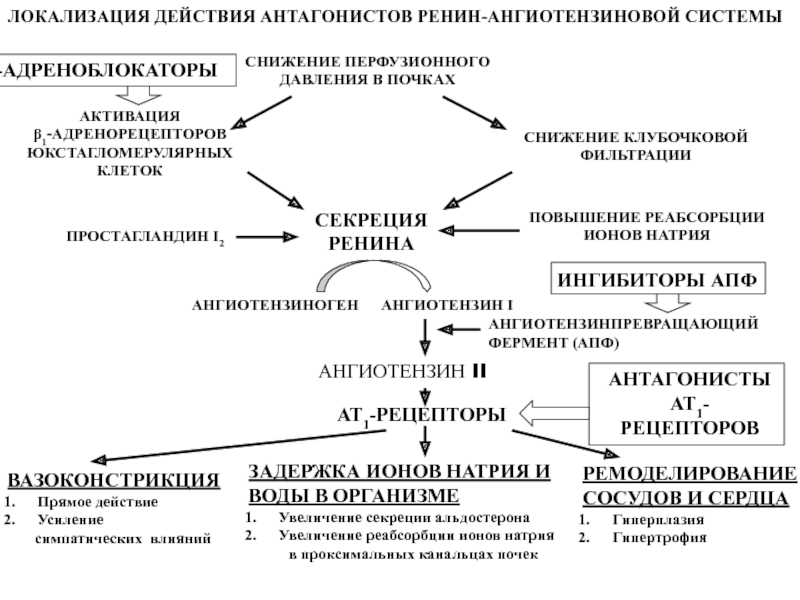 Состояние компенсируют введением солевых растворов и стимуляторов рецепторов к альдостерону.
Состояние компенсируют введением солевых растворов и стимуляторов рецепторов к альдостерону.