Химические реакции их классификация (Схема, Таблица)
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.
Классификация химических реакций по числу и составу исходных и образующихся веществ
|
Химическая реакция |
Определение |
Примеры |
|
Разложения А → В + С + D |
Реакция, в которой из одного исходного вещества образуется несколько новых веществ |
2HgO →t→ 2Hg + O2 CaCO3 → CaO + CO2 4HNO3 → 2H2O + 4NO2 + O2 |
|
Замещения А + ВС → АВ + С |
Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества |
Fe + CuSO4 → FeSO4 + Сu CuSO4 + Fe → FeSO4 + Cu 2KBr + Cl2 → 2KCl + Br2 |
|
Обмена АВ + CD → АС + BD |
Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества |
2AgNO3 + H2SO4 → Ag2SO4 + 2HNO3NaOH + HCl → NaCl + H2O CH3COONa + H2O → CH3COOH + NaOH |
|
Соединения А + В + С → D |
Реакция, в результате которой из двух или нескольких веществ образуется одно новое |
HCl + NH3 → NH4Cl↓ CaO + H2O → Ca(OH)2 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 |
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
|
Реакция |
Определение |
Пример |
|
Эндотермическая |
Реакция, проходящая с поглощением теплоты |
N2 + O2 → 2NO — 90,4 кДж |
|
Экзотермическая |
Реакция, проходящая с выделением теплоты |
Н2 + Сl2 → 2НСl + 92,3 кДж |
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
2Н2 + 0 = 2Н2O + 484 кДж
2NH3 → N2 + ЗН2 — 46,36 кДж.
Термохимические расчеты основаны на законе Гесса:
— тепловой эффект химической реакции зависит от состояний исходных веществ и продуктов реакций, но не зависит от промежуточных стадий процесса
— тепловой эффект химической реакции равен сумме теплот образования продуктов реакции эа вычетом суммы теплот образования исходных веществ
Классификация химических реакций по признаку обратимости
|
Реакция |
Определение |
Примеры |
|
Обратимая |
Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях |
ЗН2 + N2 ↔ 2NH3 Вг2 + Н2O ↔ НВrО + НВr |
|
Необратимая |
Такая реакция, которая в данных условиях протекает до конца, т. |
2Н2(г) + O2(г) → 2Н2O(ж) СН4 + 2O2 → СO2 + 2Н2O |
Таблица признаки необратимости реакций
|
Признак |
Примеры |
|
Реакция идет с выделением большого количества теплоты |
2Mg + O2 → 2MgO + Q |
|
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа) |
СаСl2 + Na2SO3 → CaSO3↓ + 2NaCl CaCO3 →t→ CaO + CO2↑ |
|
В результате реакции образуются малодиссоциируе-мые вещества |
(CH3COO)NH4 + H2O → CH3COOH + NH4OH HCl + NaOH → NaCl + H2O |
Классификация химических реакций по изменению степени окисления
|
Химическая реакция |
Определение |
Примеры |
|
Проходящая с изменением степени окисления атомов (окислительно-восстановительная) |
реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим |
H2S-2 + 020 → S0 + Н2O-2 -2KI-1 + Сl20 → 2КСl-1 + I20 |
|
Проходящая без изменения степени окисления |
Реакция, в которой степень окисления каждого атома после реакции остается неизменной |
2АlСl3 + 3Na2S + 6Н2O → 2Аl(ОН)3↓ + 3H2S↑ + 6NaCl H2SO4 + NaOH → NaHSO4 + H2O |
Влияние изменения условий на положение химического равновесия
|
Изменение условий, при которых система находится в состоянии химического равновесия |
Изменение скоростей прямой и обратной реакции в начальный момент |
Направление смешения положения равновесия |
|
|
Температура |
повышается |
В большей степени возрастает скорость эндотермической реакции |
В сторону эндотермической реакции |
|
понижается |
В большей степени понижается скорость эндотермической реакции |
В сторону экзотермической реакции |
|
|
Давление |
повышается |
В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ |
В сторону уменьшения числа молей газообразных веществ в системе |
|
понижается |
В большей степени понижается скорость реакции протекающей с уменьшением числа молей газообразных веществ |
В сторону увеличения числа молей газообразных веществ в системе |
|
|
Концентрация |
|
Возрастает скорость реакции, по которой вводимое вещество расходуется |
В сторону реакции, по которой вводимое вещество расходуется |
|
понижается |
Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается |
В сторону реакции, по которой образуется вещество, концентрация которого уменьшается |
|
|
Введение катализатора |
Скорости прямой и обратной реакции изменяются одинаково |
— |
|
Классификация химических реакций в неорганической и органической химии | ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат. ,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑. $
$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$). {-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{\text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{\text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{\text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{\text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.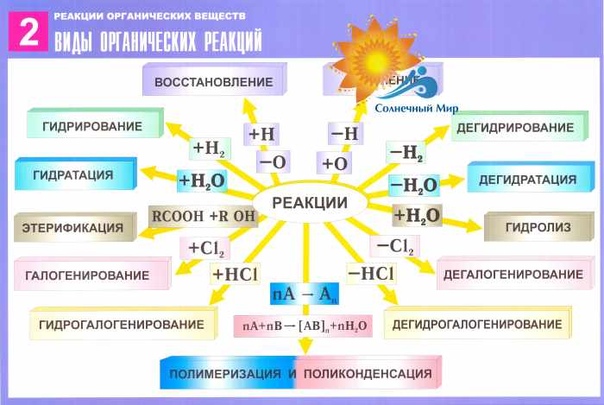 3 кДж,$
3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.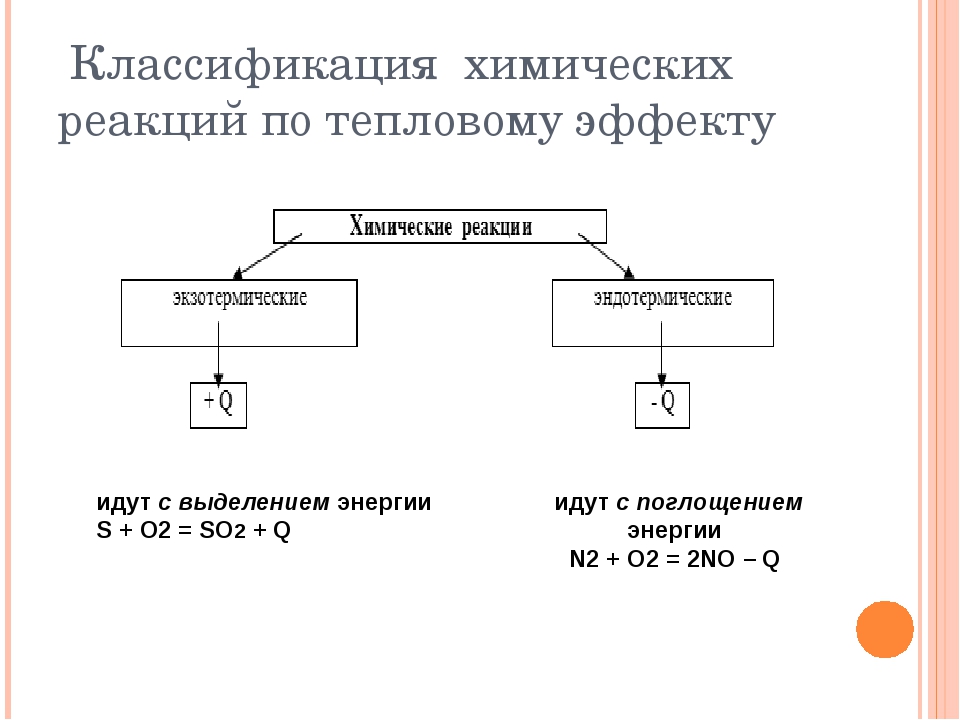
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Классификация химических реакций. Химия. 11 класс. Разработка урока
УМК «Химия. 11 класс. Базовый уровень» О. С. Габриеляна.
Цель: Систематизировать знания учащихся о подходах к классификации химических реакций.
Задачи:
- Обучающие: систематизировать, обобщить и углубить знания учащихся о химических реакциях и их классификации. Рассмотреть некоторые из многочисленных классификаций химических реакций по различным признакам.
- Развивающие: развивать умение анализировать, сопоставлять данные и делать выводы, развитие познавательных способностей
- Воспитывающие: формирование коммуникативной компетенции: воспитание самостоятельности, сотрудничества.

Тип урока: урок изучения новых знаний.
Методы: диалог, частично-поисковый метод.
Форма организации деятельности учащихся: фронтальная и групповая.
Оборудование: компьютер, проектор, реактивы и лабораторное оборудование для проведения лабораторных опытов.
ЦОР: Видеоопыты с сайта «Единая коллекция цифровых образовательных ресурсов», презентация.
Ход урока
1. Организационный момент
2. Актуализация знаний
Слайд 2.
?Что объединяет эти явления? Что лежит в их основе?
«Осень. Обсыпается весь наш бедный сад,
Листья пожелтелые по ветру летят;
Лишь вдали красуются, там на дне долин,
Кисти ярко-красные вянущих рябин».(А.
К.Толстой)
Во время грозы образовался озон.
Железный гвоздь, лежавший на влажной земле, покрылся ржавчиной.
Предполагаемые ответы: Все явления объединяет то, что в их основе лежат химические явления, химические реакции.
?Что происходит в ходе химической реакции с веществами?
Слайд 3. В ходе химической реакции из одних веществ образуются другие вещества, отличающиеся от исходных по составу, строению и свойствам.
3. Изучение новых знаний
Химические реакции можно классифицировать по различным признакам.
Слайд 4.
?Как вы думаете, по какой признак объединил все указанные реакции:
|
Р(белый) |
<=> |
Р (красный) |
|
C(графит) |
<=> |
С (алмаз) |
|
С4Н10 (бутан) |
<=> |
С4Н10 (изобутан) |
Данные реакции не сопровождаются изменением состава веществ.
?Как называется явление существования разных простых веществ, образованных одним элементом? (Аллотропия)
?Как называется процесс превращения бутана в изобутан? (изомеризация)
Вывод: Процесс взаимопревращений разных аллотропных модификаций одного химического элемента и реакции изомеризации относятся к реакциям, которые не сопровождаются изменением состава веществ. Слайд 5.
Классификацию химических реакций, протекающих с изменением состава вещества, можно проводить по самым разным признакам.
? Какие типы реакций, протекающих с изменением состава вещества вы знаете?
Предполагаемые ответы учащихся: реакция соединения, разложения, обмена, замещения.
Слайд 6. ?Определите, какой признак объединяет эти реакции:
|
В неорганической химии |
В органической химии |
|
S + O2 = SO2 |
CH2 = CH2 + H2 = CH3–CH3 |
|
SO3 + H2O = H2SO4 |
CH2 = CH2 + H2O = CH3–CH2–OH |
Предполагаемые ответы: из нескольких веществ образуется одно, происходит соединение.
?Одинаковый ли механизм протекания реакций такого типа в органической и неорганической химии?
Вывод: Реакции, в результате которых из двух и более веществ образуется одно сложное вещество называются реакциями соединения в неорганической химии и реакциями присоединения в органической химии.
Слайд 7. ? Какой признак объединяет реакции:
|
В неорганической химии |
В органической химии |
|
2КMnO4 = K2MnO4 + MnO2 + O2 |
|
|
2HgO = 2Hg + O2 |
|
Вывод: В ходе этих реакций из одного сложного вещества образуется несколько новых веществ. В неорганической химии реакции называются реакциями разложения, в органической – реакциями отщепления.
В неорганической химии реакции называются реакциями разложения, в органической – реакциями отщепления.
Реакции отщепления – антонимы реакциям присоединения.. Составьте самостоятельно реакции дегидрирования этана и дегидратации этанола.
Слайд 8. Просмотрите видеофрагменты: получение железа из его оксида, взаимодействие натрия с водой
Получение железа: http://school-collection.edu.ru/catalog/res/d77a30c4-8cff-11db-b606-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c11&interface=catalog&class=54&subject=31
Взаимодействие натрия с водой
http://school-collection.edu.ru/catalog/res/d77a30ab-8cff-11db-b606-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c11&interface=catalog&class=54&subject=31
Составьте уравнения данных реакций.
?Какой признак объединяет эти реакции? Какие изменения происходят с веществами в ходе таких реакций?
В ходе реакций атомы простого вещества замещают атомы одного из элементов в сложном. Такие реакции называются реакциями замещения. В органической химии реакции замещения имеют свою специфику.
Такие реакции называются реакциями замещения. В органической химии реакции замещения имеют свою специфику.
Слайд 9. Найдите среди перечисленных реакции замещения.
1) C6H6 + 6H2 = C6H12
2) C6H6 + HNO3 = C6H5NO2 + H2O
3) CH4 + Cl2 = CH3Cl + HCl
(К реакциям замещения относятся реакции №2 и №3.)
Ребята, определите к какому типу можно отнести реакции между предложенными веществами.
Лабораторная работа (работа в группах)
Проведите опыты, соблюдая правила техники безопасности, заполните таблицу:
|
Исходные вещества |
Продукты реакции |
Признак реакции |
Тип реакцции |
|
Na2CO3 + HCl |
|
|
|
|
Na2SO4 + BaCl2 |
|
|
|
|
KOH + ф/ф + HCl |
|
Вода (нейтрализация) |
|
Вывод: Реакции, в которых два сложных вещества обмениваются своими составными частями называются реакциями обмена. Реакции протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (вода).
Реакции протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (вода).
Слайд 10. ?Какие признаки реакции ярко выражены в ходе реакции горения спирта, горения метана?
(Реакции сопровождаются выделением тепла.)
?Как называются реакции, которые сопровождаются выделением тепла? Поглощением тепла?
Слайд 11.
|
Тип реакции |
Экзотермические |
Эндотермические |
|
Теплота |
Выделяется |
Поглощается |
|
Примеры реакций |
Реакции соединения
Искл. H2 + I2 = 2HI – Q |
Реакции разложения |
Q – тепловой эффект реакции. Уравнение, в котором указывается тепловой эффект, называют термохимическим.
4. Первичная проверка освоения изученного материала
Слайд 12 Ребята, дайте классификацию реакции:
|
N2 |
+ |
3H2 |
<=> |
2NH3 + Q |
|
(г) |
|
(г) |
|
(г) |
?Вспомнили ли вы, какие еще классификации реакций существуют?
Предполагаемые ответы: обратимые-необратимые, каталитические-некаталитические, гомогенные-гетерогенные) Более подробно такие реакции рассмотрим на следующих уроках.
5. Закрепление материала
5.1. Тест «Типы химических реакций» (на столах учащихся)
1. Взаимодействие оксида серы (IV) с кислородом относится к реакциям
1) соединения, экзотермическим
2) замещения, экзотермическим
3) обмена, эндотермическим
4) соединения, эндотермическим.
2. Взаимодействие кислорода с азотом относится к реакции
1) соединения, экзотермическая
2) обмена, экзотермическая
3) соединения, эндотермическая
4) обмена, эндотермическая
3. Взаимодействие цинка с соляной кислотой относится к реакциям
1) разложения
2) ионного обмена
3) замещения
4) соединения.
4. Гидратация этилена – это реакция
1) присоединения
2) отщепления
3) обмена
4) замещения.
5. Дегидрирование пропана – это реакция
Дегидрирование пропана – это реакция
1) присоединения
2) отщепления
3) обмена
4) замещения.
6. Взаимодействие гидроксида калия с раствором сульфата меди относится к реакциям
1) соединения
2) разложения
3) обмена
4) замещения.
7. Взаимодействие гидроксида калия с серной кислотой относится к реакциям
1) соединения
2) разложения
3) обмена
4) замещения.
5.2. Слайд 13.
Составьте термохимическое уравнение реакции горения угля, тепловой эффект реакции 394 кДж.
5.3. упр № 6 к п.14 стр. 126
6. Рефлексия
Определите свой результат урока:
- Я всё это знал;
- Чувствовал себя уверенно;
- Чувствовал не очень уверенно;
- Узнал много нового;
- Часть материала оказалась для меня новой;
- Было не очень интересно;
- На уроке было интересно!
7. Подведение итогов урока
Независимо от того, между какими веществами – органическими или неорганическими – происходит химическое превращение, для них характерны одни и те же закономерности. Каждую химическую реакцию можно охарактеризовать, используя различные классификации.
8. Домашнее задание
п.13,14
Литература:
Программа: Программа курса химии для 8-11 классов общеобразовательных учреждений. Габриелян О.С. – М.: Дрофа, 2011.
Учебник: Химия. 11 класс. Базовый уровень: учеб. для общеобразовательных учреждений/ О.С. Габриелян – М.: Дрофа, 2010.
Методические пособия:
- Габриелян О.С., Яшукова А.В. Химия. 11 кл. Базовый уровень: Методическое пособие. – М.:Дрофа, 2006.
- Габриелян О.С., Лысова Г.Г., Введенская А.Г. Настольная книга учителя. Химия. 11 кл. В 2 ч. – М.: Дрофа, 2008.
- Габриелян О.С., Остроумов И.Г. Общая химия в тестах, задачах, упражнениях. 11 кл. – М.: Дрофа, 2007.
- Химия. 11 кл.: Контрольные и проверочные работы к учебнику О.С. Габриеляна, Г.Г. Лысовой «Химия. 11»/О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – М.: Дрофа, 2008.
Классификация химических реакций по различным признакам
Билет № 8
1. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; выделению или поглощению энергии; изменению степени окисления химических элементов. Примеры реакций различных типов
♦ По числу и составу исходных и полученных веществ химические реакции бывают:
- Соединения — из двух или нескольких веществ образуется одно сложное вещество:
Fe + S = FeS
(при нагревании порошков железа и серы образуется сульфид железа) - Разложения — из одного сложного вещества образуется два или несколько веществ:
2H2O = 2H2 + O2
(вода разлагается на водород и кислород при пропускании электрического тока) - Замещения — атомы простого вещества замещают один из элементов в сложном веществе:
Fe + CuCl2 = Cu↓ + FeCl2
(железо вытесняет медь из раствора хлорида меди (II)) - Обмена — 2 сложных вещества обмениваются составными частями:
HCl + NaOH = NaCl + H2O
(реакция нейтрализации — соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия и воды)
♦ Реакции, протекающие с выделением энергии (тепла), называются экзотермическими. К ним относятся реакции горения, например серы:
S + O2 = SO2 + Q
Образуется оксид серы (IV), выделение энергии обозначают + Q
Реакции, требующие затрат энергии, т. е. протекающие с поглощением энергии, называются эндотермическими. Эндотермической является реакция разложения воды под действием электрического тока:
2H2O = 2H2 + O2 − Q
♦ Реакции, сопровождающиеся изменением степеней окисления элементов, т. е. переходом электронов, называются окислительно-восстановительными:
Fe0 + S0 = Fe+2S−2
Противоположностью являются электронно-статичные реакции, часто их называют просто реакции, протекающие без изменения степени окисления. К ним относятся все реакции обмена:
H+1Cl−1 + Na+1O−2H+1 = Na+1Cl−1 + H2+1O−2
(Напомним, что степень окисления в веществах, состоящих из двух элементов, численно равна валентности, знак ставится перед цифрой)
2. Опыт. Проведение реакций, подтверждающих качественный состав предложенной соли, например сульфата меди (II)
Качественный состав соли доказывают с помощью реакций, сопровождающихся выпадением осадка или выделением газа с характерным запахом или цветом. Образование осадка происходит в случае получения нерастворимых веществ (определяем по таблице растворимости). Газы выделяются при образовании слабых кислот (для многих требуется нагревание) или гидроксида аммония.
Наличие иона меди можно доказать добавлением гидроксида натрия, выпадает синий осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Дополнительно можно провести разложение гидроксида меди (II) при нагревании, образуется черный оксид меди (II):
Cu(OH)2 = CuO + H2O
Наличие сульфат-иона доказывается выпадением белого кристаллического осадка, нерастворимого в концентрированной азотной кислоте, при добавлении растворимой соли бария:
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
автор: Владимир Соколов
Классификация химических реакций
Химические реакции следует отличать от ядерных реакций. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например превращение алюминия в магний:
2713Аl + 11Н = 2412Мg + 42Не
Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Реакции, идущие без изменения состава веществ.
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
С (графит) ↔ С (алмаз)
S (ромбическая) ↔ S (моноклинная)
Р (белый) ↔ Р (красный)
Sn (белое олово) ↔ Sn (серое олово)
3O2 (кислород) ↔ 2O3 (озон)
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, так как углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
CH3— CH2— С= — СН ↔ СН3— С= — С- СН3
этилацетилен диметнлацетилен
4. Изомеризация галогеналканов (А. Е. Фаворский, 1907 г.).
5. Изомеризация цианита аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1828 г. изомеризацией цианата аммония при нагревании.
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество
В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы:
1. Получение оксида серы (IV):
S + O2 = SO — из двух простых веществ образуется одно сложное.
2. Получение оксида серы (VI):
SO2 + 02 → 2SO3 — из простого и сложного веществ образуется одно сложное.
3. Получение серной кислоты:
SO3 + Н2O = Н2SO4 — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
4NО2 + O2 + 2Н2O = 4НNO3
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1. Реакция гидрирования — присоединения водорода:
CH2=CH2 + Н2 → Н3-СН3
этен → этан
2. Реакция гидратации — присоединения воды.
3. Реакция полимеризации.
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами:
1. Разложение оксида ртути(II) — из одного сложного вещества образуются два простых.
2. Разложение нитрата калия — из одного сложного вещества образуются одно простое и одно сложное.
3. Разложение перманганата калия — из одного сложного вещества образуются два сложных и одно простое, то есть три новых вещества.
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности:
1. Реакция дегидратации (отщепления воды) этанола:
С2H5OH → CH2=CH2 + H2O
2. Реакция дегидрирования (отщепление водорода) этана:
CH3-CH3 → CH2=CH2 + H2
или СН3-СН3 → 2С + ЗН2
3. Реакция крекинга (расщепления) пропана:
CH3-СН2-СН3 → СН2=СН2 + СН4
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1. Взаимодействие щелочных или щелочноземельных металлов с водой:
2Na + 2Н2O = 2NаОН + Н2
2. Взаимодействие металлов с кислотами в растворе:
Zn + 2НСl = ZnСl2 + Н2
3. Взаимодействие металлов с солями в растворе:
Fе + СuSO4 = FеSO4 + Сu
4. Металлотермия:
2Аl + Сr2O3 → Аl2O3 + 2Сr
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена. Другой пример — бромирование ароматического соединения (бензола, толуола, анилина).
FеВr3
С6Н6 + Вr2 → С6Н5Вr + НВr
бензол → бромбензол
Обратим внимание на особенность реакции замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещество, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола. Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2O).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1. Реакция нейтрализации, идущая с образованием соли и воды.
2. Реакция между щелочью и солью, идущая с образованием газа.
3. Реакция между щелочью и солью, идущая с образованием осадка:
СuSO4 + 2КОН = Сu(ОН)2 + К2SO4
или в ионном виде:
Сu2+ + 2OН— = Сu(ОН)2
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1. Реакция, идущая с образованием слабого электролита — Н2O:
СН3СООН + NаОН → Nа(СН3СОО) + Н2O
2. Реакция, идущая с образованием газа:
2СН3СООН + СаСO3 → 2СН3СОО + Са2+ + СO2 + Н2O
3. Реакция, идущая с образованием осадка:
2СН3СООН + К2SO3 → 2К(СН3СОО) + Н2SO3
или
2СН3СООН +SiO → 2СН3СОО + Н2SiO3
По этому признаку различают следующие реакции:
1. Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1. Mg0 + H+2SO4 = Mg+2SO4 + H2↑
2. 2Mg0 + O02 = Mg+2O-2
Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса.
2KMn+7O4 + 16HCl— = 2KCl— + 2Mn+2Cl—2 + 5Cl02↑ + 8H2O
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов.
1. Они восстанавливаются в соответствующие спирты:
Альдекиды окисляются в соответствующие кислоты:
2. Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, многие реакции разложения, реакции этерификации:
НСООН + CHgOH = НСООСН3 + H2O
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1. Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота(II) из азота и кислорода и реакция газообразного водорода с твердым иодом.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения. Гидрирование этилена — пример экзотермической реакции. Она идет при комнатной температуре.
2. Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
1. Обжиг известняка
2. Крекинг бутана
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением:
Н2(г) + С12(г) = 2НС1(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) — 90,4 кДж
По агрегатному состоянию реагирующих веществ различают:
1. Гетерогенные реакции — реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах).
2. Гомогенные реакции — реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе).
По участию катализатора различают:
1. Некаталитические реакции, идущие без участия катализатора.
2. Каталитические реакции , идущие с участием катализатора. Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным. Следует отметить, что более 70% химических производств используют катализаторы.
По направлению различают:
1. Необратимые реакции протекают в данных условиях только в одном направлении. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
2. Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия — антонимы процессов:
• гидрирование — дегидрирование,
• гидратация — дегидратация,
• полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма — обмена веществ.
1. Радикальные реакции идут между образующимися в ходе реакции радикалами и молекулами.
Как вы уже знаете, при всех реакциях происходит разрыв старых и образование новых химических связей. Способ разрыва связи в молекулах исходного вещества определяет механизм (путь) реакции. Если вещество образовано за счет ковалентной связи, то могут быть два способа разрыва этой связи: гемолитический и гетеролитический. Например, для молекул Сl2, СН4 и т. д. реализуется гемолитический разрыв связей, он приведет к образованию частиц с неспаренными электронами, то есть свободных радикалов.
Радикалы чаще всего образуются, когда разрываются связи, при которых общие электронные пары распределены между атомами примерно одинаково (неполярная ковалентная связь), однако многие полярные связи также могут разрываться подобным же образом, в частности тогда, когда реакция проходит в газовой фазе и под действием света, как, например, в случае рассмотренных выше процессов — взаимодействия С12 и СН4—. Радикалы очень реакционноспособны, так как стремятся завершить свой электронный слой, забрав электрон у другого атома или молекулы. Например, когда радикал хлора сталкивается с молекулой водорода, то он вызывает разрыв общей электронной пары, связывающей атомы водорода, и образует ковалентную связь с одним из атомов водорода. Второй атом водорода, став радикалом, образует общую электронную пару с неспаренным электроном атома хлора из разрушающейся молекулы Сl2, в результате чего возникает радикал хлора, который атакует новую молекулу водорода и т. д
Реакции, представляющие собой цепь последовательных превращений, называют цепными реакциями.
За разработку теории цепных реакций два выдающихся химика — наш соотечественник Н. Н. Семенов и англичанин С. А. Хиншелвуд были удостоены Нобелевской премии.
Аналогично протекает и реакция замещения между хлором и метаном:
По радикальному механизму протекают большинство реакций горения органических и неорганических веществ, синтез воды, аммиака, полимеризация этилена, винилхлорида и др.
Типичные ионные реакции — это взаимодействие между электролитами в растворе. Ионы образуются не только при диссоциации электролитов в растворах, но и под действием электрических разрядов, нагревания или излучений. γ-Лучи, например, превращают молекулы воды и метана в молекулярные ионы.
По другому ионному механизму происходят реакции присоединения к алкенам галогеноводородов, водорода, галогенов, окисление и дегидратация спиртов, замещение спиртового гидроксила на галоген; реакции, характеризующие свойства альдегидов и кислот. Ионы в этом случае образуются при гетеролитическом разрыве ковалентных полярных связей.
инициирующей реакцию, различают:
1. Фотохимические реакции. Их инициирует световая энергия. Кроме рассмотренных выше фотохимических процессов синтеза НСl или реакции метана с хлором, к ним можно отнести получение озона в тропосфере как вторичного загрязнителя атмосферы. В роли первичного в этом случае выступает оксид азота(IV), который под действием света образует радикалы кислорода. Эти радикалы взаимодействуют с молекулами кислорода, в результате чего получается озон.
Образование озона идет все время, пока достаточно света, так как NO может взаимодействовать с молекулами кислорода с образованием того же NO2. Накопление озона и других вторичных загрязнителей атмосферы может привести к появлению фотохимического смога.
К этому виду реакций принадлежит и важнейший процесс, протекающий в растительных клетках, — фотосинтез, название которого говорит само за себя.
2. Радиационные реакции. Они инициируются излучениями большой энергии — рентгеновскими лучами, ядерными излучениями (γ-лучами, а-частицами — Не2+ и др.). С помощью радиационных реакций проводят очень быструю радиополимеризацию, радиолиз (радиационное разложение) и т. д.
Например, вместо двухстадийного получения фенола из бензола его можно получать взаимодействием бензола с водой под действием радиационных излучений. При этом из молекул воды образуются радикалы [•OН] и [•H•], с которыми и реагирует бензол с образованием фенола:
С6Н6 + 2[ОН] → С6Н5ОН + Н2O
Вулканизация каучука может быть проведена без серы с использованием радиовулканизации, и полученная резина будет ничуть не хуже традиционной.
3. Электрохимические реакции. Их инициирует электрический ток. Помимо хорошо известных вам реакций электролиза укажем также реакции электросинтеза, например, реакции промышленного получения неорганических окислителей
4. Термохимические реакции. Их инициирует тепловая энергия. К ним относятся все эндотермические реакции и множество экзотермических реакций, для начала которых необходима первоначальная подача теплоты, то есть инициирование процесса.
Рассмотренная выше классификация химических реакций отражена на схеме.
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам. Например, составим характеристику процесса синтеза аммиака.
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гетерогенная (точнее, гетерогенно-каталитическая), протекающая с уменьшением давления в системе. Для успешного управления процессом необходимо учитывать все приведенные сведения. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки.
Классификация химических реакций — HimHelp.ru
Химические свойства веществ выявляются в разнообразных химических реакциях.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями. Часто встречается и такое определение: химической реакцией называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются посредством химических уравнений и схем, содержащих формулы исходных веществ и продуктов реакции. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части – веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т.д.), это указывается соответствующим символом, как правило, над (или “под”) знаком равенства.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки.
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом – выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом – поглощением энергии в форме теплоты (Q<0, ∆H >0):
N2 +О2 = 2NО – Q.
Такие реакции относят к термохимическим.
Рассмотрим более подробно каждый из типов реакций.
Классификация по числу и составу реагентов и конечных веществ
1. Реакции соединения
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са(НСО3)2,
так и относиться к числу окислительно-восстановительных:
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
| to | ||
| CuSO4 5H2O | = | CuSO4 + 5H2O |
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
| to | ||
| 4HNO3 | = | 2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.
Реакции разложения в органической химии носят название крекинга:
С18H38 = С9H18 + С9H20,
или дегидрирования
C4H10 = C4H6 + 2H2.
3. Реакции замещения
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,
Иногда эти реакции рассматривают как реакции обмена:
СН4 + Сl2 = СН3Сl + НСl.
4. Реакции обмена
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами – оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена – реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
5. Реакции переноса.
При реакциях переноса атом или группа атомов переходит от одной структурной единицы к другой:
АВ + ВС = А + В2С,
А2В + 2СВ2 = АСВ2 +АСВ3.
Например:
2AgCl + SnCl2 = 2Ag + SnCl4,
H2O + 2NO2 = HNO2 + HNO3.
Классификация реакций по фазовым признакам
В зависимости от агрегатного состояния реагирующих веществ различают следующие реакции:
1. Газовые реакции
2. Реакции в растворах
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н2О(ж)
3. Реакции между твердыми веществами
| to | ||
| СаО(тв) +SiO2(тв) | = | СаSiO3(тв) |
Классификация реакций по числу фаз.
Под фазой понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Все многообразие реакций с этой точки зрения можно разделить на два класса:
1.Гомогенные (однофазные) реакции. К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах .
2.Гетерогенные (многофазные) реакции. К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO2(г) + NaOH(p-p) = NaHCO3(p-p).
газотвердофазные реакции
СO2(г) + СаО(тв) = СаСO3(тв).
жидкотвердофазные реакции
Na2SO4(р-р) + ВаСl3(р-р) = ВаSО4(тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО3)2(р-р) + Н2SО4(р-р) = СО2(r)↑ +Н2О(ж) + СаSО4(тв)↓.
Классификация реакций по типу переносимых частиц
1. Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием – вещество, способное присоединять протон, например:
| CH3COOH | + H2O = | CH3COO– + | H3O+ |
| кислотаI | основаниеI | основаниеI | кислотаII |
| NH3 + | H2O = | NH4+ + | OH– |
| основаниеI | кислотаII | кислотаII | основаниеII |
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
3. Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2,
Fe + 5CO = [Fe(CO)5],
Al(OH)3 + NaOH = [NaAl(OH)4].
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
Обратимые и необратимые химические реакции
Обратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом:
А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например:
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО3 → 2КСl + ЗО2↑,
или окисление глюкозы кислородом воздуха:
С6Н12О6 + 6О2 → 6СО2 + 6Н2О.
Урок 5. классификация химических реакций — Химия — 11 класс
Химия, 11 класс
Урок № 5. Классификация химических реакций
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению способов классификации химических реакций и системам классификации химических реакций.
Глоссарий
Гетерогенные реакции – реакции, в которых реагенты и продукты реакции находятся в разных фазах, при этом реакция протекает на границе раздела фаз.
Гомогенные реакции – реакции, в которых реагенты и продукты реакции находятся в одной фазе.
Катализатор – вещество, увеличивающее скорость химической реакции, но само при этом остающееся неизменным.
Необратимые реакции – реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции.
Обратимые реакции – реакции, протекающие одновременно в прямом и обратном направлениях в одних и тех же условиях.
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степеней окисления элементов.
Реакции замещения – реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Реакции обмена – реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Реакции разложения – реакции, при которых из одного сложного вещества образуется несколько новых веществ.
Реакции соединения – реакции, в результате которых из двух или нескольких исходных веществ образуется одно сложное вещество.
Химическая реакция (химическое превращение) – процесс, в котором одно или несколько веществ превращаются в другие вещества.
Экзотермическая реакция – реакция, сопровождающаяся выделением энергии (тепла).
Эндотермическая реакция – реакция, сопровождающаяся поглощением энергии (тепла).
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Химическая реакция – это процесс, в котором одно или несколько веществ превращаются в другие вещества. Выбирая определённые критерии, которые лягут в основу нашего описания, мы можем классифицировать и описать любую химическую реакцию с разных «точек зрения».
Рассмотрим, какие критерии могут лежать в основе разных классификаций химических реакций.
Первый критерий – число и состав реагирующих и образующихся веществ. Мы можем выделить реакции: соединения, разложения, замещения и обмена. Кроме этого, нам могут встретиться реакции, в ходе которых изменение состава веществ не происходит. Примерами таких реакций будут превращения одних аллотропных модификаций в другие, а также реакции изомеризации.
Если в основу классификации мы положим изменение степени окисления атомов элементов, то все реакции разделятся на две категории: окислительно-восстановительные и реакции, при которых изменение степени окисления не происходит.
В зависимости от использования катализатора, реакции могут являться каталитическими либо некаталитическими.
Если нас заинтересует смещение химического равновесия во время химического превращения, тогда мы увидим, что некоторые реакции окажутся обратимыми, а некоторые будут проходить до конца полностью и безвозвратно – необратимо.
По фазовому составу можно разделить реакции на гомогенные, при которых реагенты и продукты находятся в одной фазе, и гетерогенные, в которых реагенты и продукты находятся в разных фазах, а реакции происходят на границе раздела фаз.
Также реакции можно различить по виду энергии, которая их инициирует: таким образом реакции могут быть радиационные, фотохимические, термохимические и электрохимические.
В зависимости от теплового эффекта можно выделить реакции экзотермические, в ходе которых тепло выделяется, и эндотермические, при которых происходит поглощение тепла.
В заключение, можно посмотреть на реакции с точки зрения их механизма и тогда большинство реакций можно будет разделить на те, которые проходят по радикальному механизму, и те, что проходят по ионному.
Химические реакции следует отличать от ядерных. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются. Ядерные же реакции – это процесс превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами.
Как мы видим, классификация химических реакций многопланова, то есть в ее основу положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Для примера рассмотрим реакцию разложения осадка гидроксида меди (II) с образованием оксида меди (II) и воды.
Cu(OH)2 → CuO + H2O
По количеству и характеру реагентов и продуктов эта реакция относится к типу реакций разложения – из одного сложного вещества мы получаем два новых сложных. В ходе реакции степени окисления атомов элементов остаются прежними, значит, это превращение относится к реакциям без изменения степеней окисления. Для осуществления такой реакции нам не требуется катализатор, поэтому это будет превращением некаталитическим. При разложении нерастворимого гидроксида меди (II) мы получаем нерастворимый в воде оксид меди (II), поэтому, если мы попробуем провести реакцию между оксидом меди (II) и водой, у нас ничего не выйдет. Значит, реакция разложения гидроксида меди (II) является необратимой. В качестве реагента выступает твердое вещество, а в качестве продуктов – твердый оксид меди (II) и водяной пар, поэтому по фазовому составу такая реакция является гетерогенной. Реакция разложения гидроксида меди (II) начинается при его нагревании, температура превращения составляет около 80 °С. Значит, по виду энергии, инициирующей реакцию, эта реакция является термохимической. Для «запуска» этой реакции требуется нагревание, следовательно, теплота, которую мы подводим извне, будет поглощаться и полученная энергия будет расходоваться на перестройку структуры. Такая реакция относится к эндотермическим.
В итоге мы видим, что любая химическая реакция может быть одновременно и полно охарактеризована по различным критериям.
Классификация химических реакций разнообразна. Такой комплексный подход позволяет рассмотреть и изучить каждое превращение со всех возможных сторон и понять его максимально полно.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Пример 1.
Введите формулу недостающего продукта реакции.
CH3COOH + Ca(OH)2 → … + H2O.
Решение
Мы видим, что первое вещество в этой реакции – это уксусная кислота, а второе – гидроксид кальция. Вспоминаем, что реакция между кислотой и основанием – это реакция нейтрализации. Продуктами подобных реакций являются соль и вода. Вода уже записана в правой части уравнения, остается вписать туда формулу соль. Это должна быть кальциевая соль уксусной кислоты – ацетат кальция. Ацетат-ион одновалентен, а ион кальция – двухвалентен, следовательно, на каждый ион кальция приходится два ацетат-иона. Его формула (CH3COO)2Ca. Записываем формулу на место пропуска.
Пример 2.
К каким типам реакций относится промышленный синтез аммиака?
- Реакция соединения
- Реакция обмена
- Электрохимическая реакция
- Радиохимическая реакция
- Гомогенная реакция
- Каталитическая реакция
Решение.
Реакция синтеза аммиака: N2 + H2 → NH3
Два простых вещества реагируют друг с другом с образованием сложного вещества. Следовательно, по определению, такая реакция будет реакцией соединения. Значит, «обмен» можно смело вычеркивать. Реакция синтеза аммиака происходит при высокой температуре и очень высоком давлении в присутствии катализатора. Выходит, что по типу энергии, инициирующей реакцию, эта реакция будет термохимической. Такого варианта у нас нет, значит оба предложенных варианта не подходит (электрохимическая и радиохимическая). Мы сказали, что для реакции требуется катализатор, поэтому эта реакция является каталитической. Все три вещества – азот, водород и аммиак – являются газообразными веществами, значит, реакция относится к типу гомогенных.
7.10: Классификация химических реакций — Chemistry LibreTexts
Цели обучения
- Классифицируют химическую реакцию как синтез, разложение, однократное замещение, двойное замещение или реакцию горения.
- Предскажите продукты простых реакций.
Химические реакции, которые мы описали, представляют собой лишь небольшую часть бесконечного числа возможных химических реакций. Как химики справляются с таким огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы категоризации реакций.Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, которые образуются при контакте определенных видов соединений или элементов.
Большинство химических реакций можно разделить на один или несколько из пяти основных типов: кислотно-основные реакции, реакции обмена, реакции конденсации (и обратные реакции расщепления) и реакции окисления-восстановления. Общие формы этих пяти типов реакций приведены в Таблице \ (\ PageIndex {1} \) вместе с примерами каждого из них.Однако важно отметить, что многие реакции могут быть отнесены к более чем одной классификации, как вы увидите в нашем обсуждении.
| Название реакции | Общая форма | Примеры |
|---|---|---|
| Окисление – восстановление (редокс) | окислитель + восстановитель → восстановленный окислитель + окисленный восстановитель | C 7 H 16 (л) + 11O 2 (г) → 7CO 2 (г) + 8H 2 O (г) |
| Кислотно-щелочная | кислота + основание → соль | NaOH (водн.) + HNO 3 (водн.) → NaNO 3 (водн.) + H 2 O (л) |
Обмен: однократная замена | AB + C → AC + B | ZnCl 2 (водн.) + Mg (s) → MgCl 2 (водн.) + Zn (s) |
| Обмен: Двойная замена | AB + CD → AD + CB | BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (т.) + 2NaCl (водн.) |
| Комбинация (синтез) | А + В → АВ | CO 2 (г) + H 2 O (л) → H 2 CO 3 (водн.) N 2 (г) + 2O 2 (г) → 2NO 2 (г) |
| Разложение | AB → A + B | CaCO 3 (т) → CaO (т) + CO 2 (г) |
Схема классификации приведена только для удобства; одну и ту же реакцию можно классифицировать по-разному, в зависимости от того, какая из ее характеристик наиболее важна.В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит чистый перенос электронов от одного атома к другому, и реакции конденсации. Кислотно-основные реакции — это один из видов реакции обмена — образование нерастворимой соли, такой как сульфат бария, когда растворы двух растворимых солей смешиваются вместе.
Комбинированные реакции
Реакция объединения — это реакция, в которой два или более веществ объединяются с образованием одного нового вещества.Комбинированные реакции также можно назвать реакциями синтеза. Общая форма комбинированной реакции:
\ [\ ce {A} + \ ce {B} \ rightarrow \ ce {AB} \]
Одна комбинационная реакция — это соединение двух элементов с образованием соединения. Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\ [2 \ ce {Na} \ left (s \ right) + \ ce {Cl_2} \ left (g \ right) \ rightarrow 2 \ ce {NaCl} \ left (s \ right) \ nonumber \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, которые существуют в природе в виде двухатомных молекул (\ (\ ce {H_2} \), \ (\ ce {N_2} \), \ (\ ce {O_2} \), \ (\ ce {F_2} \), \ (\ ce {Cl_2} \), \ (\ ce {Br_2} \) и \ (\ ce {I_2} \)) .
Одним из часто встречающихся типов комбинационной реакции является реакция элемента с кислородом с образованием оксида. И металлы, и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и резко реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния:
\ [2 \ ce {Mg} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {MgO} \ left (s \ right) \ nonumber \]
Сера реагирует с кислородом с образованием диоксида серы:
\ [\ ce {S} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {SO_2} \ left (g \ right) \ nonumber \]
При взаимодействии неметаллов друг с другом продукт представляет собой молекулярное соединение.Часто неметаллические реагенты могут сочетаться в разных соотношениях и давать разные продукты. Сера также может соединяться с кислородом с образованием триоксида серы:
\ [2 \ ce {S} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {SO_3} \ left (g \ right) \ nonumber \]
Переходные металлы способны принимать несколько положительных зарядов в своих ионных соединениях. Следовательно, большинство переходных металлов способны образовывать различные продукты в реакции сочетания. Железо реагирует с кислородом с образованием как оксида железа (II), так и оксида железа (III):
\ [2 \ ce {Fe} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {FeO} \ left (s \ right) \ nonumber \]
\ [4 \ ce {Fe} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {Fe_2O_3} \ left (s \ right) \ nonumber \]
Пример \ (\ PageIndex {1} \): сжигание твердого калия
Калий — это очень реактивный щелочной металл, который необходимо хранить под маслом, чтобы предотвратить его реакцию с воздухом.Напишите сбалансированное химическое уравнение реакции взаимодействия калия и кислорода.
Решение
| Ступени | Пример решения |
|---|---|
Спланируйте проблему. | Убедитесь, что формулы всех реагентов и продуктов верны. до балансировки уравнения. Газообразный кислород — это двухатомная молекула.{2 -}} \). |
| Решить. | Каркас (неуравновешенное) уравнение: \ [\ ce {K} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {K_2O} \ left (s \ right) \ nonumber \] Уравнение затем легко уравновешивается с помощью коэффициентов. \ [4 \ ce {K} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {K_2O} \ left (s \ right) \ nonumber \] |
| Подумайте о своем результате. | Формулы верны, и результирующая реакция комбинации сбалансирована. |
Комбинированные реакции также могут иметь место, когда элемент реагирует с соединением с образованием нового соединения, состоящего из большего числа атомов. Окись углерода реагирует с кислородом с образованием двуокиси углерода в соответствии с уравнением:
\ [2 \ ce {CO} \ left (g \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {CO_2} \ left (g \ right) \]
Два соединения также могут реагировать с образованием более сложного соединения.Очень распространенный пример — реакции оксидов с водой. Оксид кальция легко реагирует с водой с образованием водного раствора гидроксида кальция:
\ [\ ce {CaO} \ left (s \ right) + \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {Ca (OH) _2} \ left (aq \ right) \]
Газообразный триоксид серы реагирует с водой с образованием серной кислоты. К сожалению, это обычная реакция, которая происходит в атмосфере в некоторых местах, где оксиды серы присутствуют в качестве загрязнителей. Кислота, образующаяся в результате реакции, падает на землю в виде кислотного дождя.
\ [\ ce {SO_3} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {H_2SO_4} \ left (aq \ right) \]
Рисунок \ (\ PageIndex {1} \): Кислотный дождь имеет серьезные последствия как для природных, так и для искусственных объектов. Кислотный дождь разрушает мраморные статуи, подобные изображению слева (A). Деревья в лесу справа (B) погибли из-за кислотного дождя.Упражнение \ (\ PageIndex {1} \)
- Напишите химическое уравнение синтеза бромида серебра \ (\ ce {AgBr} \).
- Предскажите продукты для следующей реакции: \ (\ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \)
- Ответ:
- \ (2 \ ce {Ag} + \ ce {Br_2} \ rightarrow 2 \ ce {AgBr} \)
- Ответ b:
- \ (\ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \ rightarrow \ ce {H_2CO_3} \)
Реакция разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества.Общая форма реакции разложения:
\ [\ ce {AB} \ rightarrow \ ce {A} + \ ce {B} \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода:
\ [2 \ ce {HgO} \ left (s \ right) \ rightarrow 2 \ ce {Hg} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \]
Видео \ (\ PageIndex {2} \): Оксид ртути (II) представляет собой твердое вещество красного цвета.При нагревании он разлагается на металлическую ртуть и газообразный кислород.
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединениями. Карбонат металла разлагается на оксид металла и газообразный диоксид углерода. Например, карбонат кальция разлагается на оксид кальция и диоксид углерода:
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды.Гидроксид натрия разлагается с образованием оксида натрия и воды:
\ [2 \ ce {NaOH} \ left (s \ right) \ rightarrow \ ce {Na_2O} \ left (s \ right) + \ ce {H_2O} \ left (g \ right) \]
Некоторые нестабильные кислоты разлагаются с образованием оксидов неметаллов и воды. Углекислота легко разлагается при комнатной температуре на диоксид углерода и воду:
\ [\ ce {H_2CO_3} \ left (aq \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \]
Пример \ (\ PageIndex {2} \): Электролиз воды
Когда электрический ток проходит через чистую воду, она разлагается на элементы.Напишите сбалансированное уравнение разложения воды.
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте проблему. | Вода — это бинарное соединение, состоящее из водорода и кислорода. Газообразные водород и кислород, образующиеся в реакции, представляют собой двухатомные молекулы. |
Решить. | Каркас (неуравновешенное) уравнение: \ [\ ce {H_2O} \ left (l \ right) \ overset {\ text {elec}} {\ rightarrow} \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (g \ right) \ nonumber \] Обратите внимание на аббревиатуру «\ (\ text {elec} \)» над стрелкой, чтобы указать прохождение электрического тока для инициирования реакции. Сбалансируйте уравнение. \ [2 \ ce {H_2O} \ left (l \ right) \ overset {\ text {elec}} {\ rightarrow} 2 \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (г \ право) \ nonumber \] |
| Подумайте о своем результате. | Продукты являются стихиями, и уравнение сбалансировано. |
Упражнение \ (\ PageIndex {2} \)
Напишите химическое уравнение разложения:
- \ (\ ce {Al_2O_3} \)
- \ (\ ce {Ag_2S} \)
- Ответьте на
- \ (2 \ ce {Al_2O_3} \ rightarrow 4 \ ce {Al} + 3 \ ce {O_2} \)
- Ответ б
- \ (\ ce {Ag_2S} \ rightarrow 2 \ ce {Ag} + \ ce {S} \)
Реакция однократной замены
Третий тип реакции — реакция одиночного замещения, в которой один элемент заменяет аналогичный элемент в соединении.Общая форма реакции однократного замещения (также называемой однократным вытеснением):
\ [\ ce {A} + \ ce {BC} \ rightarrow \ ce {AC} + \ ce {B} \]
В этой общей реакции элемент \ (\ ce {A} \) является металлом и заменяет элемент \ (\ ce {B} \), также металл, в соединении. Когда элемент, выполняющий замену, является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает следующий вид:
\ [\ ce {Y} + \ ce {XZ} \ rightarrow \ ce {XY} + \ ce {Z} \]
, где \ (\ ce {Y} \) — неметалл и заменяет неметалл \ (\ ce {Z} \) в соединении на \ (\ ce {X} \).
Замена металла
Магний является более химически активным металлом, чем медь. Когда полоса металлического магния помещается в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\ [\ ce {Mg} \ left (s \ right) + \ ce {Cu (NO_3) _2} \ left (aq \ right) \ rightarrow \ ce {Mg (NO_3) _2} \ left (aq \ right) + \ ce {Cu} \ left (s \ right) \]
Эта подкатегория реакций однократного замещения называется реакцией замещения металла, потому что это металл, который заменяется (медь).
Замена водорода
Многие металлы легко вступают в реакцию с кислотами, и когда они это делают, одним из продуктов реакции является газообразный водород. Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (рисунок ниже).
\ [\ ce {Zn} \ left (s \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow \ ce {ZnCl_2} \ left (aq \ right) + \ ce {H_2} \ влево (г \ вправо) \]
В реакции замещения водорода водород в кислоте заменяется активным металлом.Некоторые металлы настолько реактивны, что способны заменять водород в воде. Продуктами такой реакции являются гидроксид металла и газообразный водород. Все металлы 1-й группы подвергаются этой реакции. Натрий бурно реагирует с водой с образованием водного гидроксида натрия и водорода (см. Рисунок ниже).
\ [2 \ ce {Na} \ left (s \ right) + 2 \ ce {H_2O} \ left (l \ right) \ rightarrow 2 \ ce {NaOH} \ left (aq \ right) + \ ce {H_2 } \ left (g \ right) \]
Рисунок \ (\ PageIndex {2} \): (Первое изображение) Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции одинарного вытеснения.(Второе изображение) Металлический натрий бурно реагирует с водой с выделением газообразного водорода. Большой кусок натрия часто выделяет столько тепла, что водород воспламеняется.Замена галогена
Элемент хлор реагирует с водным раствором бромида натрия с образованием водного хлорида натрия и элементарного брома:
\ [\ ce {Cl_2} \ left (g \ right) + 2 \ ce {NaBr} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {Br_2} \ влево (л \ вправо) \]
Реакционная способность галогенной группы (группа 17) снижается сверху вниз внутри группы.Фтор является наиболее реактивным галогеном, а йод — наименее активным. Поскольку хлор выше брома, он более активен, чем бром, и может замещать его в реакции замещения галогена.
Пример \ (\ PageIndex {3} \)
Каковы продукты реакции между твердым алюминием (\ (\ ce {Al} \)) и оксидом железа (III) (\ (\ ce {Fe_2O_3} \))?
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте проблему. | Чтобы предсказать продукты, нам нужно знать, что алюминий заменит железо и образует оксид алюминия (металл заменит ион металла в соединении). Алюминий имеет заряд \ (+ 3 \), а кислород имеет заряд \ (- 2 \). Следовательно, соединение, образованное между алюминием и кислородом, будет \ (\ ce {Al_2O_3} \). Поскольку железо заменяется алюминием, железо теперь будет единственным элементом в продуктах. |
Решить. | Несбалансированное уравнение будет: \ [\ ce {Al} + \ ce {Fe_2O_3} \ rightarrow \ ce {Al_2O_3} + \ ce {Fe} \ nonumber \] и вычисленное уравнение будет: \ [2 \ ce {Al} + \ ce {Fe_2O_3} \ rightarrow \ ce {Al_2O_3} + 2 \ ce {Fe} \ nonumber \] |
| Подумайте о своем результате. | Это однократная реакция замещения, и при уравновешивании коэффициенты точно отражают, что железо и алюминий имеют одинаковый заряд в этой реакции. |
Упражнение \ (\ PageIndex {3} \)
- Напишите химическое уравнение для реакции единственного замещения между твердым цинком и раствором нитрата свинца (II) с образованием раствора нитрата цинка и твердого свинца. (Обратите внимание, что цинк образует ионы с зарядом \ (+ 2 \).)
- Предскажите продукты следующей реакции: \ (\ ce {Fe} + \ ce {CuSO_4} \). (Предположим, что в этой реакции железо образует ионы с зарядом \ (+ 2 \).)
- Ответьте на
- \ (\ ce {Zn} + \ ce {Pb (NO_3) _2} \ rightarrow \ ce {Pb} + \ ce {Zn (NO_3) _2} \)
- Ответ б
- \ (\ ce {Fe} + \ ce {CuSO_4} \ rightarrow \ ce {Cu} + \ ce {FeSO_4} \)
Реакция двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений обмениваются местами с образованием двух новых соединений.Общая форма реакции двойного замещения (также называемой двойным вытеснением):
\ [\ ce {AB} + \ ce {CD} \ rightarrow \ ce {AD} + \ ce {BC} \]
В этой реакции \ (\ ce {A} \) и \ (\ ce {C} \) являются положительно заряженными катионами, а \ (\ ce {B} \) и \ (\ ce {D} \) являются отрицательно заряженными анионами. -} \) возникают очень сильные силы притяжения, в результате чего образуется ярко-желтый осадок (рис. \ (\ PageIndex {3} \)).Другой продукт реакции, нитрат калия, остается растворимым.
Рисунок \ (\ PageIndex {3} \): Иодид свинца (II) осаждается, когда йодид калия смешивают с нитратом свинца (II) (уравнение \ ref {eq10}). (CC BY-SA 3.0; PRHaney).Образование газа
В некоторых реакциях двойного замещения образуется газообразный продукт, который затем пузырится из раствора и уходит в воздух. При смешивании растворов сульфида натрия и соляной кислоты продуктами реакции являются водный раствор хлорида натрия и газообразный сероводород:
\ [\ ce {Na_2S} \ left (aq \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {H_2S} \ влево (г \ вправо) \]
Образование молекулярного соединения
Другой вид реакции двойного замещения — это реакция, при которой в качестве одного из продуктов образуется молекулярное соединение.Многие примеры в этой категории — это реакции с образованием воды. Когда водная соляная кислота взаимодействует с водным гидроксидом натрия, продуктами являются водный раствор хлорида натрия и вода:
\ [\ ce {HCl} \ left (aq \ right) + \ ce {NaOH} \ left (aq \ right) \ rightarrow \ ce {NaCl} \ left (aq \ right) + \ ce {H_2O} \ left (л \ вправо) \]
Пример \ (\ PageIndex {4} \)
Напишите полное и сбалансированное химическое уравнение реакции двойного замещения \ (\ ce {NaCN} \ left (aq \ right) + \ ce {HBr} \ left (aq \ right) \ rightarrow \) (газообразный цианистый водород сформирован).
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте проблему. | Производство газа запускает реакцию. |
Решить. | Катионы обоих реагентов — это \ (+ 1 \) заряженные ионы, а анионы — \ (- 1 \) заряженные ионы.После обмена партнерами сбалансированное уравнение будет: \ [\ ce {NaCN} \ left (aq \ right) + \ ce {HBr} \ left (aq \ right) \ rightarrow \ ce {NaBr} \ left (aq \ right) + \ ce {HCN} \ left (г \ вправо) \] |
| Подумайте о своем результате. | Это реакция двойной замены. Все формулы верны, а уравнение сбалансировано. |
Упражнение \ (\ PageIndex {4} \)
Напишите полное и сбалансированное химическое уравнение реакции двойной замены \ (\ ce {(NH_4) _2SO_4} \ left (aq \ right) + \ ce {Ba (NO_3) _2} \ left (aq \ right) \ rightarrow \) (образуется осадок сульфата бария).
- Ответ:
- \ [\ ce {(NH_4) _2SO_4} \ left (aq \ right) + \ ce {Ba (NO_3) _2} \ left (aq \ right) \ rightarrow 2 \ ce {NH_4NO_3} \ left (aq \ right) + \ ce {BaSO_4} \ left (s \ right) \]
Иногда в результате реакции образуются как газ, так и молекулярное соединение. Реакция раствора карбоната натрия с соляной кислотой дает водный раствор хлорида натрия, газообразный диоксид углерода и воду:
\ [\ ce {Na_2CO_3} \ left (aq \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow 2 \ ce {NaCl} \ left (aq \ right) + \ ce {CO_2 } \ left (g \ right) + \ ce {H_2O} \ left (l \ right) \ nonumber \]
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Классификация химических реакций
Химические реакции, которые мы описали, представляют собой лишь небольшую часть бесконечного числа возможных химических реакций.Как химики справляются с таким огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы категоризации реакций. Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, которые образуются при контакте определенных видов соединений или элементов.
Большинство химических реакций можно разделить на один или несколько из пяти основных типов: кислотно-основные реакции. Реакция общей формы кислота + основание → соль., реакции обмена: Химическая реакция, которая имеет общую форму AB + C → AC + B или AB + CD → AD + CB., реакции конденсации. Химическая реакция, которая имеет общую форму A + B → AB. Реакции конденсации противоположны реакциям расщепления. Некоторые, но не все, реакции конденсации также являются реакциями окисления и восстановления. (и наоборот, реакции расщепления — химическая реакция, которая имеет общую форму AB → A + B. Реакции расщепления являются обратными реакциям конденсации.), и реакции окисления-восстановления — химическая реакция, которая демонстрирует изменение степени окисления одного или нескольких элементы в реагентах, которые имеют общую форму окислитель + восстановитель → восстановленный окислитель + окисленный восстановитель.. Общие формы этих пяти типов реакций приведены в Таблице 3.1 «Основные типы химических реакций» вместе с примерами каждого из них. Однако важно отметить, что многие реакции могут быть отнесены к более чем одной классификации, как вы увидите в нашем обсуждении. Схема классификации предназначена только для удобства; одну и ту же реакцию можно классифицировать по-разному, в зависимости от того, какая из ее характеристик наиболее важна. В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит чистый перенос электронов от одного атома к другому, и реакции конденсации.Кислотно-основные реакции и один вид реакции обмена — образование нерастворимой соли, такой как сульфат бария, при смешивании растворов двух растворимых солей, — будут обсуждаться в главе 4 «Реакции в водном растворе».
Реакции окисления – восстановления
Термин окисление: потеря одного или нескольких электронов в химической реакции. Говорят, что вещество, теряющее электроны, окисляется. впервые был использован для описания реакций, в которых металлы реагируют с кислородом воздуха с образованием оксидов металлов.Когда железо подвергается воздействию воздуха в присутствии воды, например, железо превращается в ржавчину — оксид железа. При контакте с воздухом металлический алюминий образует сплошной, когерентный, прозрачный слой оксида алюминия на своей поверхности. В обоих случаях металл приобретает положительный заряд, передавая электроны нейтральным атомам кислорода молекулы кислорода. В результате атомы кислорода приобретают отрицательный заряд и образуют оксидные ионы (O 2-). Поскольку металлы потеряли электроны из-за кислорода, они окислились ; окисление, следовательно, потеря электронов.И наоборот, поскольку атомы кислорода приобрели электроны, они были уменьшены на , поэтому уменьшение — это получение электронов. Для каждого окисления должно быть соответствующее восстановление.
Обратите внимание на узор
Любое окисление должно сопровождаться восстановлением и наоборот.
Первоначально термин «уменьшение» — усиление одного или нескольких электронов в химической реакции. Говорят, что вещество, которое получает электроны, восстанавливается.относится к уменьшению массы, наблюдаемому при нагревании оксида металла с оксидом углерода, реакцией, которая широко использовалась для извлечения металлов из их руд. Когда твердый оксид меди (I) нагревается, например, водородом, его масса уменьшается, поскольку образование чистой меди сопровождается потерей атомов кислорода в виде летучего продукта (воды). Реакция следующая:
Уравнение 3.24
Cu 2 O (т) + H 2 (г) → 2Cu (т) + H 2 O (г)Реакции окисления и восстановления теперь определяются как реакции, которые демонстрируют изменение степени окисления одного или нескольких элементов в реагентах, что следует за мнемоническим кодом : окисление — уменьшение потерь — это прирост или нефтяная вышка .Степень окисления — заряд, который каждый атом в соединении имел бы, если бы все его связывающие электроны были перенесены на атом с большим притяжением для электронов. каждого атома в соединении — это заряд, который имел бы атом, если бы все его связывающие электроны были перенесены на атом с более сильным притяжением электронов. Атомам в их элементарной форме, такой как O 2 или H 2 , приписывается нулевая степень окисления. Например, реакция алюминия с кислородом с образованием оксида алюминия составляет
.Уравнение 3.25
4Al (т) + 3O 2 (г) → 2Al 2 O 3 (т)Каждый нейтральный атом кислорода получает два электрона и становится отрицательно заряженным, образуя ион оксида; таким образом, кислород в продукте имеет степень окисления -2 и был восстановлен. Каждый нейтральный атом алюминия теряет три электрона, чтобы произвести в продукте ион алюминия со степенью окисления +3, поэтому алюминий был окислен. При образовании Al 2 O 3 электроны переносятся следующим образом (верхний индекс 0 подчеркивает степень окисления элементов):
Уравнение 3.26
4Al 0 + 3O 2 0 → 4Al 3+ + 6O 2-Уравнение 3.24 и уравнение 3.25 являются примерами окислительно-восстановительных (окислительно-восстановительных) реакций. В окислительно-восстановительных реакциях происходит чистый перенос электронов от одного реагента к другому. В любой окислительно-восстановительной реакции общее количество потерянных электронов должно равняться общему количеству электронов, полученных для сохранения электрической нейтральности. В уравнении 3.26, например, общее количество электронов, потерянных алюминием, равно общему количеству электронов, приобретенных кислородом:
Уравнение 3.27
потеря электронов = 4 атома Al × 3 e− потерянный атом Al = 12 e− потерянных электронов = 6 атомов O × 2 e− полученный атом O = 12 e− полученныйТа же самая картина наблюдается во всех реакциях окисления-восстановления: количество потерянных электронов должно равняться количеству полученных электронов.
Дополнительный пример окислительно-восстановительной реакции, реакции металлического натрия с кислородом в воздухе, показан на Рисунке 3.1 «Образцы 1 моля некоторых обычных веществ».
Обратите внимание на узор
Во всех окислительно-восстановительных (окислительно-восстановительных) реакциях количество потерянных электронов равно количеству полученных электронов.
Назначение состояний окисления
Приписать элементам в бинарных ионных соединениях степени окисления несложно: степени окисления элементов идентичны зарядам одноатомных ионов. В главе 2 «Молекулы, ионы и химические формулы» вы узнали, как предсказывать формулы простых ионных соединений на основе знака и величины заряда одноатомных ионов, образованных нейтральными элементами. Примерами таких соединений являются хлорид натрия (NaCl; Рисунок 3.13 «Реакция нейтрального атома натрия с нейтральным атомом хлора»), оксидом магния (MgO) и хлоридом кальция (CaCl 2 ). В ковалентных соединениях, напротив, у атомов общие электроны. Состояния окисления в ковалентных соединениях в некоторой степени произвольны, но они являются полезными учетными приборами, которые помогут вам понять и предсказать многие реакции.
Рис. 3.13 Реакция нейтрального атома натрия с нейтральным атомом хлора
Результат — перенос одного электрона от натрия к хлору с образованием ионного соединения NaCl.
Ниже приводится набор правил для присвоения степени окисления атомам в химических соединениях. Поскольку мы обсуждаем атомную и молекулярную структуру в главе 6 «Структура атомов», главе 7 «Периодическая таблица и периодические тенденции», главе 8 «Ионная и ковалентная связь» и главе 9 «Молекулярная геометрия и модели ковалентной связи», принципы, лежащие в основе этих правил, будут описаны более подробно.
Правила определения состояний окисления
- Степень окисления атома любого чистого элемента, будь то одноатомный, двухатомный или многоатомный, равна нулю.
- Степень окисления одноатомного иона такая же, как и его заряд — например, Na + = +1, Cl — = -1.
- Степень окисления фтора в химических соединениях всегда -1. Другие галогены также обычно имеют степень окисления -1, за исключением комбинации с кислородом или другими галогенами.
- Водороду присвоена степень окисления +1 в его соединениях с неметаллами и -1 в его соединениях с металлами.
- Кислороду обычно присваивается степень окисления -2 в соединениях, за двумя исключениями: в соединениях, которые содержат связи кислород-фтор или кислород-кислород, степень окисления кислорода определяется степенями окисления других присутствующих элементов.
- Сумма степеней окисления всех атомов в нейтральной молекуле или ионе должна равняться заряду молекулы или иона.
В любой химической реакции чистый заряд должен сохраняться; то есть в химической реакции общее количество электронов постоянно, как и общее количество атомов.В соответствии с этим, правило 1 гласит, что сумма индивидуальных степеней окисления атомов в молекуле или ионе должна равняться чистому заряду этой молекулы или иона. В NaCl, например, Na имеет степень окисления +1, а Cl равен -1. Чистый заряд равен нулю, как и должен быть для любого соединения.
Правило 3 требуется, потому что фтор притягивает электроны сильнее, чем любой другой элемент, по причинам, которые вы узнаете в главе 6 «Строение атомов». Следовательно, фтор является эталоном для расчета степени окисления других атомов в химических соединениях.Правило 4 отражает разницу в химии, наблюдаемую для соединений водорода с неметаллами (такими как хлор), в отличие от соединений водорода с металлами (такими как натрий). Например, NaH содержит ион H — , тогда как HCl образует ионы H + и Cl — при растворении в воде. Правило 5 необходимо, потому что фтор имеет большее притяжение для электронов, чем кислород; это правило также предотвращает нарушение правила 2. Таким образом, степень окисления кислорода составляет +2 в OF 2 , но −½ в KO 2 .Обратите внимание, что степень окисления –½ для O в KO 2 вполне приемлема.
Восстановление оксида меди (I), показанное в уравнении 3.28, демонстрирует, как применять эти правила. Правило 1 гласит, что атомы в их элементарной форме имеют нулевую степень окисления, что применимо к H 2 и Cu. Согласно правилу 4 водород в H 2 O имеет степень окисления +1, а согласно правилу 5 кислород как в Cu 2 O, так и в H 2 O имеет степень окисления -2.Правило 6 гласит, что сумма степеней окисления в молекуле или формульной единице должна равняться чистому заряду этого соединения. Это означает, что каждый атом Cu в Cu 2 O должен иметь заряд +1: 2 (+1) + (−2) = 0. Таким образом, степени окисления следующие:
Уравнение 3.28
Cu2 + 1O – 2 (т) + h30 (г) → 2Cu0 (т) + h3 + 1O – 2 (г)Присвоение степеней окисления позволяет нам увидеть, что произошел чистый перенос электронов от водорода (0 → +1) к меди (+1 → 0).Итак, это окислительно-восстановительная реакция. Еще раз, количество потерянных электронов равно количеству полученных электронов, и есть чистое сохранение заряда:
Уравнение 3.29
потеря электронов = 2 атома H × 1 e — потерянный атом H = 2 e — потеря электронов получено = 2 атома Cu × 1 e — получено атома Cu = 2 e — полученоПомните, что степени окисления полезны для визуализации переноса электронов в реакциях окисления и восстановления, но степень окисления атома и его фактический заряд одинаковы только для простых ионных соединений.Состояния окисления — удобный способ привязать электроны к атомам, и они полезны для предсказания типов реакций, которым подвергаются вещества.
Пример 14
Присвойте степени окисления всем атомам в каждом соединении.
- гексафторид серы (SF 6 )
- метанол (CH 3 OH)
- сульфат аммония [(NH 4 ) 2 SO 4 ]
- магнетит (Fe 3 O 4 )
- этановая (уксусная) кислота (CH 3 CO 2 H)
Дано: Молекулярная или эмпирическая формула
Запрошено: степеней окисления
Стратегия:
Начните с атомов, степень окисления которых можно однозначно определить из представленных правил (например, фтор, другие галогены, кислород и одноатомные ионы).Затем определите степени окисления других присутствующих атомов в соответствии с правилом 1.
Решение:
Мы знаем из правила 3, что фтор всегда имеет степень окисления -1 в своих соединениях. Шесть атомов фтора в гексафториде серы дают общий отрицательный заряд -6. Поскольку правило 1 требует, чтобы сумма степеней окисления всех атомов в нейтральной молекуле была равна нулю (здесь SF 6 ), степень окисления серы должна быть +6:
. [(6 атомов F) (- 1)] + [(1 атом S) (+6)] = 0Согласно правилам 4 и 5, водород и кислород имеют степени окисления +1 и -2 соответственно.Поскольку у метанола нет чистого заряда, углерод должен иметь степень окисления -2:
. [(4 атома H) (+ 1)] + [(1 атом O) (- 2)] + [(1 атом C) (- 2)] = 0Обратите внимание, что (NH 4 ) 2 SO 4 представляет собой ионное соединение, которое состоит как из многоатомного катиона (NH 4 + ), так и из многоатомного аниона (SO 4 2−) (см. Таблицу 2.4 «Общие многоатомные ионы и их названия»). Мы присваиваем степени окисления атомам в каждом многоатомном ионе отдельно. Для NH 4 + водород имеет степень окисления +1 (правило 4), поэтому азот должен иметь степень окисления −3:
. [(4 атома H) (+ 1)] + [(1 атом N) (- 3)] = +1, заряд на ионе NH 4 +Для SO 4 2- кислород имеет степень окисления -2 (правило 5), поэтому сера должна иметь степень окисления +6:
. [(4 атома O) (−2)] + [(1 атом S) (+ 6)] = −2, заряд сульфат-ионаКислород имеет степень окисления -2 (правило 5), что дает общий заряд -8 на формульную единицу.Это должно быть уравновешено положительным зарядом на трех атомах железа, что дает степень окисления +8/3 для железа:
[(4 атома O) (- 2)] + [(3 атома Fe) (+ 83)] = 0Дробные степени окисления разрешены, потому что степени окисления — это несколько произвольный способ отслеживания электронов. Фактически, Fe 3 O 4 можно рассматривать как имеющий два иона Fe 3+ и один ион Fe 2+ на формульную единицу, что дает чистый положительный заряд +8 на формульную единицу.Fe 3 O 4 представляет собой магнитную железную руду, обычно называемую магнетитом. В древние времена магнетит был известен как магнит, потому что его можно было использовать для изготовления примитивных компасов, указывающих на Полярную звезду (Полярную звезду), которую называли «путеводной звездой».
Изначально мы приписываем степени окисления компонентам CH 3 CO 2 H так же, как и любому другому соединению.Водород и кислород имеют степени окисления +1 и -2 (правила 4 и 5 соответственно), в результате чего общий заряд водорода и кислорода составляет
. [(4 атома H) (+ 1)] + [(2 атома O) (- 2)] = 0Значит, степень окисления углерода также должна быть нулевой (правило 6). Это, однако, средняя степень окисления для двух присутствующих атомов углерода. Поскольку каждый атом углерода имеет разный набор связанных с ним атомов, они, вероятно, будут иметь разные степени окисления.Чтобы определить степени окисления отдельных атомов углерода, мы используем те же правила, что и раньше, но с дополнительным предположением, что связи между атомами одного и того же элемента не влияют на степени окисления этих атомов. Атом углерода метильной группы (-CH 3 ) связан с тремя атомами водорода и одним атомом углерода. Из правила 4 мы знаем, что водород имеет степень окисления +1, и мы только что сказали, что связь углерод-углерод можно игнорировать при вычислении степени окисления атома углерода.Чтобы метильная группа была электрически нейтральной, ее атом углерода должен иметь степень окисления -3. Точно так же атом углерода группы карбоновой кислоты (-CO 2 H) связан с одним атомом углерода и двумя атомами кислорода. Снова игнорируя связанный атом углерода, мы приписываем степени окисления -2 и +1 атомам кислорода и водорода соответственно, что приводит к чистому заряду
. [(2 атома O) (- 2)] + [(1 атом H) (+ 1)] = −3Чтобы получить электрически нейтральную группу карбоновой кислоты, заряд этого углерода должен быть +3.Таким образом, степени окисления отдельных атомов в уксусной кислоте равны
. С − 3h4 + 1C + 3O2−2H + 1Таким образом, сумма степеней окисления двух атомов углерода действительно равна нулю.
Exercise
Присвойте степени окисления всем атомам в каждом соединении.
- фторид бария (BaF 2 )
- формальдегид (CH 2 O)
- дихромат калия (K 2 Cr 2 O 7 )
- оксид цезия (CsO 2 )
- этанол (CH 3 CH 2 OH)
Ответ:
- Ba, +2; F, −1
- С, 0; H, +1; О, −2
- К, +1; Cr, +6; О, −2
- Cs, +1; O, −½
- ° С, -3; H, +1; С, -1; H, +1; О, -2; H, +1
Окислители и восстановители
Соединения, способные принимать электроны, такие как O 2 или F 2 , называются окислителями (или окислителями). Соединение, способное принимать электроны; таким образом сокращается.потому что они могут окислять другие соединения. В процессе приема электронов окислитель восстанавливается. Соединения, которые способны отдавать электроны, такие как металлический натрий или циклогексан (C 6 H 12 ), называются восстановителями (или восстанавливающими агентами). Соединение, которое способно отдавать электроны; таким образом он окисляется. потому что они могут вызвать сокращение другого соединения. В процессе передачи электронов восстановитель окисляется. Эти отношения суммированы в уравнении 3.30:
Уравнение 3.30
окислитель + восстановитель → окисление-восстановление O2 (г) получает e– (восстанавливается) + 4Na (s) теряет e– (окисляется) → 2Na2O (s) окислительно-восстановительная реакцияНекоторые окислители обладают большей способностью, чем другие, удалять электроны из других соединений. Окислители могут варьироваться от очень сильных, способных окислять большинство соединений, с которыми они контактируют, до довольно слабых.И F 2 , и Cl 2 являются мощными окислителями: например, F 2 окисляет H 2 O в бурной, потенциально взрывоопасной реакции. Напротив, S 8 является довольно слабым окислителем, а O 2 находится где-то посередине. И наоборот, восстановители различаются по своей склонности отдавать электроны другим соединениям. Восстановители также могут варьироваться от очень мощных, способных отдавать электроны практически чему угодно, до слабых. Щелочные металлы являются мощными восстановителями, поэтому их следует хранить вдали от кислорода воздуха, чтобы избежать потенциально опасной окислительно-восстановительной реакции.
Реакция горения Реакция окисления-восстановления, в которой окислителем является O2., Впервые введенная в разделе 3.2 «Определение эмпирических и молекулярных формул», представляет собой реакцию окисления-восстановления, в которой окислителем является O 2 . Одним из примеров реакции горения является горение свечи, показанное на Рисунке 3.9 «Пример реакции горения». Рассмотрим, например, сжигание циклогексана, типичного углеводорода, в избытке кислорода. Сбалансированное химическое уравнение реакции со степенью окисления для каждого атома выглядит следующим образом:
Уравнение 3.31
C6–2h22 + 1 + 9O20 → 6C + 4O2–2 + 6h3 + 1O – 2Если мы сравним степень окисления каждого элемента в продуктах и реагентах, мы увидим, что водород — единственный элемент, степень окисления которого не изменяется; остается +1. Углерод, однако, имеет степень окисления -2 в циклогексане и +4 в CO 2 ; то есть каждый атом углерода меняет свою степень окисления на шесть электронов во время реакции. Кислород имеет степень окисления 0 в реагентах, но он получает электроны, чтобы иметь степень окисления -2 в CO 2 и H 2 O.Поскольку углерод был окислен, восстановителем является циклогексан; поскольку кислород был восстановлен, он является окислителем. Таким образом, все реакции горения являются реакциями окисления и восстановления.
Реакции конденсации
Реакция брома с этиленом с образованием 1,2-дибромэтана, который используется в сельском хозяйстве для уничтожения нематод в почве, выглядит следующим образом:
Уравнение 3.32
C 2 H 4 (г) + Br 2 (г) → BrCH 2 CH 2 Br (г)Согласно таблице 3.1 «Основные типы химических реакций», это реакция конденсации, потому что она имеет общий вид A + B → AB. Эта реакция, однако, также может рассматриваться как реакция окисления-восстановления, в которой электроны передаются от углерода (−2 → −1) к брому (0 → −1). Другой пример реакции конденсации — реакция, используемая для промышленного синтеза аммиака:
Уравнение 3.33
3H 2 (г) + N 2 (г) → 2NH 3 (г)Хотя эта реакция также имеет общую форму реакции конденсации, водород был окислен (0 → +1), а азот восстановлен (0 → −3), поэтому ее также можно классифицировать как реакцию окисления-восстановления.
Не все реакции конденсации являются окислительно-восстановительными. Например, реакция амина с карбоновой кислотой представляет собой вариант реакции конденсации (A + B → A′B ′ + C): два больших фрагмента конденсируются с образованием одной молекулы, а молекула гораздо меньшего размера, такая как как H 2 O, исключено. В этой реакции -OH из группы карбоновой кислоты и -H из аминогруппы удаляются как H 2 O, и реакция образует амидную связь (также называемую пептидной связью ), которая связывает две фрагменты.Амидные связи являются важной структурной единицей, связывающей строительные блоки белков и многих полимеров вместе, как описано в главе 12 «Твердые тела». Например, нейлон получают в результате реакции конденсации (рис. 3.14 «Производство нейлона»).
Амидные связи. Реакция амина с карбоновой кислотой протекает путем удаления воды и образования новой C – N (амидной) связи.
Рисунок 3.14 Производство нейлона
Пример 15
Следующие ниже реакции имеют важное промышленное применение.Используя таблицу 3.1 «Основные типы химических реакций», классифицируйте каждую реакцию как реакцию окисления-восстановления, кислотно-щелочную реакцию, реакцию обмена, реакцию конденсации или реакцию расщепления. Для каждой окислительно-восстановительной реакции укажите окислитель и восстановитель и укажите, какие атомы окисляются или восстанавливаются. (Не забывайте, что некоторые реакции можно отнести к нескольким категориям.)
- C 2 H 4 (г) + Cl 2 (г) → ClCH 2 CH 2 Cl (г)
- AgNO 3 (водн.) + NaCl (водн.) → AgCl (т.) + NaNO 3 (водн.)
- CaCO 3 (т) → CaO (т) + CO 2 (г)
- Ca 5 (PO 4 ) 3 (OH) (s) + 7H 3 PO 4 (водн.) + 4H 2 O (л) → 5Ca (H 2 PO 4 ) 2 · H 2 O (с)
- Pb (с) + PbO 2 (с) + 2H 2 SO 4 (водн.) → 2PbSO 4 (с) + 2H 2 O (л)
Дано: вычисленное химическое уравнение
Запрошено: Классификация химической реакции
Стратегия:
A Определите общий вид уравнения, обратившись к таблице 3.1 «Основные типы химических реакций», а затем классифицируйте реакции.
B Для окислительно-восстановительных реакций присвойте степени окисления каждому атому, присутствующему в реагентах и продуктах. Если степень окисления одного или нескольких атомов изменяется, то реакция является окислительно-восстановительной. В противном случае реакция должна быть одним из других типов реакций, перечисленных в Таблице 3.1 «Основные типы химических реакций».
Решение:
A Эта реакция используется для получения 1,2-дихлорэтана, одного из 25 ведущих промышленных химикатов на Рисунке 2.22 «25 лучших химических веществ, произведенных в США в 2002 году *». Он имеет общий вид A + B → AB, который типичен для реакции конденсации. B Поскольку реакции могут относиться к более чем одной категории, нам необходимо посмотреть на степени окисления атомов:
C2–2h5 + 1 + Cl20 → Cl – 1C – 1h3 + 1C – 1h3 + 1Cl – 1Степени окисления показывают, что хлор восстанавливается от 0 до -1, а углерод окисляется от -2 до -1, так что это окислительно-восстановительная реакция, а также реакция конденсации.Этилен является восстановителем, а хлор — окислителем.
A Эта реакция используется для получения хлорида серебра для изготовления фотопленки. Химическое уравнение имеет общий вид AB + CD → AD + CB, поэтому оно классифицируется как реакция обмена. B Степени окисления атомов следующие
Ag + 1N + 5O3–2 + Na + 1Cl – 1 → Ag + 1Cl – 1 + Na + 1N + 5O3–2Нет изменений в степенях окисления, поэтому это не окислительно-восстановительная реакция.
AgCl (s) осаждается при смешивании растворов AgNO 3 (водный) и NaCl (водный). NaNO 3 (водн.) Находится в растворе в виде ионов Na + и NO 3 —.
A Эта реакция используется для получения извести (CaO) из известняка (CaCO 3 ) и имеет общую форму AB → A + B.Общая форма химического уравнения указывает на то, что его можно классифицировать как реакцию расщепления, обратную реакции конденсации. B Степени окисления атомов следующие:
Ca + 2C + 4O3–2 → Ca + 2O – 2 + C + 4O2–2Поскольку степени окисления всех атомов в продуктах и реагенте одинаковы, это , а не окислительно-восстановительная реакция.
A Эта реакция используется для получения «супер тройного фосфата» в удобрении.Одним из реагентов является фосфорная кислота, которая переносит протон (H + ) на фосфат- и гидроксид-ионы гидроксиапатита [Ca 5 (PO 4 ) 3 (OH)] с образованием H 2 PO 4 — и H 2 O соответственно. Это кислотно-основная реакция, в которой H 3 PO 4 является кислотой (донор H + ), а Ca 5 (PO 4 ) 3 (OH) является основанием (H + акцептор).
B Чтобы определить, является ли это также окислительно-восстановительной реакцией, мы присваиваем атомам степени окисления:
Ca5 + 2 (P + 5O4–2) 3 (O – 2H + 1) + 7h4 + 1P + 5O4–2 + 4H + 12O – 2 → 5Ca + 2 (H + 12P + 5O4–2) 2 · h3 + 1O –2Поскольку степень окисления не меняется, это не окислительно-восстановительная реакция.
A Эта реакция происходит в обычном автомобильном аккумуляторе при каждом запуске двигателя.Кислота (H 2 SO 4 ) присутствует и переносит протоны на кислород в PbO 2 с образованием воды во время реакции. Таким образом, реакцию можно описать как кислотно-щелочную реакцию.
B Степени окисления следующие:
Pb0 + Pb + 4O2–2 + 2h3 + 1S + 6O4–2 → 2Pb + 2S + 6O4–2 + 2h3 + 1O – 2Степень окисления свинца изменяется с 0 в Pb и +4 в PbO 2 (оба реагента) до +2 в PbSO 4 .Это также окислительно-восстановительная реакция, в которой элементарный свинец является восстановителем, а PbO 2 является окислителем. Какое описание правильное? Оба.
Схема автомобильного аккумулятора на 12 В. Показано расположение реагентов (металлический свинец в губчатой форме с большой площадью поверхности) и PbO 2 . Продукт (PbSO 4 ) образует белое твердое вещество между пластинами.
Упражнение
Используя таблицу 3.1 «Основные типы химических реакций» классифицируют каждую реакцию как реакцию окисления-восстановления, кислотно-щелочную реакцию, реакцию обмена, реакцию конденсации или реакцию расщепления. Для каждой окислительно-восстановительной реакции укажите окислитель и восстановитель и укажите, какие атомы окисляются или восстанавливаются.
- Al (тв.) + OH — (водн.) + 3H 2 O (л) → 3 / 2H 2 (г) + [Al (OH) 4 ] — (водн.)
- TiCl 4 (л) + 2Mg (л) → Ti (тв) + 2MgCl 2 (л)
- MgCl 2 (водн.) + Na 2 CO 3 (водн.) → MgCO 3 (т.) + 2NaCl (водн.)
- CO (г) + Cl 2 (г) → Cl 2 CO (л)
- H 2 SO 4 (л) + 2NH 3 (г) → (NH 4 ) 2 SO 4 (с)
Ответ:
- Окислительно-восстановительная реакция; восстановитель — Al, окислитель — H 2 O; Al окисляется, H восстанавливается.Это реакция, которая возникает, когда Drano используется для очистки забитого слива.
- Редокс-реакция; восстановитель — Mg, окислитель — TiCl 4 ; Mg окисляется, Ti восстанавливается.
- Обменная реакция. Эта реакция является причиной образования накипи в кофеварках в местах с жесткой водой.
- И реакция конденсации, и окислительно-восстановительная реакция; восстановитель — СО, окислитель — Cl 2 ; C окисляется, Cl восстанавливается.Продуктом этой реакции является фосген, высокотоксичный газ, который использовался в качестве химического оружия во время Первой мировой войны. В настоящее время фосген используется для получения полиуретанов, которые используются в пеноматериалах для постельных принадлежностей и мебели, а также в различных покрытиях.
- Кислотно-основная реакция.
Катализаторы
Многие химические реакции, в том числе некоторые из тех, что обсуждались ранее, протекают быстрее в присутствии катализатора — вещества, которое увеличивает скорость химической реакции, не претерпевая самого чистого химического изменения., которое является веществом, которое участвует в реакции и заставляет ее протекать быстрее, но может быть восстановлено без изменений в конце реакции и повторно использовано. Поскольку катализаторы не участвуют в стехиометрии реакции, они обычно показаны над стрелкой в чистом химическом уравнении. Химические процессы в промышленности в значительной степени зависят от использования катализаторов, которые обычно добавляют в реакционную смесь в следовых количествах, и большинство биологических реакций не происходит без биологического катализатора или фермента. Катализаторы, которые возникают в естественных условиях в живых организмах и катализируют биологические реакции.. Примерами катализируемых реакций в промышленности являются использование платины в крекинге и риформинге нефти, реакция SO 2 и O 2 в присутствии V 2 O 5 с получением SO 3 в промышленных условиях. синтез серной кислоты и использование серной кислоты в синтезе таких соединений, как этилацетат и прокаин. Катализаторы не только значительно увеличивают скорость реакций, но в некоторых случаях, например, при переработке нефти, они также контролируют образующиеся продукты.Ускорение реакции катализатором называется катализом. Ускорение химической реакции катализатором.
Гетерогенный катализатор. Эта большая круглая сетка, сотканная из родий-платиновой проволоки, является гетерогенным катализатором при промышленном производстве азотной кислоты путем окисления аммиака.
Катализаторы можно разделить на гомогенные и гетерогенные. Гомогенный катализатор — катализатор, который равномерно диспергирован в смеси реагентов с образованием раствора.равномерно диспергирован по всей смеси реагентов с образованием раствора. Например, серная кислота представляет собой гомогенный катализатор, используемый при синтезе сложных эфиров, таких как прокаин (Пример 13). Сложный эфир имеет структуру, аналогичную структуре карбоновой кислоты, в которой атом водорода, присоединенный к кислороду, заменен группой R. Они ответственны за ароматы многих фруктов, цветов и духов. Другими примерами гомогенных катализаторов являются ферменты, которые позволяют нашему телу функционировать.Напротив, гетерогенный катализатор — это катализатор, который находится в другом физическом состоянии, чем реагенты. находится в другом физическом состоянии, чем реагенты. По экономическим причинам в большинстве промышленных процессов используются гетерогенные катализаторы в виде твердых веществ, которые добавляют к растворам реагентов. Поскольку такие катализаторы часто содержат дорогие драгоценные металлы, такие как платина или палладий, имеет смысл формулировать их в виде твердых веществ, которые можно легко отделить от жидкой или газообразной смеси реагент-продукт и восстановить.Примерами гетерогенных катализаторов являются оксиды железа, используемые в промышленном синтезе аммиака, и каталитические преобразователи, используемые практически во всех современных автомобилях, которые содержат драгоценные металлы, такие как палладий и родий. Более подробно катализ будет обсуждаться в главе 14 «Химическая кинетика», когда мы будем обсуждать скорости реакции, но вы часто будете встречать этот термин по всему тексту.
Сводка
Химические реакции могут быть классифицированы как реакция цид-основание , реакция обмена , реакция конденсации и ее обратная реакция, реакция расщепления и реакция окисления-восстановления (или окислительно-восстановительная) .Чтобы отслеживать электроны в химических реакциях, атомам в соединениях приписываются степени окисления. Степень окисления — это заряд, который имел бы атом, если бы все его связывающие электроны были полностью переданы атому, который имеет большее притяжение для электронов. В реакции окисления-восстановления один атом должен потерять электроны, а другой — получить электроны. Окисление — это потеря электронов, а элемент, степень окисления которого увеличивается, называется окисленным . Восстановление — это усиление электронов, а элемент, степень окисления которого снижается, называется восстановленным . Окислители — это соединения, которые способны принимать электроны от других соединений, поэтому они восстанавливаются во время реакции окисления-восстановления. Напротив, восстановители представляют собой соединения, которые способны отдавать электроны другим соединениям, поэтому они окисляются во время реакции окисления-восстановления. Реакция горения представляет собой окислительно-восстановительную реакцию, в которой окислителем является O 2 (г).Амидная связь образуется в результате реакции конденсации между карбоновой кислотой и амином; это важная структурная единица белков и многих полимеров. Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая самого чистого химического изменения. Биологический катализатор называется ферментом . Катализ — это ускорение скорости реакции, вызванное присутствием вещества, которое не фигурирует в химическом уравнении.Гомогенный катализатор равномерно диспергирован в растворе реагентов, тогда как гетерогенный катализатор присутствует в виде другой фазы, обычно твердой.
Key Takeaway
- Химические реакции можно разделить на кислотно-основные, обменные, конденсационные, расщепляющие и окислительно-восстановительные (окислительно-восстановительные).
Концептуальные проблемы
Что такое реакция горения? Как его отличить от реакции обмена?
Какие два продукта образуются при сгорании органического соединения, содержащего только углерод, водород и кислород? Возможно ли образование только этих двух продуктов в результате реакции, не являющейся реакцией горения? Поясните свой ответ.
Какие факторы определяют, можно ли классифицировать реакцию как окислительно-восстановительную?
Назовите три характеристики сбалансированной окислительно-восстановительной реакции.
Окислитель принимает электроны или отдает их?
Становится ли степень окисления восстановителя более положительной или более отрицательной во время окислительно-восстановительной реакции?
Азот, водород и аммиак, как известно, существовали на первозданной земле, однако смеси азота и водорода обычно не реагируют с образованием аммиака.У какого природного явления было бы достаточно энергии, чтобы инициировать реакцию между этими двумя первичными газами?
Катализаторы не добавляют в реакции в стехиометрических количествах. Почему?
Укажите, используется ли в каждом из следующих случаев гомогенный или гетерогенный катализатор.
- Металлическая платина используется в автомобильном катализаторе.
- Азот биологически превращается в аммиак под действием фермента.
- Окись углерода и водород объединяются с образованием метана и воды с никелевым катализатором.
- Растворенное соединение родия используется в качестве катализатора превращения алкена в алкан.
Укажите, используется ли в каждом из следующих случаев гомогенный или гетерогенный катализатор.
- Гранулы ZSM-5, минерала, содержащего алюминий и кремний, используются для катализирования превращения метанола в бензин.
- Превращение глюкозы в карбоновую кислоту происходит при катализе ферментом глюкозооксидазой.
- Металлический родий используется для превращения моноксида углерода и воды в диоксид углерода и водород.
Заполните следующую таблицу, чтобы описать некоторые ключевые различия между гомогенным и гетерогенным катализом.
Однородный Гетерогенный количество фаз Простота отделения от продукта Простота восстановления катализатора Чтобы увеличить скорость реакции, ученый решил использовать катализатор.Неожиданно ученый обнаружил, что катализатор снижает выход желаемого продукта, а не увеличивает его. Что могло случиться?
Ответ
Однородный Гетерогенный количество фаз однофазный минимум две фазы Простота отделения от продукта сложный легкий Простота восстановления катализатора сложный легкий
Числовые задачи
Классифицируйте каждую химическую реакцию по типам, перечисленным в Таблице 3.1 «Основные типы химических реакций».
- 12FeCl 2 (с) + 3O 2 (г) → 8FeCl 3 (с) + 2Fe 2 O 3 (с)
- CaCl 2 (водн.) + K 2 SO 4 (водн.) → CaSO 4 (т.) + 2KCl (водн.)
- HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
- Br 2 (л) + C 2 H 4 (г) → BrCH 2 CH 2 Br (л)
Классифицируйте каждую химическую реакцию по типам, перечисленным в таблице 3.1 «Основные типы химических реакций».
- 4FeO (т) + O 2 (г) → 2Fe 2 O 3 (т)
- Ca 3 (PO 4 ) 2 (с) + 3H 2 SO 4 (вод.) → 3CaSO 4 (с) + 2H 3 PO 4 (вод.)
- HNO 3 (водн.) + KOH (водн.) → KNO 3 (водн.) + H 2 O (л)
- этан (г) + кислород (г) → диоксид углерода (г) + вода (г)
Назначьте степени окисления атомам в каждом соединении или ионе.
- (NH 4 ) 2 S
- фосфат-ион
- [AlF 6 ] 3-
- CuS
- HCO 3 —
- NH 4 +
- H 2 SO 4
- муравьиная кислота
- n -бутанол
Назначьте степени окисления атомам в каждом соединении или ионе.
- ClO 2
- HO 2 —
- бикарбонат натрия
- MnO 2
- PCl 5
- [Mg (H 2 O) 6 ] 2+
- N 2 O 4
- бутановая кислота
- метанол
Выровняйте это химическое уравнение:
NaHCO 3 (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + CO 2 (г) + H 2 O (л)Что это за реакция? Обосновать ответ.
Присвойте атомам в каждом соединении степени окисления.
- нитрат железа (III)
- Al 2 O 3
- сульфат калия
- Cr 2 O 3
- перхлорат натрия
- Cu 2 S
- гидразин (N 2 H 4 )
- НЕТ 2
- n -пентанол
Присвойте атомам в каждом соединении степени окисления.
- карбонат кальция
- NaCl
- CO 2
- дихромат калия
- КМно 4
- оксид железа
- Cu (OH) 2
- Na 2 SO 4
- n -гексанол
Для каждой окислительно-восстановительной реакции определите идентичность окислителя, восстановителя, окисленных и восстановленных частиц.
- H 2 (г) + I 2 (с) → 2HI (г)
- 2Na (т) + 2H 2 O (л) → 2NaOH (водн.) + H 2 (г)
- 2F 2 (г) + 2NaOH (водн.) → OF 2 (г) + 2NaF (водн.) + H 2 O (л)
Для каждой окислительно-восстановительной реакции определите идентичность окислителя, восстановителя, окисленных и восстановленных частиц.
- 2Na (тв) + Cl 2 (г) → 2NaCl (тв)
- SiCl 4 (л) + 2Mg (с) → 2MgCl 2 (с) + Si (с)
- 2H 2 O 2 (водн.) → 2H 2 O (л) + O 2 (г)
Сбалансируйте каждое химическое уравнение. Затем определите окислитель, восстановитель, окисленные и восстановленные частицы.(Δ означает, что реакция требует нагревания.)
- H 2 O (г) + CO (г) → CO 2 (г) + H 2 (г)
- реакция оксида алюминия, углерода и газообразного хлора при 900 ° C с образованием хлорида алюминия и оксида углерода
- HgO (т) → ΔHg (л) + O2 (г)
Сбалансируйте каждое химическое уравнение.Затем определите окислитель, восстановитель, окисленные и восстановленные частицы. (Δ означает, что реакция требует нагревания.)
- реакция воды и углерода при 800ºC с образованием водорода и окиси углерода
- Mn (s) + S 8 (s) + CaO (s) → CaS (s) + MnO (s)
реакция этилена и кислорода при повышенной температуре в присутствии серебряного катализатора с образованием оксида этилена
- ZnS (тв.) + H 2 SO 4 (водн.) + O 2 (г) → ZnSO 4 (водн.) + S 8 (т.) + H 2 O (л)
Серебро потускнело из-за сероводорода, атмосферного загрязнителя, с образованием тонкого слоя темного сульфида серебра (Ag 2 S) вместе с газообразным водородом.
- Напишите вычисленное химическое уравнение этой реакции.
- Какие виды были окислены, а какие восстановлены?
- Предполагая, что 2,2 г Ag превратилось в сульфид серебра, постройте таблицу, показывающую реакцию с точки зрения количества атомов в реагентах и продуктах, молей реагентов и продуктов, граммов реагентов и продуктов и молекул реактивы и продукты.
В целлюлозно-бумажной промышленности используется следующая реакция:
Na 2 SO 4 (водн.) + C (s) + NaOH (водн.) → Na 2 CO 3 (водн.) + Na 2 S (водн.) + H 2 O (л )- Выровняйте химическое уравнение.
- Укажите окислитель и восстановитель.
- Сколько углерода нужно для преобразования 2,8 кг сульфата натрия в сульфид натрия?
- Если бы выход реакции был только 78%, сколько килограммов карбоната натрия было бы произведено из 2,80 кг сульфата натрия?
- Если бы в реакции использовали 240 г углерода и 2,80 кг сульфата натрия, какой был бы ограничивающий реагент (при условии избытка гидроксида натрия)?
Реакция A 2 (синий) с B 2 (желтый) показана ниже.Слева показана исходная реакционная смесь, а справа — смесь после завершения реакции.
- Напишите вычисленное химическое уравнение реакции.
- Какой реагент является ограничивающим в исходной реакционной смеси?
- Сколько молей продукта AB 4 можно получить из смеси 0.020 моль A 2 и 0,060 моль B 2 ?
Реакция X 4 (оранжевый) с Y 2 (черный) показана ниже. Слева показана исходная реакционная смесь, а справа — смесь после завершения реакции.
- Напишите вычисленное химическое уравнение реакции.
- Какой реагент является ограничивающим в исходной реакционной смеси?
- Сколько молей продукта XY 3 можно получить из смеси 0,100 моль X 4 и 0,300 моль Y 2 ?
Метилбутират, искусственный яблочный ароматизатор, используемый в пищевой промышленности, получают реакцией бутановой кислоты с метанолом в присутствии кислотного катализатора (H + ):
Ch4Ch3Ch3COOH (л) + Ch4OH (л) → H + Ch4Ch3Ch3CO2Ch4 (л) + h3O (л)- Дано 7.8 г бутановой кислоты, сколько граммов метилбутирата можно было бы синтезировать при 100% выходе?
- В результате реакции получают 5,5 г метилбутирата. Какая была процентная доходность?
- Катализатор, используемый в этой реакции, гетерогенный или гомогенный?
В присутствии платинового катализатора водород и бром реагируют при повышенных температурах (300 ° C) с образованием бромистого водорода (тепло обозначается Δ):
h3 (г) + Br2 (ж) → ΔPt 2HBr (г)Рассчитайте массу произведенного бромистого водорода с учетом следующего:
- 8.23 × 10 22 молекул H 2
- 6,1 × 10 3 моль H 2
- 1,3 × 10 5 г H 2
- Катализатор, используемый в этой реакции, гетерогенный или гомогенный?
Убедитесь, что вы знакомы с темами, обсуждаемыми в разделе Основные навыки 2 (Раздел 3.7 «Основные навыки 2»), прежде чем переходить к числовым задачам.
ответов
- окислительно-восстановительная реакция
- обмен
- кислотно-щелочная
- конденсация
- S, -2; N, -3; H, +1
- П, +5; О, −2
- F, -1; Ал, +3
- S, −2; Cu, +2
- H, +1; О, -2; С, +4
- H, +1; N, −3
- H, +1; О, -2; S, +6
- H, +1, O, -2; С, +2
бутанол:
O, -2; H, +1
Слева направо: C, −3–2–2–1
2NaHCO 3 (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + 2CO 2 (г) + 2H 2 O (л) кислота –Основная реакция
- Ca, +2; О, -2; С, +4
- Na, +1; Cl, -1
- O, -2; С, +4
- К, +1; О, -2; Cr, +6
- К, +1; О, -2; Пн, +7
- O, -2; Fe, +3
- O, -2; H, +1; Cu, +2
- O, -2; S, +6
Гексанол
O, -2; H, +1
Слева направо: C: −3, −2, −2, −2, −2, −1
- Na является восстановителем и окисляется.Cl 2 является окислителем и восстанавливается.
- Mg является восстановителем и окисляется. Si является окислителем и восстанавливается.
- H 2 O 2 одновременно является окислителем и восстановителем. Одна молекула окисляется, а одна молекула восстанавливается.
H 2 O (г) + C (т) → Δ H 2 (г) + CO (г)
C является восстановителем и окисляется.H 2 O является окислителем и восстанавливается.
8Mn (с) + S 8 (с) + 8CaO (с) → 8CaS (с) + 8MnO (с)
Mn является восстановителем и окисляется. S 8 является окислителем и восстанавливается.
2C 2 H 4 (г) + O 2 (г) → Δ 2C 2 H 4 O (г)
Этилен является восстановителем и окисляется.O 2 является окислителем и восстанавливается.
8ZnS (s) + 8H 2 SO 4 (вод.) + 4O 2 (г) → 8ZnSO 4 (вод.) + S 8 (s) + 8H 2 O (л)
Сульфид в ZnS является восстановителем и окисляется. O 2 является окислителем и восстанавливается.
- Na 2 SO 4 + 2C + 4NaOH → 2Na 2 CO 3 + Na 2 S + 2H 2 O
- Сульфат-ион является окислителем, а восстановитель — углеродом.
- 470 г
- 3300 г
- углерод
- 22,1 г
- 9.9 × 10 5 г
- 1,0 × 10 7 г
- неоднородный
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
типов химических реакций (с примерами)
Химическая реакция — это процесс, обычно характеризующийся химическим изменением, при котором исходные материалы (реагенты) отличаются от продуктов. В химических реакциях обычно происходит движение электронов, что приводит к образованию и разрыву химических связей.Существует несколько различных типов химических реакций и несколько способов их классификации. Вот несколько распространенных типов реакции:
Окисление-восстановление или окислительно-восстановительная реакция
В окислительно-восстановительной реакции степени окисления атомов изменяются. Окислительно-восстановительные реакции могут включать перенос электронов между химическими веществами.
Реакция, которая происходит, когда I 2 восстанавливается до I — и S 2 O 3 2- (тиосульфат-анион) окисляется до S 4 O 6 2- дает пример окислительно-восстановительной реакции:
2 S 2 O 3 2- (водн.) + I 2 (водн.) → S 4 O 6 2- (водн.) + 2 I — (водн.)
В реакции синтеза два или более химических соединения объединяются с образованием более сложного продукта.
A + B → AB
Сочетание железа и серы с образованием сульфида железа (II) является примером реакции синтеза:
8 Fe + S 8 → 8 FeS
Реакция химического разложения или анализа
В реакции разложения соединение распадается на более мелкие химические частицы.
AB → A + B
Электролиз воды на кислород и газообразный водород является примером реакции разложения:
2 H 2 O → 2 H 2 + O 2
Одиночное вытеснение или реакция замещения
Реакция замещения или однократного замещения характеризуется тем, что один элемент вытесняется из соединения другим элементом.
A + BC → AC + B
Пример реакции замещения происходит, когда цинк соединяется с соляной кислотой. Цинк заменяет водород:
Zn + 2 HCl → ZnCl 2 + H 2
Метатезис или реакция двойного вытеснения
В реакции двойного замещения или метатезиса два соединения обмениваются связями или ионами с образованием разных соединений.
AB + CD → AD + CB
Пример реакции двойного замещения между хлоридом натрия и нитратом серебра с образованием нитрата натрия и хлорида серебра.
NaCl (водн.) + AgNO 3 (водн.) → NaNO 3 (водн.) + AgCl (т. Е.)
Кислотно-основная реакция
Кислотно-основная реакция — это тип реакции двойного замещения, который происходит между кислотой и основанием. Ион H + в кислоте реагирует с ионом OH — в основании с образованием воды и ионной соли:
HA + BOH → H 2 O + BA
Реакция между бромистоводородной кислотой (HBr) и гидроксид натрия является примером кислотно-основной реакции:
HBr + NaOH → NaBr + H 2 O
Реакция горения — это тип окислительно-восстановительной реакции, в которой горючий материал соединяется с окислителем с образованием окисленных продуктов и выделением тепла (экзотермическая реакция).Обычно в реакции горения кислород соединяется с другим соединением с образованием диоксида углерода и воды. Примером реакции горения является горение нафталина:
C 10 H 8 + 12 O 2 → 10 CO 2 + 4 H 2 O
Изомеризация
В реакции изомеризации структурное расположение соединения изменяется, но его чистый атомный состав остается прежним.
Реакция гидролиза
В реакции гидролиза участвует вода.Общая форма реакции гидролиза:
X — (водн.) + H 2 O (l) ↔ HX (водн.) + OH — (водн.)
Основные типы реакций
Существуют сотни и даже тысячи видов химических реакций! Если вас попросят назвать основные 4, 5 или 6 типов химических реакций, вот как они классифицируются. Основными четырьмя типами реакций являются прямая комбинация, реакция анализа, одинарное смещение и двойное смещение. Если вас спросят о пяти основных типах реакций, это четыре, а затем либо кислотно-основные, либо окислительно-восстановительные (в зависимости от того, кого вы спросите).

 е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
 К.Толстой)
К.Толстой)
 N2 + O2 = 2NO – Q
N2 + O2 = 2NO – Q
