строение, функции, роль в биосинтезе белка
Рибосомы — субмикроскопические немембранные органеллы, необходимые для синтеза белка. Они объединяют аминокислоты в пептидную цепь, образуя новые белковые молекулы. Биосинтез осуществляется по матричной РНК путем трансляции.
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.
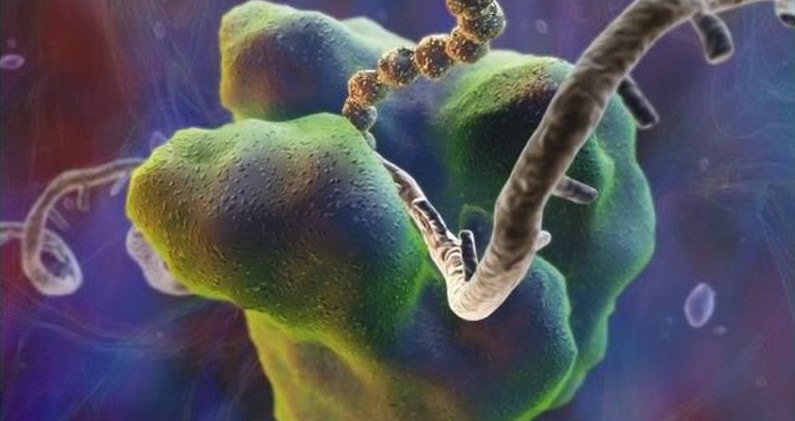
Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
Выделяют 2 вида рибосом:
- Малые – находятся в прокариотических клетках, а также в хлоропластах и митохондриальном матриксе. Они не связаны с мембраной и имеют меньшие размеры (в диаметре до 15нм).
- Большие – находятся в эукариотических клетках, могут достигать в диаметре до 23нм, связываются с эндоплазматической сетью или крепятся к мембране ядра.
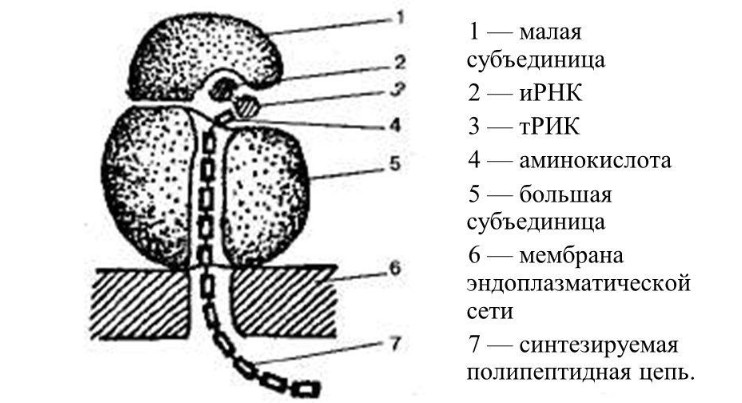 Схема строения
Схема строенияСтроение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
Образование в клетке
Субъединицы рибосом формируются в ядрышке. Матрицей для синтеза рибосомальной РНК является ДНК. Для полного созревания они проходят несколько этапов:
- Эосома – первая фаза, при этом в ядрышке на ДНК синтезируется лишь рРНК;
- неосома – структура включающая не только рРНК, но и белки, после ряда модификаций выходит в цитоплазму;
- рибисома – зрелая органелла, состоящая из двух субъединиц.
| Функции элементов рибосом | ||
|---|---|---|
| Структура | Строение | Функции |
| Большая субъединица | Большая субъединица Треугольная, в диаметре 16нм, состоит из 3 молекул РНК и 33 белковых молекул Трансляция, декодирование генетической информации | Трансляция, декодирование генетической информации |
| Малая субъединица | Вогнутая, овальная, в диметре 14нм, состоит из 1 молекулы РНК и 21 белковых молекул | Объединение аминокислот, создание пептидных связей, синтез новых молекул белка |
Биосинтез белков на рибосомах
Трансляция или синтез белков на рибосомах с матрицы иРНК – конечный этап преобразования генетической информации в клетках. Во время трансляции информация, закодированная в нуклеиновых кислотах, переходит в белковые молекулы со строгой последовательностью аминокислот.
Трансляция – весьма непростой этап (в сравнении с репликацией и транскрипцией). Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции, новообразованная молекула иРНК, выходит из ядра в цитоплазму. Здесь после нескольких преобразований она соединяется с рибосомой. При этом аминокислоты приводятся в действие после взаимодействия с энергетическим субстратом – молекулой АТФ.
Аминокислоты и иРНК имеют разный химический состав и без постороннего участия не могут взаимодействовать между собой. Для преодоления этой несовместимости существует транспортная РНК. Под действием ферментов аминокислоты соединяются с тРНК. В таком виде они переносятся на рибосому и тРНК, с определенной аминокислотой, прикрепляется на иРНК в предназначенном месте. Далее рибосомальные ферменты формируют пептидную связь между присоединенной аминокислотой и строящимся полипептидом. После рибосома перемещается по цепи информационной РНК, оставляя участок для прикрепления следующей аминокислоты.
Рост полипептида идет до того момента, пока рибосома не встретит «стоп-кодон», который сигнализирует об окончании синтеза. Для освобождения новосинтезированного пептида от рибосомы включаются факторы терминации, окончательно завершающие биосинтез. К последней аминокислоте прикрепляется молекула воды, а рибосома распадается на две субъединицы.
Когда рибосома продвигается дальше по иРНК, она освобождает начальный отрезок цепи. К нему снова может присоединиться рибосома, которая начнет новый синтез. Таким образом, используя одну матрицу для биосинтеза, рибосомы создают одномоментно множество копий белка.
Роль рибосом в организме
- Рибосомы синтезируют белок для собственных нужд клетки и за ее пределы. Так в печени образуются плазменные факторы свертывания крови, плазмоциты продуцируют гамма-глобулины.
- Считывание закодированной информации с РНК, соединение аминокислот в запрограммированном порядке с образованием новых белковых молекул.
- Каталитическая функция – формирование пептидных связей, гидролиз ГТФ.
- Свои функции в клетке рибосомы выполняют более активно в виде полирибосом. Эти комплексы способны одновременно синтезировать несколько молекул белка.
Рибосомы
☰
Рибосомы являются важнейшими органоидами клетки, так как на них протекает процесс трансляции — синтез полипептида на матричной РНК (мРНК). Другими словами, рибосомы служат местом белкового синтеза.
Строение рибосом
Рибосомы относятся к немембранным органоидам. Они очень мелкие (около 20 нм), но многочисленные (тысячи и даже миллионы на клетку),
Одну из субъединиц называют «малой», вторую – «большой».
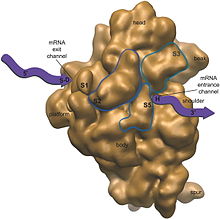
В собранной из субъединиц рибосоме выделят два (по одним источникам) или три (по другим) участка, которые называют сайтами. Один из участков обозначают A (aminoacyl) и называют аминоацильным, второй — P (peptidyl) — пептидильный. Данные сайты являются основными каталитическими центрами протекающих на рибосомах реакций. Третий участок обозначают E (exit), через него освободившаяся от синтезируемого полипептида транспортная РНК (тРНК), покидает рибосому.
Кроме перечисленных сайтов на рибосомах есть другие участки, используемые для связывания различных ферментов.
Когда субъединицы диссоциированы (разъединены) специфичность сайтов теряется, т. е. они определяются сочетанием соответствующих областей обеих субъединиц.
Отличие рибосом прокариот и эукариот
Соотношение по массе белков и РНК в рибосоме примерно поровну. Однако у прокариот белков меньше (около 40%).
Размеры как самих рибосом, так и субъединиц выражают в скорости их седиментации (осаждения) при центрифугировании. При этом S обозначает константу Сведберга — единицу, характеризующую скорость оседания в центрифуге (чем больше S, тем быстрее частица осаждается, а значит тяжелее). У прокариот рибосомы имеют размер в 70S, а у эукариот — в 80S (т. е. они тяжелее и крупнее). При этом субъединицы прокариотических рибосом имеют значения 30S и 50S, а эукариотических — 40S и 60S. Размеры рибосом в митохондриях и хлоропластах эукариот сходны с прокариотическими (хотя имеют определенную вариабельность по размерам), что может указывать на их происхождение от древних прокариотических организмов.
У прокариот в состав большой субъединицы рибосом входит две молекулы рРНК и более 30 молекул белка, в состав малой — одна молекула рРНК и около 20 белков. У эукариот в субъединицах больше молекул белка, а также в большой субъединице три молекулы рРНК. Составляющие рибосому белки и молекулы рРНК обладают способностью к самосборке и в итоге образуют сложную трехмерную структуру. Структуру рРНК поддерживают ионы магния.
Синтез рРНК
У эукариот в состав рибосом входят 4 вида рРНК. При этом три образуются из одного транскрипта-предшественника — 45S рРНК. Он синтезируется в ядрышке (на петлях хромосом его формирующем) при помощи РНК-полимеразы-1. Гены рРНК имеют много копий (десятки и сотни) и обычно располагаются на концах разных пар хромосом. После синтеза 45S рРНК разрезается на 18S, 5.8S и 28S рРНК, каждая из которых подвергается тем или иным модификациям.
Четвертый вид рРНК синтезируется вне ядрышка с помощью фермента РНК-полимеразы-3. Это 5S РНК, которая после синтеза не нуждается в процессинге.
Третичная структура рРНК в составе рибосом очень сложная и компактная. Она служит каркасом для размещения рибосомных белков, которые выполняют вспомогательные функции для поддержания структуры и функциональности.
Функция рибосом
Функционально рибосомы являются местом связывания молекул, участвующих в синтезе (мРНК, тРНК, различные факторы). Именно в рибосоме молекулы могут занять друг по отношению к другу такое положение, которое позволит быстро протечь химической реакции реакции.
В эукариотических клетках рибосомы могут находиться свободно в цитоплазме или быть прикрепленными с помощью специальных белков к ЭПС (эндоплазматическая сеть, она же ЭР — эндоплазматический ретикулум).
В процессе трансляции рибосома перемещается по мРНК. Часто по одной нитевидной мРНК двигаются несколько (или множество) рибосом, образуя так называемую
Рибосомы ℹ️ особенности строения органоида клетки, химический состав, место образования, функции, этапы механизма трансляции, роль в биосинтезе белка
Химический состав
Рибосома напоминает эллипс или сферу, диаметром от пятнадцати до двадцати нанометров у прокариот и от двадцати пяти до тридцати у эукариот. Органелла состоит из маленькой и большой субъединиц.
В клетках с ядром органеллы находятся на мембране эндоплазматической сети, но могут располагаться и в отдельной форме в цитоплазме. Часто с молекулой м-РНК связано больше одной органеллы, подобная структура получила название полисомы (полирибосомы). Нужно понять, где образуются рибосомы у эукариотов. Это осуществляется в специальной структуре внутри ядра — ядрышке.
Рибосомы являются нуклеопротеидом, в котором пропорция белок/рибонуклеиновая кислота равна 50:50 у высших организмов и 65:40 у бактерий. РНК органеллы занимает почти 70% от общей РНК клетки. Органеллы эукариот содержат 4 молекулы р-РHК, из них 18 S (единица измерения Сведберга), 5 S и 28 S р-РНК синтезируются в ядрышке. Практически полностью р-РHК имеет вид магниевой соли. Это обязательное условие для стабильности структуры. Если убрать ионы магния, то органелла расщепляется на субъединицы.
Реакция оседания в центрифуге (постоянная седиментации) у органелл цитоплазмы клеток с выраженным ядром равна 80 S (маленькая и крупная частицы 40 S и 60 S, соответственно), у клеточных рибосом бактерий — 70 (для частиц 30 S и 50 S).
Строение рибосомы
В состав рибосомы входят особые РНК (рибосомные). А также своеобразные белки и малочисленные низкомолекулярные составляющие.
РНК органеллы
За структуру и работоспособность рибосомы в первую очередь отвечает её РHК. Рибонуклеиновая кислота органеллы или р-РНК в составе органеллы весьма компактна, обладает сложной третичной конструкцией и часто усыпана молекулами разных белков органеллы. Освобождённые от белковых соединений высокомолекулярные р-РHК в особых условиях самостоятельно скручиваются в мелкие частицы, по своей морфологии очень похожие на субчастицы рибосомы, основой которых они и являются.
Исходя из этого, общая схема структурной организации органеллы определяется свойствами р-РHК. Третичное устройство р-РНК служит каркасом для позиционирования рибосомных белков, которые в определённом понимании выполняют лишь второстепенную задачу в образовании и сохранении структуры рибосомы и её жизнедеятельности.
Есть предположение, что развитие органеллы началось ещё в добелковый период, и предшественниками рибосом были своеобразные древнейшие рибозимы. Предполагают, что в процессе эволюции (появление более сложной ступени организации живых организмов) рибозимы, способные к катализации появления амидных соединений тоже поддавались прогрессу (дополнялись различными аппаратами, а со временем и образованными ими полипептидами), вплоть до появления нынешнего модуля для синтеза белка, принимая во внимание рибосому.
Нынешняя органелла по своему содержанию до сих пор остаётся рибозимом, так как главная структурно-функциональная деятельность принадлежит её собственной кислоте, а не белкам, как считалось раньше.
В состав пептидилтрансферазного центра входит только кислота. То обстоятельство, что в то время, как почти во всех процессах жизненного функционала главную задачу выполняют белки, в образовании их самих основная роль принадлежит РНК, обеспечивает весомый аргумент в защиту гипотезы о пространстве РНК как о древнейшем добелковом периоде развития живой ткани.
РНК малой субъединицы
Рибосомная рибонуклеиновая кислота маленькой частицы органоида имеет маркировку 16 S р-РHК в случае органелл бактерий и 16 S -подобная р-РHК в других ситуациях. Чаще всего р-РНК маленькой субъединицы образована из одной ковалентно непрерывной полирибонуклеотидной цепочки.
Число звеньев нуклеотидов, как и постоянной величины седиментации, для экземпляров 16 S-подобных р-РHК из разных источников могут серьёзно отличаться. В рибосомах бактерий и пластидов высших представителей растительного мира эти частицы обладают размером порядка 1500 нуклеотидных остатков.
Для 16 S-подобных р-РНК цитоплазменных рибосом клеток с выраженным ядром, а также для митохондриальных рибосом высших растений и грибов типична длина до 2 тыс. нуклеотидных остатков (18 S р-РHК). Органеллы митохондрий млекопитающих животных содержат довольно короткие 16 S-подобные р-РНК (9 — 12 S), состоящие из 950 нуклеотидных остатков.
Рибонуклеиновая кислота большой частицы
Высокомолекулярная рибонуклеиновая кислота, представляющая основу конструкции большой субъединицы рибосомы, имеет обозначение 23 S р-РHК (для бактерий) и 23 S-подобная р-РНК (для иных случаев). Бактериальная 23 S р-РНК, точно также как и 16 S р-РHК имеет вид полирибонуклеотидной ковалентно непрерывной цепочки.
Вместе с этим 23 S-подобная р-РНК органеллы цитоплазмы эукариотических клеток включает в себя две прочно сгруппированных полирибонуклеотидных цепочек — 28 S и 5,8 S р-РHК. Таким же образом 23 S-подобная р-РHК рибосом пластидов растительных видов состоит из двух крепко соединённых полирибонуклеотидных цепей и включает 4,5 S р-РНК.
Белки органоида
Кроме р-РНК, в состав органеллы входят порядка пятидесяти (прокариоты) или восьмидесяти (эукариоты) разных белков. Почти каждый из них имеет один лишь экземпляр на отдельную рибосому. Доминируют умеренно-осно̀вные белки. Бо̀льшая часть белков органоида эволюционно консервативна, а белки от разных ресурсов могут соотноситься как подобные. Это учитывается в нынешнем универсальном перечне рибосомных белков. Сама органелла состоит почти на 50% из белка.
Помимо биополимеров (белки, рибонуклеиновая кислота) составными частями рибосом являются отдельные низкомолекулярные составляющие. Это частицы воды, ионы металлов (в основном Mg2+), поли- и диамины, которые могут составлять до 2,5% сухой массы рибосомы.
Механизм трансляции
Трансляция — это процесс образования белка из аминокислот на матрице информационной (матричной) кислоты (и-РНК, м-РHК), приводимый в действие рибосомой.
Основной задачей функционирования живой клетки считается биосинтез белка. Для воспроизведения этой операции абсолютно во всех клеточных организмах находятся рибосомы. Они являются рибонуклеопротеидными комплексами, в которых участвуют малая и большая субъединицы. Роль рибосомы состоит:
- в распознавании трехнуклеотидных кодонов м-РНК;
- в соотношении соответствующих им антикодонов т-РНК, переносящих аминокислоты;
- во включении этого груза в увеличивающуюся белковую цепь.
Продвигаясь вдоль молекулы м-РНК, органелла образует белок согласно информации, имеющейся в молекуле м-РНК. Для различия аминокислот в клетке существуют особые «адаптеры», молекулы транспортной рибонуклеиновой кислоты (т-РHК). Они напоминают форму листа клевера, имеющего область (антикодон), соответствующую кодону м-РНК, и ещё один участок для присоединения аминокислоты, комплиментарной этому кодону.
Прикрепление аминокислот к т-РНК происходит в энергозависимой реакции с помощью ферментов аминоацил-т-РHК-синтетаз, а образованная молекула носит название аминоацил-т-РНК. Следовательно, вся специфика трансляции может быть определена взаимосвязью кодона м-РНК и антикодона т-РНК, а также характерной особенностью аминоацил-т-РНК-синтетаз, прикрепляющим аминокислоты точно к соответствующим т-РНК.
Механизмы трансляции эукариотических и прокариотических клеток имеют серьезное отличие, из-за этого множество соединений, угнетающих трансляцию прокариот, в меньшей мере оказывает влияние на трансляцию высших особей. Такая особенность позволяет применять их в медицине в виде противобактериальных средств, не приносящих вред организму млекопитающих. Если кратко, то вся процедура трансляции подразделяется на три основных этапа:
- инициация — распознавание рибосомой стартового кодона и начало синтеза;
- элонгация — сама операция образования белка;
- терминация — опознавание терминирующего кодона и отделение продукта.
История исследований
Органеллы изначально были определены как уплотнённые частички. Это сделал уроженец Румынии, гражданин Америки и клеточный биолог Джордж Паладе в 50-х гг. XIX в. В 1974 г. ему и Кристиану Де Дюву вручили Нобелевскую премию по медицине и физиологии за прорыв в знаниях о структурной и функциональной деятельности клетки.
В 1958 г. проходил симпозиум, посвящённый органеллам и их участию в белковом синтезе. В рамках этого мероприятия Ричард Робертс предложил сменить название «рибонуклеопротеидная частица микросомальной фракции» на менее ёмкое «рибосома». В 60-х гг. началось мутационное и биохимическое изучение органеллы, которое впоследствии помогло точно расписать большинство структурных и функциональных отличительных черт рибосомы.
В начале 2000-х гг. были созданы модели с атомным разрешением (до 2,4 А) конструкций отдельных субъединиц, а также полной рибосомы прокариот, связанной с разными субстратами, позволившими осознать устройство декодинга (узнавание антикода т-РНК, соответствующего кодону м-РНК) и подробности взаимосвязи рибосомы, т-РНК, м-РНК, причины трансляции и разных антибиотиков.
Это крупное достижение в молекулярной биологии было заслуженно отмечено Нобелевской премией по химии в 2009 г. «За исследования структуры и функций рибосомы». Лауреатами стали:
- американец Томас Стейц.
- британец уроженец Индии Венкатраман Рамакришнан.
- гражданка Израиля Ада Йонат.
В 2010 г. в лаборантской Марата Юсупова была открыта трёхмерная конструкция рибосомы эукариот.
В 2009 г. биохимики из Канады Сергей Штейнберг и Константин Боков из университета Монреаля, изучив третичную структуру кислоты рибосомы бактерии Escherichia coli, выдвинули обоснованную гипотезу о том, что органелла могла зародиться в результате постепенного эволюционного развития из простейшей малой молекулы РНК — проторибосомы, способной к катализации реакции соединения двух аминокислот.
Все оставшиеся конструктивные блоки рибосомы постепенно добавлялись к проторибосоме, не изменяя её строение и планомерно увеличивая продуктивность её деятельности.
Еще в школе детей начинают знакомить с рибосомой. Ее функционал перестал оставаться тайной для человека. Может показаться, что все загадки относительно этого органоида разгаданы. Однако за последние десятилетия в области исследования рибосом происходит значительный переворот.
Рибосома — Википедия
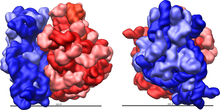 Модель рибосомы Escherichia coli. Красным цветом выделена большая субьединица, синим — малая субьединица. Более светлым оттенком показаны рибосомные белки, более темным — рРНК
Модель рибосомы Escherichia coli. Красным цветом выделена большая субьединица, синим — малая субьединица. Более светлым оттенком показаны рибосомные белки, более темным — рРНКРибосо́ма — важнейший немембранный органоид живой клетки, служащий для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
 Схема синтеза рибосом в клетках эукариот.
Схема синтеза рибосом в клетках эукариот. 1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид, в составе которого соотношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 16S, 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом бактериальных клеток (а также у рибосом митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Состав рибосомы
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Примечания
- ↑ 1 2 Спирин, 2011, с. 109.
- ↑ Спирин, 2011, с. 120—121.
- ↑ 1 2 Спирин, 2011, с. 110.
- ↑ 1 2 3 Спирин, 2011, с. 110—111.
- ↑ Спирин, 2011, с. 133—134.
- ↑ Спирин, 2011, с. 136—137.
- ↑ Спирин, 2011, с. 84—85.
- ↑ 1 2 Спирин, 2011, с. 84.
- ↑ Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.
- ↑ T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520—524.
- ↑ A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760-3770.
- ↑ P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920—930.
- ↑ T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437—448
- ↑ G.E. Palade. (1955) «A small particulate component of the cytoplasm.» J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. «Crystal structure of the eukaryotic ribosome.» // Science. 2010. V. 330. P. 1203-1209.
- ↑ Konstantin Bokov, Sergey V. Steinberg. «A hierarchical model for evolution of 23S ribosomal RNA» // Nature. 2009. V. 457. P. 977—980.
Литература
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Ссылки
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
Рибосомы — строение и функции

Строение и функции рибосом необходимо знать любому современному человеку. Функционирование клетки живого организма – сложный процесс, продолжающийся в течение жизни организма.
Рибосомы представляют собой органоиды клетки, участвующие в сложном клеточном механизме трансляции генетического кода в цепи аминокислот. Длинные цепи аминокислот соединяются между собой, образуя белки, выполняющие различные функции. Схема строения рибосомы показана на рисунке ниже.
Какую функцию выполняют рибосомы
Назначение описываемого органоида в любой клетке заключается в осуществлении синтеза белков. Белки используются практически всеми клетками:
- в качестве катализаторов — ускоряют время реакции;
- в качестве волокон — обеспечивают стабильность клетки;
- многие белки имеют индивидуальные задачи.

Основным хранилищем информации в клетках служит молекула дезоксирибонуклеиновой кислоты (ДНК). Специальный фермент, РНК-полимераза, связывается с молекулой ДНК и создает «зеркальную копию» — матричную рибонуклеиновую кислоту (мРНК), свободно перемещающуюся из ядра в цитоплазму клетки.
Цепочка рибонуклеиновой кислоты обрабатывается при выходе из ядра; области РНК, которые не кодируют белки, удаляются; мРНК используется для дальнейшего синтеза белка.
Каждая мРНК состоит из 4 различных нуклеиновых кислот, тройки которых составляют кодоны. Каждый кодон определяет специфическую аминокислоту. В организме всех живых существ на Земле встречаются 20 аминокислот. Кодоны, используемые для спецификации аминокислот, почти универсальны.
Кодон, запускающий все белки — «AUG», последовательность нуклеиновых оснований:
- аденин;
- урацил;
- гуанин.
Специальная молекула РНК поставляет аминокислоты для синтеза — транспортная РНК или тРНК. К активному кодону подходит тРНК, несущая соответствующую аминокислоту, ассоциируется с ним. Происходит образование пептидной связи новой аминокислоты со строящимся белком.
Где образуются рибосомы
Составные части органоида образуются в ядрышке. Две субъединицы объединяются для начала химического процесса синтеза белка из цепи мРНК. Рибосома действует в качестве катализатора, образуя пептидные связи между аминокислотами. Использованная тРНК высвобождается обратно в цитозоль, в дальнейшем она может связываться с другой аминокислотой.

Органоид достигнет стоп-кодона мРНК (UGA, UAG и UAA), остановив процесс синтеза. Специальные белки (факторы терминации) прервут цепочку аминокислот, отделив ее от последней тРНК — формирование белка закончится.
Различные белки требуют некоторых модификаций, транспортировки в определенные области клетки до начала функционирования. Рибосома, прикрепленная к эндоплазматическому ретикулуму, поместит вновь образованный белок внутрь, он пройдет дополнительные модификации, будет должным образом свернут. Другие белки образуются непосредственно в цитозоли, где действуют как катализатор для различных реакций.
Рибосомы создают нужные клеткам белки, составляющие около 20 процентов состава клетки. Приблизительно в клетке находится 10 000 различных белков, приблизительно по миллиону копий каждого.
Рибосома эффективно и быстро участвует в синтезе, добавляя 3-5 аминокислот к белковой цепи в секунду. Короткие белки, содержащие несколько сотен аминокислот, могут быть синтезированы за считанные минуты.
Состав и строение рибосом
Рибосомы имеют схожую структуру в клетках всех организмов Земли, незаменимы при синтезе белков. В начале эволюции различных форм жизни рибосома была принята в качестве универсального способа перевода РНК в белки. Эти органоиды изменяются в различных организмах незначительно.

Описываемые органоиды состоят из большой и малой субъединицы, располагающихся вокруг молекулы мРНК. Каждая субъединица представляет собой комбинацию белков и РНК, называемых рибосомальной РНК (рРНК).
Длина рРНК в разных цепях разная. рРНК окружена белками, создающими рибосому. рРНК удерживает мРНК и тРНК в органоиде и действует в качестве катализатора для ускорения образования пептидных связей между аминокислотами.
Рибосомы измеряются в единицах Svedberg, означающих сколько времени требуется молекуле для осаждения из раствора в центрифуге. Чем больше число, тем больше молекула.
Различия между прокариотическими и эукариотическими рибосомами рассмотрены в таблице.
| Критерий | Прокариотические | Эукариотические |
| Размер в единицах Svedberg | 70S | 80S |
| содержание белков и РНК | меньше белков и меньше РНК | больше белков и больше РНК |
| содержание молекул РНК | 3 молекулы РНК | 4 молекулы РНК |
Рибосомы отвечают за процесс синтеза белка – двигательной силы организма и являются одним из ключевых органоидов живой клетки, представленной во всем многообразии живых существ на Земле.
Рибосома — это… Что такое Рибосома?
 Рибосома
РибосомаРибосо́ма — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
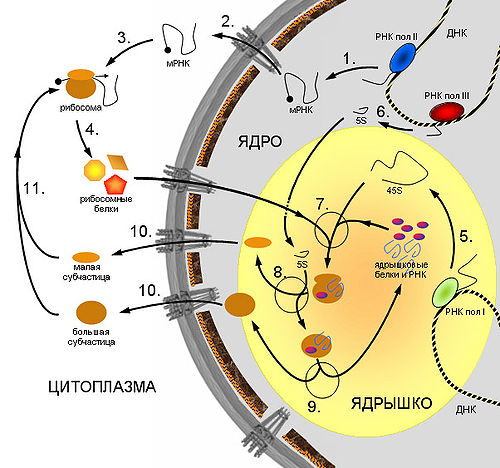 Схема синтеза рибосом в клетках эукариот.
Схема синтеза рибосом в клетках эукариот.1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5.8S и 28S рРНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а также митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов [1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции» [2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона [9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Примечания
- ↑ G.E. Palade. (1955) «A small particulate component of the cytoplasm.» J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. «Crystal structure of the eukaryotic ribosome.» // Science. 2010. V.330. P.1203-1209.
- ↑ Konstantin Bokov, Sergey V. Steinberg. «A hierarchical model for evolution of 23S ribosomal RNA» // Nature. 2009. V. 457. P. 977–980.
- ↑ Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.
- ↑ T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520—524.
- ↑ A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760-3770.
- ↑ P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920—930.
- ↑ T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437—448
Ссылки
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
Рибосома — Википедия
 Модель рибосомы Escherichia coli. Красным цветом выделена большая субьединица, синим — малая субьединица. Более светлым оттенком показаны рибосомные белки, более темным — рРНК
Модель рибосомы Escherichia coli. Красным цветом выделена большая субьединица, синим — малая субьединица. Более светлым оттенком показаны рибосомные белки, более темным — рРНКРибосо́ма — важнейший немембранный органоид живой клетки, служащий для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
 Схема синтеза рибосом в клетках эукариот.
Схема синтеза рибосом в клетках эукариот. 1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид, в составе которого соотношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 16S, 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом бактериальных клеток (а также у рибосом митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Состав рибосомы
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы

Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Примечания
- ↑ 1 2 Спирин, 2011, с. 109.
- ↑ Спирин, 2011, с. 120—121.
- ↑ 1 2 Спирин, 2011, с. 110.
- ↑ 1 2 3 Спирин, 2011, с. 110—111.
- ↑ Спирин, 2011, с. 133—134.
- ↑ Спирин, 2011, с. 136—137.
- ↑ Спирин, 2011, с. 84—85.
- ↑ 1 2 Спирин, 2011, с. 84.
- ↑ Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.
- ↑ T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520—524.
- ↑ A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760-3770.
- ↑ P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920—930.
- ↑ T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437—448
- ↑ G.E. Palade. (1955) «A small particulate component of the cytoplasm.» J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. «Crystal structure of the eukaryotic ribosome.» // Science. 2010. V. 330. P. 1203-1209.
- ↑ Konstantin Bokov, Sergey V. Steinberg. «A hierarchical model for evolution of 23S ribosomal RNA» // Nature. 2009. V. 457. P. 977—980.
Литература
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Ссылки
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
Рибосомы — определение, структура, функции и схема
На главную »Клеточная биология» Рибосомы — определение, структура, функции и схема
Последнее обновление: , автор: Sagar Aryal
Определение рибосом
- Слово «рибосома» происходит от слова «рибо» от рибонуклеиновой кислоты и «somes» от греческого слова «сома», что означает «тело».
- Рибосомы — это крошечные сфероидальные плотные частицы (от 150 до 200 A 0 диаметров), которые в основном встречаются у большинства прокариот и эукариот.
- Это сайты синтеза белка .
- Это структуры, содержащие примерно равные количества РНК и белков и служащие каркасом для упорядоченного взаимодействия многочисленных молекул, участвующих в синтезе белка.
- Рибосомы встречаются в клетках, как прокариотических, так и эукариотических клетках.
- В прокариотических клетках рибосомы часто находятся в цитоплазме свободно.
- В эукариотических клетках рибосомы либо свободно находятся в цитоплазме, либо остаются прикрепленными к внешней поверхности мембраны эндоплазматического ретикулума.
- Расположение рибосом в клетке определяет, какой белок она производит.
- Если рибосомы свободно плавают по клетке, они будут производить белки, которые будут использоваться внутри самой клетки.
- Когда рибосомы прикрепляются к эндоплазматическому ретикулуму, его называют грубым эндоплазматическим ретикулумом или грубым ER.
- Белки, полученные на грубом ER, используются для использования внутри клетки или вне клетки.
- Количество рибосом в клетке зависит от активности клетки.
- В среднем в клетке млекопитающего может быть около 10 миллионов рибосом.

Рисунок: Схема рибосом
Структура рибосом
- Рибосома состоит из комплексов РНК и белков и, следовательно, является рибонуклеопротеином.
- Примерно от 37 до 62% РНК состоит из РНК, а остальное — из белков.
- Каждая рибосома разделена на две субъединицы:
- Меньшая субъединица , которая связывается с большей субъединицей и паттерном мРНК, и
- Большая субъединица , которая связывается с тРНК, аминокислотами и меньшей субъединицей.
- Прокариоты имеют 70S рибосом, соответственно субъединицы, включающие маленькую субъединицу 30S и большую субъединицу 50S.
- Их малая субъединица имеет субъединицу 16S РНК (состоящую из 1540 нуклеотидов), связанную с 21 белком.
- Большая субъединица состоит из субъединицы 5S РНК (120 нуклеотидов), субъединицы 23S РНК (2900 нуклеотидов) и 31 белка.
- Эукариоты имеют 80S рибосомы, состоящие соответственно из небольших (40S) и значительных (60S) субъединиц.
- Меньшая 40S рибосомная субъединица имеет форму вытянутого эллипсоида и состоит из одной молекулы 18S рибосомной РНК (или рРНК) и 30 белков (называемых S1, S2, S3 и т. Д.).
- Более крупная рибосомная субъединица 60S имеет круглую форму и содержит канал, через который выходит растущая полипептидная цепь.
- Он состоит из трех типов молекул рРНК, то есть 28S рРНК, 5,8 рРНК и 5S рРНК и 40 белков (названных L1, L2, L3 и т. Д.).
- Различия между рибосомами бактерий и эукариот используются для создания антибиотиков, которые могут уничтожить бактериальную инфекцию, не нанося вреда клеткам человека.
- Рибосомы, обнаруживаемые в хлоропластах митохондрий эукариот, состоят из больших и малых субъединиц, состоящих из белков внутри частицы 70S.
- Рибосомы имеют общую структуру ядра, аналогичную всем рибосомам, несмотря на различия в размере.
- Две субъединицы подходят друг к другу и работают как одна, транслируя мРНК в полипептидную цепь во время синтеза белка.
- Поскольку они состоят из двух субъединиц неравного размера, они немного длиннее по оси, чем по диаметру.
- Во время синтеза белка, когда несколько рибосом присоединяются к одной и той же цепи мРНК, эта структура известна как полисома.
- Существование рибосом является временным, после синтеза полипептида две субъединицы разделяются и используются повторно или распадаются.
Функции рибосом
- Рибосома — сложная молекулярная машина, обнаруженная во всех живых клетках, которая служит местом синтеза (трансляции) биологического белка.
- Рибосомы связывают аминокислоты вместе в порядке, указанном молекулами информационной РНК (мРНК).
- Рибосомы действуют как катализаторы в двух чрезвычайно важных биологических процессах, называемых переносом пептидила и гидролизом пептидила.
Список литературы
- Verma, P. S., & Agrawal, V. K. (2006). Клеточная биология, генетика, молекулярная биология, эволюция и экология (1-е изд.). С.Чанд и компания ООО
- Альбертс, Б. (2004). Существенная клеточная биология.Нью-Йорк, штат Нью-Йорк: научный паб Garland.
- Кар, Д.К. и хальдер, С. (2015). Клеточная биология, генетика и молекулярная биология. Колката, Новое центральное книжное агентство
- https://biology.tutorvista.com/animal-and-plant-cells/ribosomes.html
- https://alevelbiology.co.uk/notes/ribosomes-structure-and-functions/
- https://biologywise.com/ribosomes-function
- https://biologydictionary.net/ribosome/
Рибосомы — определение, структура, функции и схема
Категории Биология клетки Теги большая субъединица, Синтез белка, Рибосомы, Функции рибосом, Структура рибосом, меньшая субъединица Сообщение навигации ,
Что такое рибосомы? — Определение, структура и функции
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРЕНТНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- BNAT 000 Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma класса 8
- Решения RD Sharma класса 9
- Решения RD Sharma класса 10
- Решения RD Sharma класса 11
- Решения RD Sharma класса 12
- BNAT 000 Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0003000300030004
- BNAT 000 NC
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- Классы
- 000
- 000
- 000
- 000
- 000 BIOG3000
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- FORMULAS
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 000 PBS4000
- 000
- 000 Физические калькуляторы
- 000
- 000
- 000 PBS4000
- 000
- 000 Калькуляторы для химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел. для класса 12
- CBSE, вопросник за предыдущий год, класс 10
- CBSE, вопросник за предыдущий год, класс 12
- HC Verma Solutions, класс 11, физика
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- CBSE Notes
- Примечания CBSE класса 7
- Примечания к редакции
- CBSE Class
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
Дополнительные вопросы по математике для класса 10
- CBSE Class
- Дополнительные вопросы по науке, класс 10 по CBSE
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия Решения для биологии класса 11
- Решения NCERT для математики класса 11 9 0003 NCERT Solutions Class 11 Accountancy
- NCERT Solutions For Класс 12 по физике
- Решения NCERT для химии класса 12
- Решения NCERT для класса 12 по биологии
- Решения NCERT для класса 12 по математике
- Решения NCERT Бухгалтерский учет 12 класса
- Решения NCERT Класс 12 Бизнес-исследования
- Решения NCERT, класс 12 Экономика
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для математики 6 класса
- Решения NCERT для науки 6 класса
- Решения NCERT для 6 класса социальных наук
- Решения NCERT для 6 класса Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для класса 7 Наука
- Решения NCERT для класса 7 по социальным наукам
- Решения NCERT для класса 7 Английский
- Решения NCERT для класса 8 Математика
- Решения NCERT для класса 8 Science
- Решения NCERT для класса 8 по социальным наукам
- Решение NCERT ns для класса 8 Английский
- Решения NCERT для социальных наук класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для Математика класса 9 Глава 2
- Решения NCERT для математики класса 9 Глава 3
- Решения NCERT для математики класса 9 Глава 4
- Решения NCERT для математики класса 9 Глава 5
- Решения NCERT для математики класса 9 Глава 6
- Решения NCERT для Математика класса 9 Глава 7
- Решения NCERT для математики класса 9 Глава 8
- Решения NCERT для математики класса 9 Глава 9 Решения NCERT
- для математики класса 9 Глава 10
- Решения NCERT для математики класса 9 Глава 11
- Решения NCERT для Математика класса 9 Глава 12
- Решения NCERT для математики класса 9 Глава 13 Решения
- NCERT для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для класса 9 Наука Глава 3
- Решения NCERT для Науки Класса 9 Глава 4
- Решения NCERT для Науки Класса 9 Глава 5
- Решения NCERT для Науки Класса 9 Глава 6
- Решения NCERT для Науки Класса 9 Глава 7
- Решения NCERT для Класса 9 Наука Глава 8
- Решения NCERT для Науки Класса 9 Глава 9
- Решения NCERT для Науки Класса 9 Глава 10
- Решения NCERT для Науки Класса 9 Глава 12
- Решения NCERT для Науки Класса 9 Глава 11
- Решения NCERT для Класса 9 Наука Глава 13
- Решения NCERT для класса 9 Наука Глава 14
- Решения NCERT для класса 9 по науке Глава 15
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для класса 10 по математике Глава 1
- Решения NCERT для математики класса 10 Глава 2
- Решения NCERT для математики класса 10 Глава 3
- Решения NCERT для математики класса 10 Глава 4
- Решения NCERT для математики класса 10 Глава 5
- Решения NCERT для математики класса 10 Глава 6
- Решения NCERT для математики класса 10 Глава 7
- Решения NCERT для математики класса 10 Глава 8
- Решения NCERT для математики класса 10 Глава 9
- Решения NCERT для математики класса 10 Глава 10
- Решения NCERT для математики класса 10 Глава 11
- Решения NCERT по математике класса 10 Глава 12
- Решения NCERT по математике класса 10 Глава 13
- NCERT Sol
- Решения NCERT для математики класса 10 Глава 15
- Решения NCERT для науки 10 класса Глава 1
- Решения NCERT для науки 10 класса Глава 2
- Решения NCERT для науки класса 10, глава 3
- Решения NCERT для науки класса 10, глава 4
- Решения NCERT для науки класса 10, глава 5
- Решения NCERT для науки класса 10, глава 6
- Решения NCERT для науки класса 10, глава 7
- Решения NCERT для науки класса 10, глава 8
- Решения NCERT для науки класса 10, глава 9
- Решения NCERT для науки класса 10, глава 10
- Решения NCERT для науки класса 10, глава 11
- Решения NCERT для науки класса 10, глава 12
- Решения NCERT для науки 10 класса Глава 13
- Решения NCERT для науки 10 класса Глава 14
- Решения NCERT для науки класса 10 Глава 15 Решения NCERT
- для науки класса 10 Глава 16
- Class 11 Commerce Syllabus 110002ancy Account
- Программа обучения бизнесу 11 класса
- Программа курса экономики 11 класса
- Программа обучения 12 класса
- Программа обучения бизнесу 12 класса
- Программа курса 12 класса 12
Simple English Wikipedia, бесплатная энциклопедия
Рибосомы являются важными органеллами клетки. Он выполняет трансляцию РНК, строит белки из аминокислот, используя информационную РНК в качестве матрицы. Рибосомы обнаружены во всех живых клетках, прокариотах, а также эукариотах.
Рибосома — это смесь белка и РНК, которая начинает вырабатываться в ядрышке клетки. Ядрышко находится в центре ядра. Ядро защищено ядерной оболочкой и выпускает вещи наружу через ядерные поры.
Работа рибосомы — производить новые белки. Он делает это, перемещаясь по цепи РНК и создавая белок на основе считываемого кода. Создание белка таким образом называется трансляцией. Рибосомы обычно находятся в шероховатом эндоплазматическом ретикулуме, но также могут быть обнаружены по всей цитоплазме.

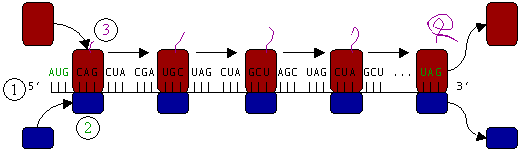
Трансляция мРНК (1) рибосомой (2) (показанной в виде малых и больших субъединиц) в полипептидную цепь (3). Рибосома начинается в стартовом кодоне мРНК (AUG) и заканчивается стоп-кодоном (UAG).
 Рисунок 2: Большой (красный) и маленький (синий) субъединицы подходят друг к другу
Рисунок 2: Большой (красный) и маленький (синий) субъединицы подходят друг к другуРибосомы состоят из двух частей: небольшой рибосомной субъединицы, которая считывает мРНК, а большая субъединица соединяет аминокислоты с образованием полипептидной цепи. Каждая субъединица состоит из одной или нескольких молекул рибосомной РНК (рРНК) и множества белков.
Эукариоты имеют 80S рибосомы, каждая из которых состоит из маленькой (40S) и большой (60S) субъединицы. [1] [2] [3] Их малая субъединица имеет субъединицу 16S РНК (состоящую из 1540 нуклеотидов), связанную с 21 белком.Большая субъединица содержит субъединицы 5S РНК (120 нуклеотидов), 28S РНК (4700 нуклеотидов), 5,8S РНК (160 нуклеотидов) и 46 белков. [2] [4] [5]
,
