Свертывание крови. Схема свертывания крови
Одним из важнейших процессов, протекающих в нашем организме, является свертывание крови. Схема его будет описана ниже (также для наглядности предоставлены и изображения). И поскольку это сложный процесс, стоит рассмотреть его в подробностях.
Как всё происходит?
Итак, обозначенный процесс отвечает за остановку кровотечения, произошедшего из-за повреждения той или иной составляющей сосудистой системы организма.
Если говорить простым языком, то можно выделить три фазы. Первая – активация. После повреждения сосуда начинают происходить последовательные реакции, которые в итоге приводят к образованию так называемой протромбиназы. Это – сложный комплекс, состоящий из V и X факторов свёртывания. Он образуется на фосфолипидной поверхности мембран тромбоцитов.
Вторая фаза – коагуляция. На этом этапе из фибриногена образуется фибрин – высокомолекулярный белок, который является основой тромбов, возникновение которых и подразумевает свертывание крови. Схема, предоставленная ниже, данную фазу наглядно демонстрирует.
И, наконец, третий этап. Он подразумевает образование фибринового сгустка, отличающегося плотной структурой. К слову, именно путём его промывания и высушивания удаётся получить «материал», который потом используется для приготовления стерильных плёнок и губок для остановки кровотечения, вызванного разрывом мелких сосудов при хирургических операциях.
О реакциях
Выше было кратко описано свертывание крови. Схема, кстати, была разработана в далёком 1905 году учёным-коагулологом по имени Пауль Оскар Моравиц. И она не теряет своей актуальности до сих пор.
Но с 1905 года в области понимания свёртывания крови как сложного процесса изменилось многое. Благодаря прогрессу, конечно же. Учёные смогли открыть десятки новых реакций и белков, которые участвуют в данном процессе. И теперь более распространена каскадная схема свертывания крови. Благодаря ей восприятие и понимание такого сложного процесса становится немного более понятным.
Как можно видеть на предоставленном ниже изображении, происходящее буквально «разобрано на кирпичики». Принимается во внимание внутренняя и внешняя система – кровяная и тканевая. Для каждой характерна определённая деформация, наступающая вследствие повреждения. В кровяной системе вред наносится сосудистым стенкам, коллагену, протеазам (расщепляющие ферменты) и катехоламинам (молекулы-медиаторы). В тканевой же наблюдается повреждение клеток, вследствие которого из них выходит тромбопластин. Который является важнейшим стимулятором процесса свёртывания (иначе называемом коагуляцией). Он выходит непосредственно в кровь. Таков его «путь», но имеет он защитный характер. Ведь именно тромбопластин запускает процесс свёртывания. После его выхода в кровь начинается осуществление вышеперечисленных трёх фаз.
Время
Итак, что примерно представляет собой свертывание крови, схема понять помогла. Теперь хотелось бы немного поговорить о времени.
Весь процесс занимает как максимум 7 минут. Первая фаза длится от пяти до семи. В течение этого времени образуется протромбин. Данное вещество является сложной разновидностью белковой структуры, отвечающей за протекание процесса свёртывания и способность крови к сгущению. Которая используется нашим организмом в целях образования тромба. Он закупоривает повреждённое место, благодаря чему кровотечение останавливается. Всё это занимает 5-7 минут. Вторая и третья стадии происходят намного быстрее. За 2-5 секунд. Потому что эти фазы свертывания крови (схема предоставлена выше) затрагивают процессы, которые происходят повсеместно. А значит и у места повреждения непосредственно.
Протромбин, в свою очередь, образуется в печени. И на его синтез необходимо время. Насколько быстро выработается достаточное количество протромбина, зависит от количества витамина К, содержащегося в организме. Если его не хватает, кровотечение будет остановить сложно. И это является серьёзной проблемой. Поскольку нехватка витамина К указывает на нарушение синтеза протромбина. А это – недуг, который необходимо лечить.

Стабилизация синтеза
Что ж, общая схема свертывания крови понятна – теперь следует уделить немного внимания теме, касающейся того, что необходимо делать для восстановления необходимого количества витамина К в организме.
Для начала – правильно питаться. Самое большое количество витамина К содержится в зелёном чае – 959 мкг в 100 г! В три раза больше, кстати, чем в чёрном. Потому стоит его активно пить. Не стоит пренебрегать и овощами – шпинатом, белокочанной капустой, томатами, зелёным горошком, репчатым луком.
В мясе витамин К тоже содержится, но не во всём – только в телятине, говяжьей печени, баранине. Но меньше всего его находится в составе чеснока, изюма, молока, яблок и винограда.
Впрочем, если ситуация серьёзная, то одним разнообразием меню помочь будет сложно. Обычно врачи настоятельно рекомендуют комбинировать свой рацион с препаратами, ими прописанными. С лечением не стоит затягивать. Необходимо как можно скорее к нему приступить, чтобы нормализовать механизм свертывания крови. Схема лечения прописывается непосредственно врачом, и он также обязан предупредить, что может случиться, если рекомендациями пренебречь. А последствиями может стать дисфункция печени, тромбогеморрагический синдром, пернициозная анемия, опухолевые заболевания и поражение стволовых клеток костного мозга.
Схема Шмидта
В конец XIX века жил известный физиолог и доктор медицинских наук. Звали его Александр Александрович Шмидт. Он прожил 63 года, и бóльшую часть времени посвятил исследованию проблем гематологии. Но особенно тщательно он изучал тему свёртывания крови. У него удалось установить ферментативный характер данного процесса, вследствие чего учёный предложил теоретическое ему объяснение. Которое наглядно изображает предоставленная ниже схема свертывания крови.
В первую очередь происходит сокращение повреждённого сосуда. Затем на месте дефекта образуется рыхлая, первичная тромбоцитарная пробка. Затем она укрепляется. Вследствие чего образуется красный тромб (иначе именуемый кровяным сгустком). После чего он частично или полностью растворяется.
В ходе данного процесса проявляются определённые факторы свертывания крови. Схема, в своём развёрнутом варианте, также их отображает. Обозначаются они арабскими цифрами. И всего их насчитывается 13. И о каждом необходимо рассказать.
Факторы
Полноценная схема свертывания крови невозможна без их перечисления. Что ж, начать стоит с первого.
Фактор I – это бесцветный белок фибриноген. Синтезируемый в печени, растворённый в плазе. Фактор II – протромбин, о котором уже говорилось выше. Его уникальная способность заключается в связывании ионов кальция. И именно впоследствии расщепления этого вещества формируется фермент свёртывания.
Фактор III – это сложный белок липопротеин, тканевый тромбопластин. Его принято называть транспортом фосфолипидов, холестерина, а ещё триацилглицеридов.
Следующим фактором, IV, являются ионы Са2+. Те самые, которые связываются под воздействием бесцветного белка. Они задействованы во многих сложных процессах, помимо свёртывания, в секреции нейромедиаторов, например.
Фактор V – это глобулин. Который тоже образуется в печени. Он необходим для связывания кортикостероидов (гормональных веществ) и их транспортировки. Фактор VI определённое время существовал, но потом его было решено изъять из классификации. Поскольку учёные выяснили – его включает в себя фактор V.
Но классификацию менять не стали. Потому следом за V идёт фактор VII. Включающий в себя проконвертин, с участием которого образуется тканевая протромбиназа (первая фаза).
Фактор VIII – это белок, выраженной в одной цепочке. Известен, как антигемофильный глобулин А. Именно из-за его нехватки развивается такое редкое наследственное заболевание, как гемофилия. Фактор IX является «родственным» ранее упомянутому. Так как это антигемофильный глобулин В. Фактор X – непосредственно глобулин, синтезируемый в печени.
И, наконец, последние три пункта. Это фактор Розенталя, Хагемана и стабилизация фибрина. Они, в совокупности, влияют на образование межмолекулярных связей и нормальное функционирование такого процесса, как свертывание крови.
Схема Шмидта включает все эти факторы. И достаточно бегло с ними ознакомиться, чтобы понять, насколько описываемый процесс сложен и многозначен.

Противосвёртывающая система
Данное понятие также необходимо отметить внимание. Выше была описана система свертывания крови – схема также наглядно демонстрирует протекание этого процесса. Но так называемое «противосвёртывание» тоже имеет место быть.
Для начала хотелось бы отметить, что в ходе эволюции ученые решали две совершенно противоположные задачи. Они пытались выяснить – как организму удаётся предотвратить вытекание крови из повреждённых сосудов, и при этом сохранить её в жидком состоянии в целых? Что ж, решением второй задачи стало обнаружение противосвертывающей системы.
Она представляет собой определённый набор плазменных белков, которые способны снижать скорость химических реакций. То есть ингибировать.
И в данном процессе участвует антитромбин III. Его главная функция заключается в контролировании работы некоторых факторов, которые включает схема процесса свертывания крови. Важно уточнить: он не регулирует образование тромба, а устраняет ненужные ферменты, попавшие в кровоток из места, где тот формируется. Для чего это необходимо? Для предотвращения распространения свёртывания на участки кровеносного русла, которые оказались повреждёнными.

Препятствующий элемент
Рассказывая о том, что представляет собой система свертывания крови (схема которой представлена выше), нельзя не отметить вниманием такое вещество, как гепарин. Он представляет собой серосодержащий кислый гликозаминогликан (один из видов полисахаридов).
Это – прямой антикоагулянт. Вещество, способствующее угнетению активности свёртывающей системы. Именно гепарин препятствует процессу образования тромбов. Как это происходит? Гепарин просто снижает активность тромбина в крови. Однако это – естественное вещество. И оно несёт пользу. Если ввести данный антикоагулянт в организм, то можно поспособствовать активированию антитромбина III и липопротеинлипазы (ферменты, расщепляющие триглицериды – главные источники энергии для клеток).
Так вот, гепарин часто используется ля лечения тромботических состояний. Лишь одна его молекула может активировать большое количество антитромбина III. Соответственно, гепарин можно считать катализатором – поскольку действие в данном случае действительно схоже с эффектом, вызываемом ими.
Есть и другие вещества с таким же действием, содержащиеся в плазме крови. Взять, к примеру, α2- макроглобулин. Он способствует расщеплению тромба, оказывает влияние на процесс фибринолиза, выполняет функцию транспорта для 2-валентных ионов и некоторых белков. А ещё ингибирует вещества, участвующие в процессе свёртывания.
Наблюдаемые изменения
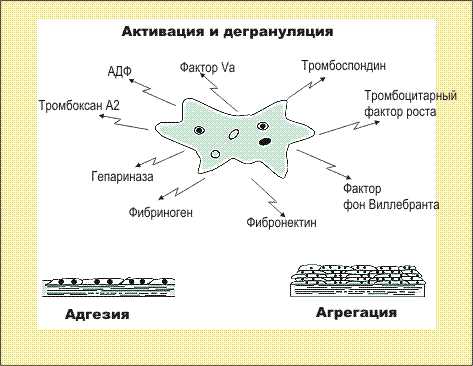
Есть ещё один нюанс, который не демонстрирует традиционная схема свертывания крови. Физиология нашего организма такова, что многие процессы подразумевают не только химические изменения. Но ещё и физические. Если бы мы могли наблюдать за свёртыванием невооруженным взглядом, то увидели бы, что форма тромбоцитов в его процессе меняется. Они превращаются в округлые клетки с характерными шиповидными отростками, которые необходимы для интенсивного осуществления агрегации – объединения элементов в единое целое.
Но это ещё не всё. Из тромбоцитов в процессе свёртывания выделяются различные вещества – катехоламины, серотонин и т.д. По причине этого просвет сосудов, которые оказались повреждёнными, сужается. За счёт чего происходит функциональная ишемия. Кровоснабжение в повреждённом месте снижается. И, соответственно, излияние постепенно тоже сводится к минимуму. Это даёт тромбоцитам возможность перекрыть повреждённые места. Они, за счёт своих шиповидных отростков, будто бы «крепятся» к краям коллагеновых волокон, которые находятся у краёв раны. На этом заканчивается первая, самая долгая фаза активации. Завершается она образованием тромбина. После чего следует ещё несколько секунд фазы коагуляции и ретракции. А последний этап – восстановление нормального кровообращения. И оно имеет большое значение. Поскольку полноценное заживление раны невозможно без хорошего кровоснабжения.
Полезно знать
Что ж, примерно так на словах и выглядит упрощенная схема свертывания крови. Впрочем, есть ещё несколько нюансов, которые хотелось бы отметить вниманием.
Гемофилия. О ней уже упоминалось выше. Это очень опасное заболевание. Любое кровоизлияние человеком, им страдающим, переживается тяжело. Заболевание наследственное, развивается из-за дефектов белков, принимающих участие в процессе свёртывание. Обнаружить его можно достаточно просто – при малейшем порезе человек потеряет много крови. И потратит немало времени на её остановку. А при особо тяжелых формах кровоизлияние может начаться без причин. Люди, страдающие гемофилией, могут рано подвергнуться инвалидизации . Поскольку частые кровоизлияния в мышечные ткани (обычные гематомы) и в суставы – это не редкость. Лечится ли это? С трудом. Человек должен в прямом смысле слова относиться к своему телу, как к хрупкому сосуду, и всегда быть аккуратным. Если случается кровотечение – нужно срочно ввести донорскую свежую кровь, в которой содержится фактор XVIII.
Обычно данным заболеванием страдают мужчины. А женщины выступают в роли носительниц гена гемофилии. Интересно, что британская королева Виктория была таковой. Одному из её сыновей заболевание передалось. Насчёт остальных двух неизвестно. С тех пор гемофилию, кстати, нередко называют королевской болезнью.
Но бывают и обратные случаи. Имеется в виду повышенная свертываемость крови. Если она наблюдается, то человеку тоже нужно быть не менее аккуратным. Повышенная свертываемость говорит о высоком риске образования внутрисосудистых тромбов. Которые закупоривают целые сосуды. Нередко последствием может стать тромбофлебит, сопровождающийся воспалением венозных стенок. Но этот дефект лечится проще. Часто, кстати, он является приобретённым.
Удивительно, сколько всего происходит в организме человека, когда тот элементарно порезался листком бумаги. Можно ещё долго рассказывать об особенностях крови, её свёртывании и процессах, которые его сопровождают. Но вся наиболее интересная информация, как и наглядно демонстрирующие её схемы, предоставлена выше. С остальным, при желании, можно ознакомиться в индивидуальном порядке.
fb.ru
Свёртывание крови — Википедия
Свёртывание крови — это важнейший этап работы системы гемостаза, отвечающий за остановку кровотечения при повреждении сосудистой системы организма. Совокупность взаимодействующих между собой весьма сложным образом различных факторов свёртывания крови образует систему свёртывания крови.
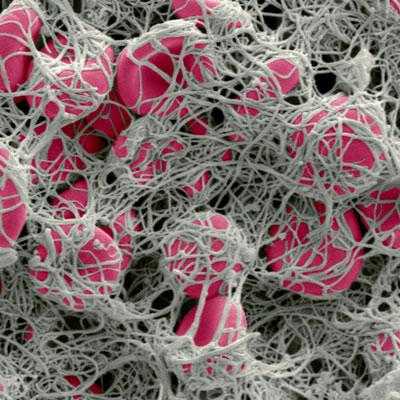
Свёртыванию крови предшествует стадия первичного сосудисто-тромбоцитарного гемостаза. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и механической закупоркой агрегатами тромбоцитов места повреждения сосудистой стенки. Характерное время для первичного гемостаза у здорового человека составляет 1—3 минуты. Собственно свёртыванием крови (гемокоагуляция, коагуляция, плазменный гемостаз, вторичный гемостаз) называют сложный биологический процесс образования в крови нитей белка фибрина, который полимеризуется и образует тромбы, в результате чего кровь теряет текучесть, приобретая творожистую консистенцию. Свёртывание крови у здорового человека происходит локально, в месте образования первичной тромбоцитарной пробки. Характерное время образования фибринового сгустка — около 10 минут. Свёртывание крови — ферментативный процесс.
Основоположником современной физиологической теории свёртывания крови является Александр Шмидт. В научных исследованиях XXI века, проведённых на базе Гематологического научного центра под руководством Атауллаханова Ф. И., было убедительно показано[1][2], что свёртывание крови представляет собой типичный автоволновой процесс, в котором существенная роль принадлежит эффектам бифуркационной памяти.
Фибриновый сгусток, полученный путём добавления тромбина в цельную кровь. Сканирующая электронная микроскопия.Процесс гемостаза сводится к образованию тромбоцитарно-фибринового сгустка. Условно его разделяют на три стадии[3]:
- временный (первичный) спазм сосудов;
- образование тромбоцитарной пробки за счёт адгезии и агрегации тромбоцитов;
- ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Повреждение сосудов сопровождается немедленной активацией тромбоцитов. Адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны обусловлена гликопротеином фактором Виллебранда[4]. Одновременно с адгезией наступает агрегация тромбоцитов: активированные тромбоциты присоединяются к повреждённым тканям и друг к другу, формируя агрегаты, преграждающие путь потере крови. Появляется тромбоцитарная пробка[3].
Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются различные биологически активные вещества (АДФ, адреналин, норадреналин и другие), которые приводят к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина[3], который воздействует на фибриноген с образованием сети фибрина, в которой застревают отдельные эритроциты и лейкоциты – образуется так называемый тромбоцитарно-фибриновый сгусток (тромбоцитарная пробка).
Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, наступает её ретракция
Процесс свёртывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свёртывания крови[3]. В самом простом виде процесс свёртывания крови может быть разделён на три фазы:
- фаза активации включает комплекс последовательных реакций, приводящих к образованию протромбиназы и переходу протромбина в тромбин;
- фаза коагуляции — образование фибрина из фибриногена;
- фаза ретракции — образование плотного фибринового сгустка.
Данная схема была описана ещё в 1905 году [5] Моравицем и до сих пор не утратила своей актуальности[6].
В области детального понимания процесса свёртывания крови с 1905 года произошёл значительный прогресс. Открыты десятки новых белков и реакций, участвующих в процессе свёртывания крови, который имеет каскадный характер. Сложность этой системы обусловлена необходимостью регуляции данного процесса.
Современное представление с позиций физиологии каскада реакций, сопровождающих свёртывание крови, представлено на рис. 2 и 3. Вследствие разрушения тканевых клеток и активации тромбоцитов высвобождаются белки фосфолипопротеины, которые вместе с факторами плазмы Xa и Va, а также ионами Ca2+ образуют ферментный комплекс, который активирует протромбин. Если процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани, речь идёт о внешней системе свёртывания крови (внешний путь активации свёртывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков называют также комплексом внешней теназы.
Если же инициация происходит под влиянием факторов свёртывания, присутствующих в плазме, используют термин внутренняя система свёртывания. Комплекс факторов IXа и VIIIa, формирующийся на поверхности активированных тромбоцитов, называют внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа). Внешняя и внутренняя системы свёртывания крови дополняют друг друга[5].
В процессе адгезии форма тромбоцитов меняется — они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из повреждённых клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин, катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета повреждённых сосудов, возникает функциональная ишемия. В конечном итоге сосуды перекрываются массой тромбоцитов, прилипших к краям коллагеновых волокон по краям раны [5].
На этой стадии гемостаза под действием тканевого тромбопластина образуется тромбин. Именно он инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca2+.
При наличии в крови ионов кальция под действием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование бесструктурной сети волокон нерастворимого фибрина. Начиная с этого момента в этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную жёсткость всей системе, и через некоторое время образуя тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, с одной стороны, предотвращая потерю крови, а с другой — блокируя поступление в кровь внешних веществ и микроорганизмов. На свёртывание крови влияет множество условий. Например, катионы ускоряют процесс, а анионы — замедляют. Кроме того, существуют вещества как полностью блокирующие свёртывание крови (гепарин, гирудин и другие), так и активирующие его (яд гюрзы, феракрил).
Врождённые нарушения системы свёртывания крови называют гемофилией.
Методы диагностики свёртывания крови[править | править код]
Все многообразие клинических тестов свёртывающей системы крови можно разделить на две группы[7]:
- глобальные (интегральные, общие) тесты;
- «локальные» (специфические) тесты.
Глобальные тесты характеризуют результат работы всего каскада свёртывания. Они подходят для диагностики общего состояния свёртывающей системы крови и выраженности патологий, с одновременным учётом всех привходящих факторов влияний. Глобальные методы играют ключевую роль на первой стадии диагностики: они дают интегральную картину происходящих изменений в свёртывающей системе и позволяют предсказывать тенденцию к гипер- или гипокоагуляции в целом. «Локальные» тесты характеризуют результат работы отдельных звеньев каскада свёртывающей системы крови, а также отдельных факторов свёртывания. Они незаменимы для возможного уточнения локализации патологии с точностью до фактора свёртывания. Для получения полной картины работы гемостаза у пациента врач должен иметь возможность выбирать, какой тест ему необходим.
Глобальные тесты:
«Локальные» тесты:
Все методы, измеряющие промежуток времени с момента добавления реагента (активатора, запускающего процесс свёртывания) до формирования фибринового сгустка в исследуемой плазме, относятся к клоттинговым методам (от англ. сlot — сгусток).
Нарушения свёртываемости крови могут быть обусловлены дефицитом одного или нескольких факторов свёртывания крови, появлением в циркулирующей крови их иммунных ингибиторов
Примеры нарушений свёртывания крови:
- ↑ Атауллаханов Ф. И., Зарницына В. И., Кондратович А. Ю., Лобанова Е. С., Сарбаш В. И. Особый класс автоволн — автоволны с остановкой — определяет пространственную динамику свертывания крови (рус.) // УФН : журнал. — 2002. — Т. 172, № 6. — С. 671—690. — ISSN 0042-1294. — DOI:10.3367/UFNr.0172.200206c.0671.
- ↑ Атауллаханов Ф. И., Лобанова Е. С., Морозова О. Л., Шноль Э. Э., Ермакова Е. А., Бутылин А. А., Заикин А. Н. Сложные режимы распространения возбуждения и самоорганизация в модели свертывания крови (рус.) // УФН : журнал. — 2007. — Т. 177, № 1. — С. 87—104. — ISSN 0042-1294. — DOI:10.3367/UFNr.0177.200701d.0087.
- ↑ 1 2 3 4 5 Кузник Б. И. 6.4 Система гемостаза // Физиология человека / Под редакцией В. М. Покровского, Г. Ф. Коротько. — М.: Медицина, 2000. — Т. 1. — С. 313—325. — 448 с. — 3000 экз. — ISBN 5-225-00960-3.
- ↑ Walsh P. N. Platelet-mediated coagulant protein interactions in hemostasis // Semin. Hematol. — 1985. — № 22 (3). — С. 178—186. — PMID 3898383.
- ↑ 1 2 3 Вайс Х., Елькманн В. Глава 18. Функции крови. Раздел 6. Остановка кровотечения и свёртывание крови // Физиология человека / Под редакцией Р. Шмидта и Г. Тевса. — М.: Мир, 1996. — Т. 2. — С. 431—439. — ISBN 5-03-002544-8.
- ↑ Коагуляционный гемостаз (неопр.). Дата обращения 15 ноября 2012. Архивировано 20 ноября 2012 года.
- ↑ Пантелеев М. А., Васильев С. А., Синауридзе Е. И., Воробьёв А. И., Атауллаханов Ф. И. Практическая коагулология / Под ред. А. И. Воробьёва. — М.: Практическая медицина, 2011. — 192 с. — ISBN 978-5-98811-165-8.
Тромбоциты. Свёртывание крови — урок. Биология, Человек (8 класс).
Тромбоциты (кровяные пластинки) — очень маленькие (диаметром \(3\)–\(4\) мкм), безъядерные (у человека) плоские клетки неправильной формы. Они постоянно образуются в красном костном мозге и живут всего несколько суток. Число их в крови человека колеблется от \(200\) до \(400\) тыс. в \(1\) мм³.
Основная функция тромбоцитов — способствовать остановке кровотечения. Они обладают свойством изменять свою форму (распластываться, сжиматься и т. п.), обеспечивая образование кровяного сгустка (тромба).

Свёртывание крови
Свёртывание крови — важнейшая защитная реакция, предохраняющая организм от кровопотери при разрушении сосудов.
Для взрослого мужчины условно смертельно опасной является потеря \(1,5\)–\(2,0\) л крови, а вот женщина может перенести потерю даже \(2,5\) л, хотя это, конечно, приводит к отрицательным последствиям.
Свёртывание крови — сложный процесс, в ходе которого из разрушенных тромбоцитов, повреждённых тканей мышц и сосудов выделяются особые биологически активные вещества — факторы свёртывания крови (их насчитывают более \(10\)).
При повреждении сосуда (например, при порезе) тромбоциты, находящиеся в этом месте, разрушаются и выделяют протромбин, который переводит растворимый белок плазмы крови фибриноген в нерастворимый белок фибрин. Длинные нити фибрина переплетаются между собой в сеть, где задерживаются форменные элементы крови, и образуется тромб, перекрывающий рану и прекращающий кровотечение. Образование тромба происходит в течение \(3\)–\(8\) мин. Со временем стенка сосуда восстанавливается, а тромб рассасывается.

При свёртывании крови вне организма, после отделения от неё кровяного сгустка, образуется сыворотка крови. Сыворотка почти соответствует плазме по составу крови, но в ней отсутствует фибриноген.
Нарушения свёртываемости крови
Отсутствие в крови факторов её свертывания или же нарушение их образования в организме приводит к тяжёлым заболеваниям. Одно из них — гемофилия. У больного гемофилией кровь не свёртывается, и человек может погибнуть от кровотечения при самых незначительных повреждениях сосудов. Гемофилией страдают исключительно мужчины (т. к. в организме человека за её развитие отвечает ген, находящийся в мужской половой хромосоме). Но подверженность этой болезни в роду передаётся по женской линии.
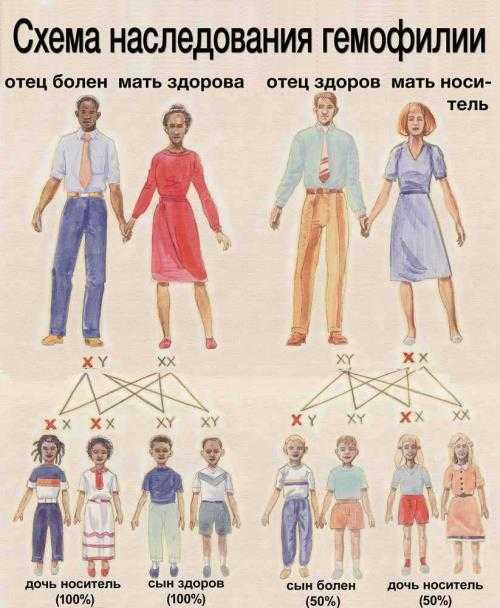
Пример:
сын последнего Российского императора Николая \(II\) — цесаревич Алексей — страдал гемофилией, которую он унаследовал от матери — императрицы Александры Фёдоровны (внучатой племянницы английской королевы Виктории, которая была носителем гена гемофилии).

Важную роль в процессе свёртывания крови играют и соли кальция. Если их удалить, то кровь утрачивает способность свёртываться.
Источники:
Любимова З. В., Маринова К. В. Биология. Человек и его здоровье. 8 класс. — М.: Владос.
Иллюстрации:
http://www.bbc.com/russian/science/2009/10/091008_royal_blood.shtml
http://ebiology.ru/sostav-i-funkcii-krovi-immunitet/
www.yaklass.ru
Свертывание крови (гемостаз): система, факторы, механизмы
Процесс свертывания крови начинается с кровопотери, но массивная кровопотеря, сопровождающаяся падением артериального давления, ведет к резким изменениям всей системы гемостаза.
Система свертывания крови (гемостаза)
Система свертывания крови — это сложный многокомпонентный комплекс гомеостаза человека, обеспечивающий сохранение целостности организма благодаря постоянному поддержанию жидкого состояния крови и формированию при необходимости различного типа тромбов, а также активации процессов заживления в местах сосудистых и тканевых повреждений.Функционирование системы свертывания обеспечивается непрерывным взаимодействием сосудистой стенки и циркулирующей крови. Известны определенные компоненты, отвечающие за нормальную деятельность коагулологической системы:
- эндотелиальные клетки сосудистой стенки,
- тромбоциты,
- адгезивные молекулы плазмы,
- плазменные факторы свертывания,
- системы фибринолиза,
- системы физиологических первичных и вторичных антикоагулянтов-антипротеаз,
- плазменная система физиологических первичных репарантов-заживителей.
Любые повреждения сосудистой стенки, «травмирование крови», с одной стороны, приводят к различной тяжести кровотечениям, а с другой — вызывают физиологические, а в последующем патологические изменения в системе гемостаза, которые способны сами по себе привести к гибели организма. К закономерным тяжелым и частым осложнениям массивной кровопотери относится острый синдром диссеминированного внутрисосудистого свертывания (острый ДВС-синдром).
При острой массивной кровопотере, а ее нельзя представить без повреждения сосудов, практически всегда имеет место локальный (в месте повреждения) тромбоз, который в сочетании с падением артериального давления может запустить острый ДВС-синдром, являющийся важнейшим и патогенетически наиболее неблагоприятным механизмом всех бед острой массивной кровопотери.
Эндотелиальные клетки
Эндотелиальные клетки сосудистой стенки обеспечивают поддержание жидкого состояния крови, непосредственно влияя на многие механизмы и звенья тромбообразования, полностью блокируя или эффективно сдерживая их. Сосуды обеспечивают ламинарность тока крови, что препятствует склеиванию клеточных и белковых компонентов.
Эндотелий несет на своей поверхности отрицательный заряд, как и циркулирующие в крови клетки, различные гликопротеины и другие соединения. Одноименно заряженные эндотелий и циркулирующие элементы крови отталкиваются, что препятствует слипанию клеток и белковых структур в циркуляторном русле.
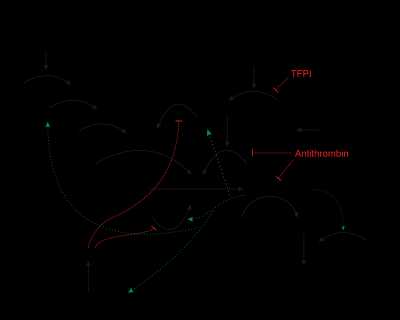
Поддержание жидкого состояния крови
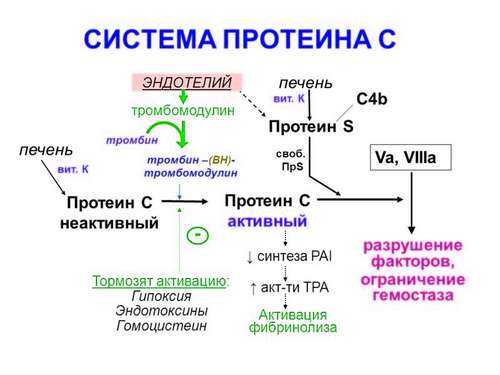 Схема системы протеина С
Схема системы протеина СПоддержанию жидкого состояния крови способствуют:
- простациклин (PGI2),
- NO и АДФаза,
- система протеина С,
- ингибитор тканевого тромбопластина,
- глюкозаминогликаны и, в частности, гепарин, антитромбин III, кофактор гепарина II, тканевой активатор плазминогена и др.
Простациклин
Блокада агглютинации и агрегации тромбоцитов в кровотоке осуществляется несколькими путями. Эндотелий активно вырабатывает простагландин I2 (PGI2), или простациклин, который ингибирует формирование первичных агрегатов тромбоцитов. Простациклин способен «разбивать» ранние агглютинаты и агрегаты тромбоцитов, вместе с тем являясь вазодилататором.
Окись азота (NO) и АДФаза
Дезагрегация тромбоцитов и вазодилатация осуществляются также путем выработки эндотелием окиси азота (NO) и так называемой АДФазы (фермента, расщепляющего аденозиндифосфат — АДФ) — соединения, вырабатываемого различными клетками и являющегося активным агентом, стимулирующим агрегацию тромбоцитов.
Система протеина С
Сдерживающее и ингибирующее влияние на свертывающую систему крови, преимущественно на ее внутренний путь активации, оказывает система протеина С. В комплекс этой системы входят:
- тромбомодулин,
- протеин С,
- протеин S,
- тромбин как активатор протеина С,
- ингибитор протеина С.
Эндотелиальные клетки вырабатывают тромбомодулин, который при участии тромбина активирует протеин С, переводя его соответственно в протеин Ca. Активированный протеин Са при участии протеина S инактивирует факторы Va и VIIIa, подавляя и ингибируя внутренний механизм свертывающей системы крови. Кроме того, активированный протеин Са стимулирует активность системы фибринолиза двумя путями: за счет стимуляции выработки и выброса из эндотелиальных клеток в кровоток тканевого активатора плазминогена, а также благодаря блокаде ингибитора тканевого активатора плазминогена (PAI-1).
Патология системы протеина С
Нередко наблюдаемая наследственная или приобретенная патология системы протеина С приводит к развитию тромботических состояний.
Фульминантная пурпура
Гомозиготный дефицит протеина С (фульминантная пурпура) — крайне тяжелая патология. Дети с фульминантной пурпурой практически нежизнеспособны и погибают в раннем возрасте от тяжелых тромбозов, острого ДВС-синдрома и сепсиса.
Тромбозы
Гетерозиготный наследственный дефицит протеина С или протеина S способствует возникновению тромбозов у молодых. Чаще наблюдаются тромбозы магистральных и периферических вен, тромбоэмболии легочной артерии, ранние инфаркты миокарда, ишемические инсульты. У женщин с дефицитом протеина С или S, принимающих гормональные контрацептивы, риск тромбозов (чаше тромбозов мозговых сосудов) возрастает в 10—25 раз.
Поскольку протеины С и S являются витамин К-зависимыми протеазами, вырабатываемыми в печени, лечение тромбозов непрямыми антикоагулянтами типа синкумара или пелентана у пациентов с наследственным дефицитом протеина С или S может приводить к усугублению тромботического процесса. Кроме того, у ряда больных при проведении лечения непрямыми антикоагулянтами (варфарином) могут развиваться периферические некрозы кожи («варфариновые некрозы»). Их появление практически всегда означает наличие гетерозиготною дефицита протеина С, что ведет к снижению фибринолитической активности крови, локальной ишемии и кожным некрозам.
V фактор Leiden
Еще одна патология, напрямую связанная с функционированием системы протеина С, получила название наследственной резистентности к активированному протеину С, или V фактор Leiden. По сути V фактор Leiden представляет собой мутантный V фактор с точечной заменой аргинина в 506-й позиции фактора V на глутамин. V фактор Leiden обладает повышенной резистентностью к прямому действию активированного протеина С. Если наследственный дефицит протеина С у пациентов преимущественно с венозными тромбозами встречается в 4-7% случаев, то V фактор Leiden, по данным разных авторов, — в 10—25%.
Ингибитор тканевого тромбопластина
Эндотелий сосудов также может ингибировать тромбообразование при активации свертывания крови по внешнему механизму. Эндотелиальные клетки активно вырабатывают ингибитор тканевого тромбопластина, который инактивирует комплекс тканевый фактор — фактор VIIa (ТФ—VIIa), что приводит к блокаде внешнего механизма свертывания крови, активизирующегося при попадании тканевого тромбопластина в кровоток, тем самым поддерживая текучесть крови в циркуляторном русле.
Глюкозаминогликаны (гепарин, антитромбин III, кофактор гепарина II)
Другой механизм поддержания жидкого состояния крови связан с выработкой эндотелием различных глюкозаминогликанов, среди которых известны гепаран- и дерматан-сульфат. Эти глюкозаминогликаны по строению и функциям близки к гепаринам. Вырабатываемый и выбрасываемый в кровоток гепарин связывается с циркулирующими в крови молекулами антитромбина III (AT III), активируя их. В свою очередь активированный AT III захватывает и инактивирует фактор Ха, тромбин и ряд других факторов свертывающей системы крови. Кроме механизма инактивации свертывания, осуществляющегося через АТ III, гепарины активируют так называемый кофактор гепарина II (КГ II). Активированный КГ II, как и AT III, ингибирует функции фактора Ха и тромбина.
Кроме влияния на активность физиологических антикоагулянтов-антипротеаз (AT III и КГ II), гепарины способны модифицировать функции таких адгезивных молекул плазмы, как фактор Виллебранда и фибронектин. Гепарин снижает функциональные свойства фактора Виллебранда, способствуя уменьшению тромботического потенциала крови. Фибронектин в результате гепариновой активации связывается с различными объектами—мишенями фагоцитоза — клеточными мембранами, тканевым детритом, иммунными комплексами, фрагментами коллагеновых структур, стафилококками и стрептококками. Вследствие стимулированных гепарином опсонических взаимодействий фибронектина активизируется инактивация мишеней фагоцитоза в органах макрофагальной системы. Очистка циркуляторного русла от объектов-мишеней фагоцитоза способствует сохранению жидкого состояния и текучести крови.
Кроме того, гепарины способны стимулировать выработку и выброс в циркуляторное русло ингибитора тканевого тромбопластина, что существенно снижает вероятность тромбоза при внешней активации свертывающей системы крови.
Процесс свертывания крови — тромбообразования
Вместе с описанным выше существуют механизмы, также связанные с состоянием сосудистой стенки, но не способствующие поддержанию жидкого состояния крови, а ответственные за ее свертывание.Процесс свертывания крови начинается с повреждения целостности сосудистой стенки. При этом различают внутренний и внешний механизмы процесса формирования тромба.
При внутреннем механизме повреждение только эндотелиального слоя сосудистой стенки приводит к тому, что поток крови контактирует со структурами субэндотелия — с базальной мембраной, в которой основными тромбогенными факторами являются коллаген и ламинин. С ними взаимодействуют находящиеся в крови фактор Виллебранда и фибронектин; формируется тромбоцитарный тромб, а затем — фибриновый сгусток.
Необходимо отметить, что тромбы, формирующиеся в условиях быстрого кровотока (в артериальной системе), могут существовать практически только при участии фактора Виллебранда. Напротив, в формировании тромбов при относительно небольших скоростях кровотока (в микроциркуляторном русле, венозной системе) участвуют как фактор Виллебранда, так и фибриноген, фибронектин, тромбоспондин.
Другой механизм тромбообразования осуществляется при непосредственном участии фактора Виллебранда, который при повреждении целостности сосудов существенно увеличивается в количественном отношении вследствие поступления из телец Вейбола-Паллада эндотелия.
Системы и факторы свертывания крови
Тромбопластин
Важнейшую роль во внешнем механизме тромбообразования играет тканевый тромбопластин, поступающий в кровоток из интерстициального пространства после разрыва целостности сосудистой стенки. Он индуцирует тромбообразование, активируя свертывающую систему крови при участии VII фактора. Поскольку тканевый тромбопластин содержит фосфолипидную часть, тромбоциты в этом механизме тромбообразования участвуют мало. Именно появление тканевого тромбопластина в русле крови и его участие в патологическом тромбообразовании и определяют развитие острого ДВС-синдрома.
Цитокины
Следующий механизм тромбообразования реализуется с участием цитокинов — интерлейкина-1 и интерлейкина-6. Образующийся в результате их взаимодействия фактор некроза опухоли стимулирует выработку и выброс из эндотелия и моноцитов тканевого тромбопластина, о значении которого уже говорилось. Этим объясняется развитие локальных тромбов при различных заболеваниях, протекающих с четко выраженными воспалительными реакциями.
Тромбоциты
Специализированными клетками крови, участвующими в процессе ее свертывания, являются тромбоциты — безъядерные клетки крови, представляющие собой фрагменты цитоплазмы мегакариоцитов. Продукция тромбоцитов связана с определенным цитокином — тромбопоэтином, регулирующим тромбоцитопоэз.
Количество тромбоцитов в крови составляет 160-385×109/л. Они хорошо видны в световом микроскопе, поэтому при проведении дифференциальной диагностики тромбозов или кровоточивости микроскопия мазков периферической крови необходима. В норме размер тромбоцита не превышает 2-3,5 мкм (около ⅓-¼ диаметра эритроцита). При световой микроскопии неизмененные тромбоциты выглядят как округлые клетки с ровными краями и красно-фиолетовыми гранулами (α-гранулы). Продолжительность жизни тромбоцитов составляет в среднем 8-9 сут. В норме они дискоидной формы, но при активации принимают форму сферы с большим количеством цитоплазматических выпячиваний.
В тромбоцитах имеется 3 типа специфических гранул:
- лизосомы, содержащие в большом количестве кислые гидролазы и другие ферменты;
- α-гранулы, содержащие множество различных белков (фибриноген, фактор Виллебранда, фибронектин, тромбоспондин и др.) и окрашивающиеся по Романовскому-Гимзе в фиолетово-красный цвет;
- δ-гранулы — плотные гранулы, содержащие большое количество серотонина, ионов К+, Ca2+, Mg2+ и др.
В α-гранулах содержатся строго специфичные белки тромбоцитов — такие, как 4-й пластиночный фактор и β-тромбоглобулин, являющиеся маркерами активации тромбоцитов; их определение в плазме крови может помочь в диагностике текущих тромбозов.
Кроме того, в структуре тромбоцитов имеются система плотных трубочек, являющаяся как бы депо для ионов Ca2+, а также большое количество митохондрий. При активации тромбоцитов происходит ряд биохимических реакций, которые при участии циклооксигеназы и тромбоксансинтетазы приводят к образованию тромбоксана А2 (ТХА2) из арахидоновой кислоты — мощного фактора, отвечающего за необратимую агрегацию тромбоцитов.
Тромбоцит покрыт 3-слойной мембраной, на внешней ее поверхности располагаются различные рецепторы, многие из которых являются гликопротеинами и взаимодействуют с различными белками и соединениями.
Тромбоцитарный гемостаз
Рецептор гликопротеина Iа связывается с коллагеном, рецептор гликопротеина Ib взаимодействует с фактором Виллебранда, гликопротеинами IIb-IIIa — с молекулами фибриногена, хотя может связываться и с фактором Виллебранда, и с фибронектином.
При активации тромбоцитов агонистами — АДФ, коллагеном, тромбином, адреналином и др. — на их внешней мембране появляется 3-й пластиночный фактор (мембранный фосфолипид), активирующий скорость свертывания крови, повышая ее в 500-700 тыс. раз.
Плазменные факторы свертывания крови
Плазма крови содержит несколько специфических систем, участвующих в каскаде свертывания крови. Это системы:
- адгезивных молекул,
- факторов свертывания крови,
- факторов фибринолиза,
- факторов физиологических первичных и вторичных антикоагулянтов-антипротеаз,
- факторов физиологических первичных репарантов-заживителей.
Система адгезивных молекул плазмы
Система адгезивных молекул плазмы представляет собой комплекс гликопротеинов, отвечающих за межклеточные, клеточно-субстратные и клеточно-белковые взаимодействия. К ней относятся:
- фактор Виллебранда,
- фибриноген,
- фибронектин,
- тромбоспондин,
- витронектин.
Фактор Виллебранда
Фактор Виллебранда высокомолекулярный гликопротеин с молекулярной массой 103 кД и более. Фактор Виллебранда выполняет множество функций, но основные из них две:
- взаимодействие с VIII фактором, благодаря чему происходит защита антигемофильного глобулина от протеолиза, что увеличивает продолжительность его жизни;
- обеспечение процессов адгезии и агрегации тромбоцитов в циркуляторном русле, особенно при высоких скоростях кровотока в сосудах артериальной системы.
Снижение уровня фактора Виллебранда ниже 50%, наблюдающееся при болезни или синдроме Виллебранда, приводит к выраженной петехиальной кровоточивости, как правило, микроциркуляторного типа, проявляющейся синяковостью при небольших травмах. Однако при тяжелой форме болезни Виллебранда может наблюдаться гематомный тип кровоточивости, подобный гемофилии (кровоизлияние в полость сустава — гемартроз).
Напротив, существенное повышение концентрации фактора Виллебранда (более 150%) может приводить к тромбофилическому состоянию, что нередко клинически проявляется различного типа тромбозами периферических вен, инфарктом миокарда, тромбозами системы легочной артерии или мозговых сосудов.
Фибриноген — фактор I
Фибриноген, или фактор I, участвует во многих межклеточных взаимодействиях. Его основными функциями являются участие в формировании фибринового тромба (армирование тромба) и осуществление процесса агрегации тромбоцитов (прикрепление одних тромбоцитов к другим) благодаря специфическим тромбоцитарным рецепторам гликопротеинов IIb-IIIа.
Плазменный фибронектин
Плазменный фибронектин — адгезивный гликопротеин, взаимодействующий с различными факторами свертывания крови.Также одной из функций плазменного фибронектина является репарация дефектов сосудов и тканей. Показано, что нанесение фибронектина на участки тканевых дефектов (трофические язвы роговицы глаза, эрозии и язвы кожных покровов) способствует стимуляции репаративных процессов и более быстрому заживлению.
Нормальная концентрация плазменного фибронектина в крови — около 300 мкг/мл. При тяжелых травмах, массивной кровопотере, ожогах, длительных полостных операциях, сепсисе, остром ДВС-синдроме в результате потребления уровень фибронектина падает, что снижает фагоцитарную активность макрофагальной системы. Именно этим можно объяснить высокую частоту инфекционных осложнений у лиц, перенесших массивную кровопотерю, и целесообразность назначения пациентам переливания криопреципитата или свежезамороженной плазмы, содержащих в большом количестве фибронектин.
Тромбоспондин
Основными функциями тромбоспондина являются обеспечение полноценной агрегации тромбоцитов и связывание их с моноцитами.
Витронектин
Витронектин, или белок, связывающийся со стеклом, участвует в нескольких процессах. В частности, он связывает комплекс АТ III-тромбин и в дальнейшем выводит его из циркуляции через макрофагальную систему. Кроме того, витронектин блокирует клеточно-литическую активность конечного каскада факторов системы комплемента (комплекс С5-С9), тем самым препятствуя реализации цитолитического эффекта активации системы комплемента.
Факторы свертывания крови
Система плазменных факторов свертывания крови — это сложный многофакторный комплекс, активация которого приводит к формированию стойкого фибринового сгустка. Она играет основную роль в остановке кровотечения при всех вариантах повреждения целостности сосудистой стенки.
Система фибринолиза
Система фибринолиза является важнейшей системой, препятствующей бесконтрольному свертыванию крови. Активация системы фибринолиза реализуется по внутреннему либо по внешнему механизму.
Внутренний механизм активации
Внутренний механизм активации фибринолиза начинается с активации плазменного XII фактора (фактора Хагемана) при участии высокомолекулярного кининогена и калликреин-кининовой системы. В результате плазминоген переходит в плазмин, который расщепляет молекулы фибрина на мелкие фрагменты (X, Y, D, Е), опсоннзируюшиеся плазменным фибронектмном.
Внешний механизм активации
Внешний путь активации фибринолитической системы может осуществляться стрептокиназой, урокиназой либо тканевого активатора плазминогена. Внешний путь активации фибринолиза часто используется в клинической практике для лизирования острых тромбозов различной локализации (при тромбоэмболии легочной артерии, остром инфаркте миокарда и др.).
Система первичных и вторичных антикоагулянтов-антипротеаз
Система физиологических первичных и вторичных антикоагулянтов-антипротеаз существует в организме человека для инактивации различных протеаз, плазменных факторов свертывания и многих компонентов фибринолитической системы.
К первичным антикоагулянтам относится система, включающая гепарин, AT III и КГ II. Эта система преимущественно ингибирует тромбин, фактор Ха и ряд других факторов свертывающей системы крови.
Система протеина С, как уже отмечалось, ингибирует Va и VIIIa плазменные факторы свертывания, что в итоге тормозит свертывание крови по внутреннему механизму.
Система ингибитора тканевого тромбопластина и гепарин ингибируют внешний путь активации свертывания крови, а именно комплекс ТФ-VII фактор. Гепарин в этой системе играет роль активатора выработки и выброса в кровоток ингибитора тканевого тромбопластинаиз эндотелия сосудистой стенки.
PAI-1 (ингибитор тканевого активатора плазминогена) является основной антипротеазой, инактивирующей активность тканевого активатора плазминогена.
К физиологическим вторичным антикоагулянтам-антипротеазам относятся компоненты, концентрация которых повышается в процессе свертывания крови. Одним из основных вторичных антикоагулянтов является фибрин (антитромбин I). Он активно сорбирует на своей поверхности и инактивирует циркулирующие в кровотоке свободные молекулы тромбина. Инактивировать тромбин могут также дериваты факторов Va и VIIIa. Кроме того, в крови тромбин инактивируют циркулирующие молекулы растворимого гликокалицина, которые представляют собой остатки рецептора тромбоцитов гликопротеина Ib. В составе гликокалицина имеется определенная последовательность — «ловушка» для тромбина. Участие растворимого гликокалицина в инактивации циркулирующих молекул тромбина позволяет достигать самоограничения тромбообразования.
Система первичных репарантов-заживителей
В плазме крови находятся определенные факторы, которые способствуют процессам заживления и репарации сосудистых и тканевых дефектов, — так называемая физиологическая система первичных репарантов-заживителей. В эту систему входят:
- плазменный фибронектин,
- фибриноген и его производное фибрин,
- трансглутаминаза или XIII фактор свертывающей системы крови,
- тромбин,
- фактор роста тромбоцитов — тромбопоэтин.
О роли и значении каждого из этих факторов в отдельности уже говорилось.
Механизм свертывания крови
 Схема свертывания крови
Схема свертывания кровиВыделяют внутренний и внешний механизм свертывания крови.
Внутренний путь свертывания крови
Во внутреннем механизме свертывания крови участвуют факторы, находящиеся в крови в нормальных условиях.
По внутреннему пути процесс свертывания крови начинается с контактной или протеазной активации XII фактора (или фактора Хагемана) при участии высокомолекулярного кининогена и калликреин-кининовой системы.
⇓
XII фактор превращается в XIIа (активированный) фактор, который активирует XI фактор (предшественник плазменного тромбопластина), переводя его в фактор ХIа.
⇓
Последний активирует IX фактор (антигемофилический фактор В, или фактор Кристмаса), переводя его при участии фактора VIIIa (антигемофилический фактор А) в фактор IХа. В активации IX фактора участвуют ионы Ca2+ и 3-й тромбоцитарный фактор.
⇓
Комплекс факторов IХа и VIIIa с ионами Ca2+ и 3-м тромбоцитарным фактором активирует X фактор (фактор Стюарта), переводя его в фактор Ха. В активации X фактора принимает также участие фактор Va (проакцелерин).
⇓
Комплекс факторов Ха, Va, ионов Са (IV фактор) и 3-го тромбоцитарного фактора называется протромбиназой; она активирует протромбин (или II фактор), превращая его в тромбин.
⇓
Последний расщепляет молекулы фибриногена, переводя его в фибрин.
⇓
Фибрин из растворимой формы под влиянием фактора XIIIа (фибринстабилизирующий фактор) превращается в нерастворимый фибрин, который непосредственно и осуществляет армирование (укрепление) тромбоцитарного тромба.
Внешний путь свертывания крови
Внешний механизм свертывания крови осуществляется при попадании в циркуляторное русло из тканей тканевого тромбопластина (или III, тканевого, фактора).
Тканевый тромбопластин связывается с VII фактором (проконвертином), переводя его в фактор VIIa.
⇓
Последний активирует X фактор, переводя его в фактор Ха.
Дальнейшие превращения свертывающего каскада такие же, как при активации плазменных факторов свертывания по внутреннему механизму.
Механизм свертывания крови кратко
В целом механизм свертывания крови кратко может быть представлен как ряд последовательных этапов:
- в результате нарушения нормального кровотока и повреждения целостности сосудистой стенки развивается дефект эндотелия;
- к обнажившейся базальной мембране эндотелия (к коллагену, ламинину) прилипают фактор Виллебранда и плазменный фибронектин;
- циркулирующие тромбоциты также прилипают к коллагену и ламинину базальной мембраны, а затем к фактору Виллебранда и фибронектину;
- адгезия тромбоцитов и их агрегация приводят к появлению на их внешней поверхностной мембране 3-го пластиночного фактора;
- при непосредственном участии 3-го пластиночного фактора происходит активация плазменных факторов свертывания, что приводит к образованию в тромбоцитарном тромбе фибрина — начинается армирование тромба;
- активируется система фибринолиза как по внутреннему (через XII фактор, высокомолекулярный кининоген и калликреин-кининовую систему), так и по внешнему (под влиянием ТАП) механизмам, останавливающая дальнейшее тромбообразование; при этом происходит не только лизирование тромбов, но и образование большого количества продуктов деградации фибрина (ПДФ), которые в свою очередь блокируют патологическое тромбообразование, обладая фибринолитической активностью;
- начинаются репарация и заживление сосудистого дефекта под влиянием физиологических факторов репаративно-заживительной системы (плазменного фибронектина, трансглутаминазы, тромбопоэтина и др.).
При острой массивной кровопотере, осложненной шоком, равновесие в системе гемостаза, а именно между механизмами тромбообразования и фибринолиза быстро нарушается, так как потребление существенно превосходит продукцию. Развивающееся истощение механизмов свертывания крови и является одним из звеньев развития острого ДВС-синдрома.
Похожие медицинские статьи
newvrach.ru
Свертываемость крови. Стадии гемостаза, факторы свертываемости
Гемостаз – это система, которая поддерживает жидкое состояние крови и предупреждает развитие кровотечений. Кровь осуществляет жизненно важные функции в организме человека, поэтому значительная потеря крови грозит нарушением работы всех органов и систем.
Система свертывания крови включает три составляющие:
- Собственно свертывающую систему – непосредственно осуществляет коагуляцию крови.
- Противосвертывающую систему – действие направлено на предотвращение сворачивания крови (патологического тромбообразования).
- Фибринолитическую систему – обеспечивает распад образовавшихся тромбов.
Свертывание крови – физиологический процесс, предотвращающий выход плазмы и клеток крови из кровеносного русла, путем поддержания целостности сосудистой стенки.
Учение о свертываемости крови сформировал А. Шмидт еще в прошлом столетии. При возникновении кровотечения активируются и участвуют в его остановке такие структуры как: эндотелий, факторы свертывания, форменные элементы, в большей мере тромбоциты. Для осуществления коагуляции крови нужны вещества, такие как кальций, протромбин, фибриноген.
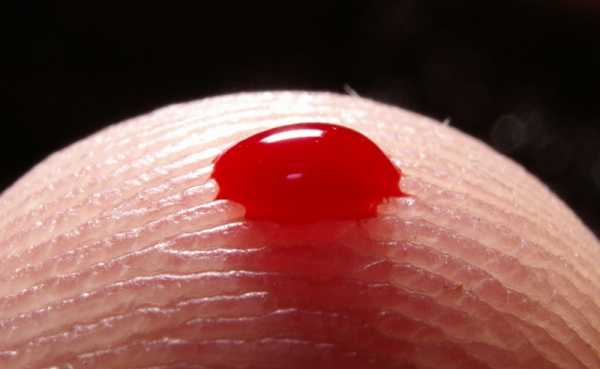 Свертываемость крови
Свертываемость кровиСтадии первичного гемостаза (сосудисто-тробоцитарного)
Процесс свертывания крови начинается с включения сосудисто-тромбоцитарного этапа. Существует четыре стадии:
- Идет кратковременный спазм в сосудистом русле, который длится около 1 минуты. Диаметр просвета сужается на 30% под действием тромбоксана и серотонина, которые выделяются из активированных тромбоцитов.
- Адгезия тромбоцитов – начинается скапливание тромбоцитов возле поврежденного участка, они видоизменяются – меняют форму и формируют отростки, и способны прикрепится к сосудистой стенке.
- Агрегация тромбоцитов – процесс склеивания тромбоцитов друг с другом. Формируется неплотный тромб, способный пропускать плазму, как следствие все больше тромбоцитов наслаиваются на новообразованный тромб. Потом он уплотняется и плазма не проходит сквозь плотный сгусток – наступает необратимая агрегация тромбоцитов.
- Ретракция тромба – продолжающееся уплотнение тромботического сгустка.
Сосудисто-тромбоцитарный способ прекращения кровотечения – это первичный гемостаз, есть более сложный механизм свертывания крови – это вторичный гемостаз, происходит с помощью ферментных и неферментных веществ.
Стадии вторичного гемостаза
Существует 3 фазы свертывание крови на этапе вторичного гемостаза:
- Фаза активации – ферменты активируются, все заканчивается образованием протромбиназы и получением тромбина из протромбина;
- фаза коагуляция – формирование фибриновых нитей из фибриногена;
- фаза ретракции – идет образование плотного тромба.
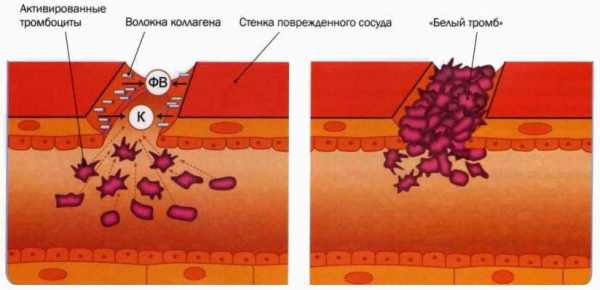 Механизм образования первичного тромба
Механизм образования первичного тромбаПервая фаза свертывания крови
Плазменные факторы свертывания крови – совокупность неактивных ферментов и неферментных соединений, которые обитают в плазменной части крови и кровяных пластинках. Для свертывания крови помимо прочего необходимы ионы Са (IV) и витамин К.
Когда повреждаются ткани, разрываются сосуды, идет гемолиз клеток крови включается череда реакций с активацией ферментов. Начало активации обусловлено взаимодействием плазменных факторов свертывания с разрушенными тканями (внешний тип активации коагуляции), частями эндотелия и форменных элементов (внутренний тип активации коагуляции).
Внешний механизм
Из оболочки разрушенных клеток в кровяное русло попадает специфический белок – тромбопластин (III фактор). Он активирует VII фактор, присоединяя молекулу кальция, эта новообразованная субстанция воздействует на X фактор для последующей активации. После X фактор соединяется с тканевыми фосфолипидами и V фактором. Сформировавшийся комплекс за пару секунд преобразовывает долю протромбина в тромбин.
Внутренний механизм
Под действием разрушенного эндотелия или форменных элементов активируется XII фактор, который после воздействия кининогена плазмы активирует XI фактор. XI действует на IX фактор, который после перехода в активную фазу формирует комплекс: «коагуляционный фактор (IX) + Антигемофильный фактор В (VIII) + тромбоцитарный фосфолипид + ионы Са (IV)». Он активирует фактор Стюарта-Прауэра (X). Активированный X совместно с V и ионами Са действуют на фосфолипидную оболочку клетки и формируют новое образование – кровяную протромбиназу, которое обеспечивает переход протромбина в тромбин.
К плазменным факторам свертывания относятся неферментные белки – акселераторы (V, VII). Они нужны для эффективного и быстрого оседания крови, потому что ускоряют коагуляцию в тысячи раз.
Внешний механизм свертывания крови длится примерно 15 секунд, на внутренний приходится от 2 до 10 минут. Завершается эта фаза свертывания образованием тромбина из протромбина.
Протромбин синтезируется в печени, чтобы синтез осуществлялся нужен витамин К, который поступает с едой и накапливается в печеночной ткани. Таким образом, при поражении печени или недостатке витамина К, система свертывания крови не функционирует нормально, и часто возникает неконтролируемый выход крови из сосудистого русла.
Таблица факторов свертываемости крови
| Факторы свертывания крови | |
|---|---|
| Факторы | Свойства |
| I – фибриноген | Тромбин инициирует превращение первого фактора в фибрин |
| II – протромбин | Синтез в печени только совместно с витамином К |
| III – тромбопластин | При его участии протромбин преобразуется в тромбин |
| IV – ионы кальция | Нужны для активации факторов свертывания |
| V – проакцелерин | Стимулирует переход протромбина в тромбин |
| VI – сывороточный акцелератор | Инициирует переход протромбина в тромбин |
| VII – проконвертин | Действует на третий фактор (активация) |
| VIII — антигемофильный фактор А | Кофактор Х фактора |
| IX — антигемофильный фактор В (Кристмаса) | Активирует VIII и IV факторы |
| X – фактор Стюарта-Прауэра | Стимулирование протромбиназы |
| XI – предшественник тромбопластина | Активирует VIII и IX факторы |
| XII – фактор Хагемана | Берет участие в преобразовании прекалликреина в калликреин |
| XIII – фибрин- стабилизирующий фактор | Стабилизация сформировавшейся фибриновой массы |
Вторая фаза свертывания крови
Свертывание крови связано с переходом I фактора в нерастворимую субстанцию — фибрин. Фибриноген – гликопротеин, который при воздействии тромбина распадается на низкомолекулярное вещество — мономеры фибрина.
Следующий шаг образование неплотной массы – геля фибрина, из него формируется фибриновая сеть (белый тромб), нестабильная субстанция. Для ее стабилизации включается фибринстабилизирующий фактор (XIII) и тромб закрепляется в участке повреждения. Образованная сеть фибрина задерживает кровяные тельца — тромб становится красным.
Третья фаза свертывания крови
Ретракция кровяного сгустка идет при участии белка тромбостенина, Са, фибриновых нитей, актина, миозина, которые обеспечивают сжатие образованного тромба, тем самым предотвращают полную закупорку сосуда. После фазы ретракции восстанавливается кровоток по поврежденному сосуду, а тромб плотно прилегает и фиксируется к стенке.
Для предотвращения дальнейшего свертывания крови в организме активируется противосвертывающая система. Ее основные составляющие: нити фибрина, антитромбин III, гепарин.
К неповрежденным сосудам кровяные пластинки не адгезируются, этому способствуют сосудистые факторы: эндотелий, соединения гепарина, гладкость внутренней выстилки сосудов и др. Таким образом, в системе гемостаза поддерживается равновесие, и функционирование организма не нарушается.
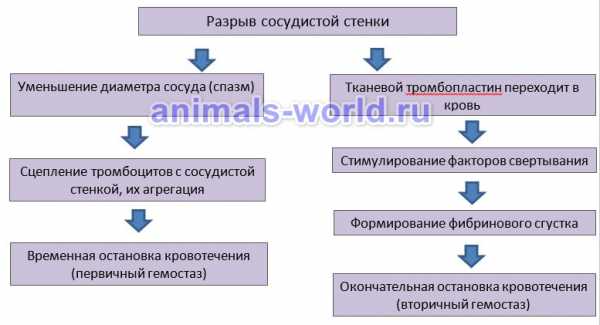 Схема свертывания крови
Схема свертывания кровиВремя свертывания крови в норме
Существует ряд методов определения время коагуляции. Для применения способа по Сухареву, каплю крови помещают в пробирку и ждут, когда она выпадет в осадок. При отсутствии патологии, продолжительность свертывания составляет 30 – 120 секунд.
Свертываемость по Дуке определяют следующим образом: производят прокол мочки уха и через 15 секунд промокают область прокола специальной бумагой. Когда кровь не будет появляться на бумаге, значит коагуляция произошла. В норме время свертывания по Дуке от 60 до 180 секунд.
При определении свертывания венозной крови пользуются методикой Ли-Уайта. Необходимо набрать 1 мл крови из вены и поместить в пробирку, наклонить под углом 50°. Проба заканчивается, когда кровь не вытекает из колбы. В норме продолжительность свертывания не должна превышать 4-6 минут.
Время свертывания может увеличиваться при геморрагическом диатезе, врожденной гемофилии, недостаточном количестве тромбоцитов, при развитии диссеминированного внутрисосудистого свертывания и других заболеваниях.
animals-world.ru
Свертывание крови
Кровь является единственной жидкой тканью организма. При нарушении целостности кровеносных сосудов она должна свертываться, чтобы предотвратить кровотечения из организма. Поскольку отсутствие свертываемости крови может привести при повреждении сосудов к значительным кровопотерям и, как следствие, смерти животного.
Гемостаз – это процесс остановки кровотечения из сосудов при их повреждении. Гемостаз осуществляется в организме системой РАСК – регуляция агрегатного состояния крови. Эта регуляция осуществляется факторами свертывающей, противосвертывающей и фибринолитической систем крови. В здоровом организме данные системы взаимосвязаны и находятся в динамическом равновесии. Изменение функционального состояния одной из систем сопровождается компенсаторными сдвигами в деятельности другой. Нарушение взаимосвязей между системами может привести к тяжелым патологическим состояниям организма: повышенная кровоточивость сосудов или внутрисосудистое тромбообразование.
К факторам, поддерживающим кровь в жидком состоянии, следует отнести следующие:
1) внутренняя стенка сосудов имеет гладкую поверхность;
2) эндотелий сосудов и форменные элементы крови заряжены отрицательно, а одноименно заряженные тела отталкиваются друг от друга;
3) большая скорость кровотока в сосудистом русле приводит к распределению эритроцитов по оси сосуда, а плазмы – вдоль стенок сосуда;
4) факторы свертывающей системы крови находятся в сосудистом русле в неактивном состоянии;
5) эндотелий сосудов секретирует простациклин, ингибирующий агрегацию тромбоцитов, а также образует антитромбин и активаторы фибринолиза;
6) в крови присутствуют естественные антикоагулянты: антитромбопластины, антитромбины, гепарин.
Свертывающая система крови.
Свертывание крови (гемокоагуляция) – это жизненно важная защитная реакция организма, направленная на сохранение крови в сосудистой системе и предотвращающая гибель животного от кровопотери при повреждении сосудов.
В процессе остановки кровотечения участвуют: сосуды, окружающая сосуды ткань, физиологически активные вещества плазмы крови, форменные элементы крови (в основном тромбоциты). Регуляция данного процесса происходит нейрогуморальным путем.
Основные положения ферментативной теории свертывания крови были разработаны А. Шмидтом более 100 лет назад.
Биологически активные вещества плазмы крови, принимающие участие в ее свертывании, называют факторами свертывания крови. В зависимости от места нахождения эти факторы подразделяют на плазменные, тромбоцитарные, эритроцитарные, лейкоцитарные и другие.
Плазменные факторы свертывания крови обозначают римскими цифрами в порядке их хронологического открытия. Иногда эти факторы называют по химическому составу, по свойствам или по фамилии больного, у которого впервые был обнаружен дефицит данного фактора. К плазменным факторам относят следующие:
I – фибриноген – является основой тромба. После выпадения осадок называется фибрином.
II – протромбин – является неактивной формой фермента тромбина, который вызывает выпадение в осадок фибриногена. Одновременно растворяет фибрин.
III – тканевый тромбопластин – участвует в образовании тканевой протромбиназы.
IV – ионы кальция – участвуют во всех фазах свертывания.
V – проакцелерин, ацеклерин (Ас-глобулин или глобулин-акцелератор) – ускоряет свертывание крови.
VI – исключен из номенклатуры.
VII – конвертин – участвует в образовании тканевой протромбиназы.
VIII – антигемофильный глобулин А – участвует в образовании кровяной протромбиназы.
IX – антигемофильный глобулин В (фактор Кристмасса) — участвует в образовании кровяной протромбиназы (активирует фактор X).
X – фактор Стюарта–Прауэра — участвует в образовании тканевой и кровяной протромбиназы, а также тромбина из протромбина.
XI – антигемофильный глобулин С (плазменный предшественник тромбопластина, фактор Розенталя) – активирует фактор IX.
XII – фактор Хагемана (контактный фактор) – активирует фактор XI и совместно с ним индуцирует процесс свертывания крови. Он участвует в фибринолизе.
XIII – фибринстабилизирующий фактор (фибриназа) – участвует в образовании фибрина, а также в регенерации тканей.
XIV – фактор Флетчера (калликреин).
XV – фактор Фитцджеральда–Фложе (кининоген).
Тромбоцитарные (пластинчатые) факторы свертывания крови обозначают арабскими цифрами. К ним следует отнести:
ПФ-3 — тромбоцитарный тромбопластин – липидно-белковый комплекс, выполняет роль матрицы, на которой происходит гемокоагуляция.
ПФ-4 – антигепариновый фактор.
ПФ-5 – фибриноген, который способствует адгезии и агрегации тромбоцитов.
ПФ-6 — тромбостенин – актиномиозиновый комплекс, обеспечивающий ретракцию тромба.
ПФ-10 – серотонин.
ПФ-11 – комплекс АТФ и тромбоксана, участвующий в агрегации.
Аналогичные биологически активные вещества открыты в эритроцитах и в лейкоцитах, но они менее изучены. При переливании несовместимой крови, резус-конфликте матери и плода происходит массовое разрушение эритроцитов и выход данных факторов в плазму. Это является причиной интенсивного внутрисосудистого свертывания крови. Лейкоцитарные факторы являются причиной свертывания крови при многих воспалительных и инфекционных заболеваниях.
По современным представлениям в остановке кровотечения принимают участие 2 механизма: сосудисто-тромбоцитарный (микроциркуляционный) и коагуляционный.
Сосудисто-тромбоцитарный (микроциркуляционный) гемостаз.
Благодаря этому механизму происходит остановка кровотечения из мелких сосудов с низким давлением крови. При травме или изменении эндотелия (шероховатость, изъязвления и др.) таких кровеносных сосудов вначале происходит их рефлекторный спазм, что уменьшает приток крови к поврежденному участку. В дальнейшем спазм поддерживается сосудосуживающими веществами (серотонин, норадреналин, адреналин), освобождающимися из тромбоцитов и поврежденных клеток тканей.
Эндотелий сосудов в месте повреждения изменяет свой заряд с отрицательного на положительный. Это приводит к адгезии отрицательно заряженных тромбоцитов на положительно заряженной раневой поверхности. Одновременно происходит агрегация и склеивание тромбоцитов с образованием тромбоцитарной пробки, или тромба. Сначала образуется рыхлая тромбоцитарная пробка, через которую проходит плазма (обратимая агрегация). Затем тромбоциты теряют свою структурность и сливаются в однородную массу, образуя плотную пробку, непроницаемую для плазмы (необратимая агрегация).
Тромбоцитарная пробка образуется в среднем в течение 1-3 минут с момента повреждения сосуда и кровотечение из мелких сосудов останавливается.
Коагуляционный гемостаз.
В крупных сосудах тромбоцитарный тромб не выдерживает высокого давления крови и вымывается. Поэтому в крупных сосудах гемостаз осуществляется ферментативным коагуляционным механизмом с образованием более прочного фибринового тромба.
Свертывание крови — это цепной ферментативный процесс. Его сущность заключается в переходе растворимого белка крови фибриногена в нерастворимый фибрин, в результате чего образуется прочный фибриновый тромб. Ферментативный процесс свертывания крови протекает в 3 фазы. По его окончании происходит ретракция кровеного сгустка.
I фаза
Взаимодействие плазменных и тканевых факторов приводит к образованию протромбиназы.
II фаза
Под влиянием протромбиназы протромбин превращается в тромбин.
III фаза
Тромбин вызывает превращение фибриногена в фибрин.
В эти фазы в крови происходят следующие процессы:
I фаза.
Она является самой сложной и продолжительной. В результате этой фазы образуется протромбиназа. Образование протромбиназы может идти двумя путями: внутренним (кровяным) и внешним (тканевым).
Внутренний путь осуществляется без внешнего повреждения стенок сосуда. Он начинается с разрушения тромбоцитов после адгезии и агрегации на измененной стенке сосуда. Это приводит к активации веществ плазмы и форменных элементов крови: IV, VI, VIII, IX, XI, XII, XIV, XV, тромбоцитарного фактора 3. Под влиянием данных факторов образуется кровяная протромбиназа. Этот процесс продолжается 5-10 минут.
Внешний путь начинается с повреждения стенок сосуда. Элементы разрушенных стенок сосудов активируют тканевый тромбопластин (III), который взаимодействует с IV, V, VI, VII, X факторами. В результате этого образуется тканевая протромбиназа. Процесс длится 5-10 с.
II фаза.
Под влиянием протромбиназы и в присутствии IV, V, VI, VII, X факторов осуществляется переход протромбина в активную форму — тромбин. Превращение веществ происходит за 1-5 с.
III фаза.
Тромбин вызывает превращение растворимого белка крови фибриногена в нерастворимый фибрин, который составляет основу тромба. Вначале под влиянием тромбина происходит образование фибрин-мономера. Затем с участием ионов кальция образуется растворимый фибрин-полимер, который под влиянием XIII фактора переходит в нерастворимый фибрин-полимер. Он обладает устойчивостью к фибринолизу. В нитях фибрина застревают форменные элементы крови и формируется кровяной сгусток (фибриновый тромб), который закупоривает рану.
Ретракция.
Она начинается после образования сгустка крови. Ретракция – это самопроизвольное отделение сыворотки крови от ее сгустка, в результате чего происходит сокращение и уплотнение тромба в поврежденном сосуде. Ретракция происходит с помощью сократительного белка тромбоцитов под влиянием тромбостенина и ионов кальция. Через 2-3 часа сгусток крови сжимается до 25–50% от своего первоначального объема. В результате ретракции тромб становится более плотным, прочным и непроницаемым для крови. Кроме того, он стягивает края раны сосуда, способствуя регенерации тканей.
Взаимосвязь факторов свертывания крови.
Вещества, участвующие в свертывании крови, постоянно образуются и находятся в ней, но в неактивном состоянии. При отсутствии или недостатке хотя бы одного из факторов нарушается весь процесс свертывания крови. Это можно наблюдать при генетическом заболевании (гемофилии), при тяжелых и дегенеративных заболеваниях печени, при гипо- и авитаминозе К, при недостатке ионов кальция и др.
Гемофилия возникает вследствие дефицита плазменных факторов – антигемофилийных глобулинов. Она передается по наследству. При этом у человека гемофилией болеют только мужчины, а передают ее женщины. Данное генетическое заболевание также встречается у лошадей, собак и свиней. Так, больные поросята даже от незначительных ранений истекают кровью и погибают. У свиней болеют и передают болезнь особи обоего пола.
Заболевания печени влияют на процесс коагуляции крови, так как большинство плазменных факторов образуется в печени, а для синтеза некоторых из них (II, VII, IX, X) необходим витамин К.
Витамин К содержится в растительной пище и синтезируется микрофлорой кишечника. Он является жирорастворимым витамином, поэтому его дефицит может возникать при снижении желчеобразования, при угнетении всасывания жиров в кишечнике, при подавлении кишечной микрофлоры антибиотиками. Кроме того, в кормах может содержаться антагонист витамина К – дикумарин. Поэтому дикумарин используют для борьбы с грызунами, которые погибают в результате множественных внутренних кровоизлияний. Кроме того, дикумарин и его синтетические производные нашли применение в качестве антикоагулянтов.
Процесс свертывания крови может ускоряться или замедляться под влиянием ряда причин:
1) Факторы, ускоряющие процесс свертывания крови:
— немного повышенная температура тела животного, так как она повышает скорость ферментативных процессов свертывания крови;
— ионы кальция, так как они участвуют во всех фазах гемокоагуляции;
— шероховатая поверхность сосудов (поражение сосудов атеросклерозом, сосудистые швы в хирургии), способствующая завихрениям крови и выпадению фибрина в сосудах;
— резкое замедление или остановка движения крови;
— механические воздействия (давление, раздробление тканей, встряхивание емкостей с кровью), которые приводят к разрушению форменных элементов крови и выходу из них факторов свертывания крови;
2) Факторы, замедляющие и предотвращающие гемокоагуляцию:
— понижение температуры тела животного;
— цитрат и оксалат натрия, которые связывают ионы кальция;
— гепарин, вызывающий подавление всех фаз гемокоагуляции;
— гладкая внутренняя поверхность сосудов (гладкие швы при сшивании сосудов, покрытие силиконом или парафинирование канюль и емкостей и др.).
Фибринолитическая система крови.
Она включает в себя плазминоген в совокупности с активаторами и ингибиторами. Плазминоген плазмы крови является неактивной формой фермента плазмина (фибринолизина), под влиянием которого осуществляется фибринолиз. Фибринолиз — это процесс ферментативного расщепления фибринового сгустка. Он начинается одновременно с ретракцией сгустка крови, но идет медленнее.
Плазминоген синтезируется в печени, костном мозге, почках. В активную форму он переходит под влиянием кровяных и тканевых активаторов. Высокоактивным тканевым активатором является урокиназа. Кровяные активаторы (в т.ч. фактор Хагемана) стимулируются адреналином, лизокиназами, то есть в случаях, когда повышается свертываемость крови (физические и психические нагрузки).
Кроме активаторов, в крови присутствуют ингибиторы (антиплазмины), которые блокируют или разрушают плазмин, а также антиактиваторы плазминогена, тормозящие его активацию.
В результате рассасывания мелких тромбов происходит восстановление просвета сосуда, в более крупных тромбах образуются каналы, по которым может восстановиться движение крови. Такое явление называется канализацией тромба.
Если отсутствуют условия для фибринолиза, то возможна организация тромба, т.е. замещение его соединительной тканью. Иногда тромб может отрываться от места своего образования и, циркулируя с кровью, может закупорить другой сосуд (эмболия).
Противосвертывающая система крови.
Наряду с веществами, способствующими свертыванию, в крови находятся вещества, препятствующие гемокоагуляции. Их называют естественными антикоагулянтами. Выделяют первичные и вторичные антикоагулянты.
Первичные антикоагулянты постоянно находятся в крови. К ним относят:
— антитромбопластины – они обладают антитромбопластиновым и антипротромбиназным действием;
— антитромбины – они связывают тромбин, кроме того, антитромбин III является плазменным кофактором гепарина;
— гепарин – образуя комплекс с антитромбином III, переводит его в антитромбин, который способен молниеносно связывать тромбин в крови, блокировать активацию IX, X, XI, XII факторов. Гепарин образуется в тучных клетках и базофильных лейкоцитах. Его особенно много в печени, легких, сердце и мышцах.
Вторичные антикоагулянты образуются в ответ на появление большого количества тромбина в процессе свертывания крови и фибринолиза. К этой группе относят антитромбин I (фибрин), который адсорбирует и инактивирует тромбин. Продукты деградации фибрина нарушают полимеризацию фибрин-мономера и блокируют его, угнетая агрегацию тромбоцитов.
Регуляция свертывания крови.
В процессе эволюции у организма выработалась одна реакция на все воздействия внешней среды – ускорение свертывания крови. Данный процесс имеет защитно-приспособительный характер.

Рисунок 6 — Форменные элементы крови в мазке:
1 – эритроцит;
2 – сегментоядерный нейтрофильный гранулоцит;
3 – палочкоядерный нейтрофильный гранулоцит;
4 – юный нейтрофильный гранулоцит;
5 – эозинофильный гранулоцит;
6 – базофильный гранулоцит;
7 – большой лимфоцит;
8 – средний лимфоцит;
9 – малый лимфоцит;
10 – моноцит;
11 – тромбоциты (кровяные пластинки)
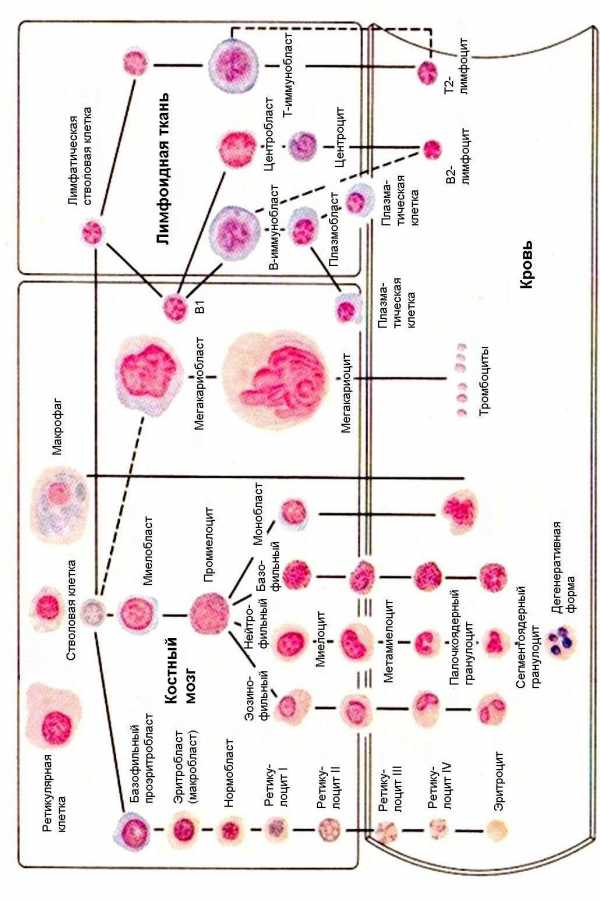
Рисунок 7 — Схема кроветворения
Он при угрозе травмы организма подготавливает его кровь к более быстрому образованию тромба.
Под влиянием сильных раздражителей происходит рефлекторный выброс в кровь из стенок сосудов большого количества факторов свертывания и повышение содержания тромбина.
Большую роль в ускорении образования тромба играет адреналин. При увеличении его концентрации в крови из стенок сосудов выделяется тромбопластин, быстро превращающийся в кровяную протромбиназу. Адреналин также активирует фактор Хагемана (XII). Влияние адреналина на тканевые липазы приводит к расщеплению жиров и, соответственно, повышению в крови уровня жирных кислот, которые обладают тромбопластической активностью.
Одновременно с ускорением свертывания крови повышается активность фибринолитической системы. Это предупреждает образование тромба, когда в этом нет необходимости, и способствует растворению уже образовавшегося фибрина.
Через некоторое время после ускорения свертывания крови наступает его замедление. Это явление вторично, так как оно обусловлено израсходованием факторов свертывающей системы. Например, во время продолжительных операций или родов может возникнуть реальная угроза потери кровью коагулирующих свойств.
В организме здоровых животных в условиях физиологического покоя мощность свертывающей и противосвертывающей систем находится в состоянии равновесия, что позволяет крови оставаться жидкой. В стрессовых ситуациях активность обеих систем возрастает и равновесие устанавливается на новом уровне.
Процессы свертывания крови регулируются нервной системой. Раздражение симпатической и парасимпатической нервных систем и, в том числе, их медиаторы ускоряют образование тромба. Поэтому, например, во время стрессовых ситуаций, болевых раздражений коагулирующие свойства крови повышаются. Ведущая роль в регуляции свертывания крови принадлежит центральной нервной системе и ее главному отделу — коре больших полушарий головного мозга.
studfile.net
СХЕМА СВЕРТЫВАНИЯ КРОВИ
Ранение
(кровь соприкасается с О2, вещества разрушенных тромбоцитов и клеток)
↓
Белок ТРОМБОПЛАСТИН поврежденной ткани
↓
ПРОТРОМБИН (белок плазмы)→→→ТРОМБИН (белок-фермент)
↑ ↑ ↓
Ферменты Са2+ ↓
↓
ФИБРИНОГЕН→ФИБРИН
↓
ТРОМБ
При отсутствии солей Са2+ и витамина К кровь не сворачивается.

Сыворотка крови – жидкая часть крови без форменных элементов и фибрина.
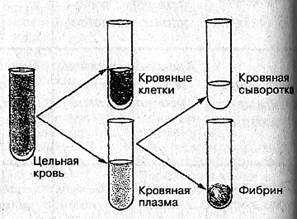
ГЕМОФИЛИЯ— болезнь несвертываемости крови, связанная с мутацией гена, сцепленного с Х (икс) хромосомой. Носители болезни ♀, болеют ♂.
Гемофилия А — дефицит VIII фактора свертывания крови;
Гемофилия В – дефицит IX фактора свертывания крови;
Гемофилия С — дефицит XI фактора свертывания крови
СОЭ — скорость оседания эритроцитов.
Метод Фарреуса :если кровь поместить в пробирку с делениями, добавив антикоагулянт (вещество препятствующее свертыванию), то через 1 ч. крови разделится на два слоя: верхний из плазмы; нижний из форменных элементов (в основном эритроцитов). Отмерив величину верхнего слоя определяют СОЭ, которое зависит от пола, возраста, здоровья.
Например:
- у новорожденных 1-2 мм/ч,
- у пожилых 15-20,
- у беременных 50;
- у♂2-10;
- у ♀ 2-15 мм/ч.
СОЭзависит от крупномолекулярных белков, концентрация которых возрастает при воспалении, инфекциях, беременности, что ведет к слипанию эритроцитов и их быстрому оседанию.
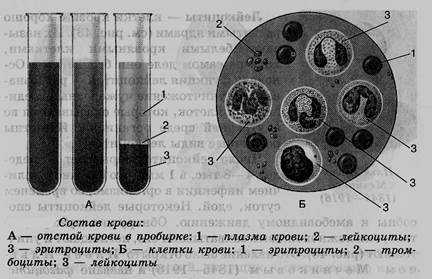
Эритроциты.
Это высокоспециализированные красные клетки крови, которые у млекопитающих и человека не имеют ядра.
Впервые обнаружены в крови лягушки в 1661г. Мальпиги, а в 1673г. Левенгуком у млекопитающих.
У человека эритроциты – двояковогнутые диски диаметром 7-8 мкм, что:
- увеличивает площадь поверхности и обеспечивает транспорт большого количества кислорода
- позволяет эритроциту закрепляться в фибриновой сети тромба
- позволяет проникать через узкие капилляры
Отсутствие ядра увеличивает поверхность газообмена и равномерность диффузии кислорода внутрь эритроцита.
Эритроциты окружены цитоплазматической мембраной, проницаемой для ионов натрия, калия, хлора, гидрокарбонат ионов, кислорода, углекислого газа. Она содержит информацию о группах крови и резус-факторе.
ЭРИТРОПОЭЗ, ГЕМОПОЭЗ или КРОВЕТВОРЕНИЕ — процесс образования эритроцитов. У младенцев кроветворная ткань во всех костях, у взрослых — в костях черепа, ребрах, грудине, позвонках, ключицах, лопатках. Эритроциты образуются в красном костном мозге, а разрушаются в селезенке и печени. Живут 120-130 суток.
В 1 мм3 крови у мужчин в норме содержится 5–5,5 млн., а у женщин – 4,5–5,5 млн. эритроцитов. Но эта величина меняется в зависимости от пола, возраста, здоровья.
Важнейшая особенность эритроцитов – присутствие в них гемоглобина (Нb) (у здоровых в крови 120-165 г/л).
ГЕМОГЛОБИН — дыхательный пигмент крови, состоящий из белка — глобина и небелковой части-4х молекул гема.
Нb = белок ГЛОБИН+ небелковая часть 4 молекулы ГЕМА (в составе гема 1 атом II валентного железа)
Оксигемоглобин— соединение кислорода с гемоглобином (это артериальная кровь. Она алая).
Артериальная кровь— кровь насыщенная кислородом.
Карбогемоглобин — соединение углекислого газа с гемоглобином (это венозная кровь. Она темнее артериальной).
Венозная кровь— кровь насыщенная углекислым газом.
Карбоксигемоглобин — соединение СО (угарного газа) с гемоглобином.
ТРАНСПОРТ О2:
- В ТКАНЯХ НbO8→ Hb + 4O2 (оксигемоглобин распадается)
- В ЛЕГКИХ Hb + 4O2→ НbO8 (образуется оксигемоглобин)
Гемолиз— разрушение оболочки эритроцита и выход гемоглобина в плазму.
ПРИЧИНЫ ГЕМОЛИЗА:
- биологический гемолизпод действием химических веществ – хлороформа, эфира, уксусной кислоты, яда змей
- механическийпри сильном встряхивании. Например: «маршевая гемоглобинурия»- травмирование эритроцитов в капиллярах стоп при длительной ходьбе.
- термическийпри размораживании и замораживании
- иммунныйпри переливании несовместимой крови
Каждую 1с. разрушается 2-10 млн. эритроцитов, что зависит от концентрации в атмосфере кислорода (чем ниже концентрация кислорода, тем больше образуется эритроцитов).
Эритропения — уменьшение числа эритроцитов (сопутствует АНЕМИИ).
Анемия — малокровие при кровопотере, недостаточной работе красного костного мозга, железа в крови.
Эритроцитоз— увеличение числа эритроцитов.
Функция эритроцитов:
1) транспортная, дыхательная, трофическая — т.к.переносят кислород, углекислый газ, аминокислоты, белки, ферменты, углеводы, жиры, гормоны, микроэлементы.
2) защитная — обеспечивают иммунитет.
3) регуляторная — с помощью гемоглобина регулирует рН крови, ионный состав плазмы, водный обмен.
Похожие статьи:
poznayka.org

