Лекция 16. Физиология тромбоцитов. Понятие о гемостазе (сосудисто-тромбоцитарный и коагуляционный гемостаз).
Тромбоциты – или кровяные пластинки – образуются из гигантских клеток красного костного мозга мегакариоцитов. Их диаметр колеблется в пределах от 2 до 4 мкм, а объем составляет около 6-9 мкм3.Имеют двуслойную мембрану, в них нет ядра, но много гранул. При встрече с чужеродной поверхностью тромбоциты активируются и распластываются, у них появляется много (до 10) отростков, в результате чего диаметр тромбоцитов возрастает в 5-10 раз. На мембране тромбоцитов находятся интегрины ( выполняющие роль рецепторов). Они принимают участие во взаимодействии тромбоцитов друг с другом и поврежденным сосудом. Они представляют собой гликопротеиды, которые экспрессируют (становятся доступными) для фибриногена, коллагена, фактор Виллебранда (ФВ) и других веществ.
В тромбоцитах содержится много гранул, в которых находится большое количество биологически активных веществ. Различают –
В норме количество тромбоцитов составляет 150 – 350 х 109/л. Увеличение числа тромбоцитов носит наименование тромбоцитоз. Он может быть физиологическим (при болевой реакции, стрессе, физической нагрузке) и патологическим (например, при заболеваниях селезенки, ее удалении). Уменьшение числа тромбоцитов называется тромбоцитопения. Как правило, тромбоцитопения является признаком патологии и наблюдается при лучевой болезни, врожденных и приобретенных заболеваниях крови. Однако у женщин в период менструаций число тромбоцитов может уменьшаться, хотя редко выходит за пределы нормы. Но, следует отметить, что даже при резкой тромбоцитопении, доходящей до 50 х 10 9, кровоточивости не бывает и врачебных вмешательств в подобных ситуациях не требуется. Только при достижении критических цифр – 25-30 х 109/л возникает легкая кровоточивость, требующая лечебных мероприятий. Это свидетельствует о том, что тромбоцитов в кровотоке находится в избытке.
У новорожденных количество тромбоцитов в среднем около 200 х 109/л (колебания от 100 до 400). К 7-10 дню жизни количество тромбоцитов почти такое же – 150-200 х 109/л, а к 14 дню и далее становится в пределах нормы взрослого человека.
Функции тромбоцитов – участие в процессе гемостаза (как сосудисто-тромбоцитарного, так и коагуляционного или свертывания крови). Кроме этого, тромбоциты выполняют ангиотрофическую функцию (роль «кормильца» сосудистой стенки, питая ее). При резкой тромбоцитопении трофика сосудистой стенки нарушается, что приводит к повышению ее проницаемости и снижению резистентности. Тромбоциты обладают
Регуляция тромбоцитопоэза – специфическая (тромбоцитопоэтины, интерлейкины –3,6,7,9,11,13) и неспецифическая (гормоны – АКТГ, адреналин; продукты питания – крапива,гриб-дождевик; возбуждение симпатического отдела вегетативной нервной системы).
Гемостаз – это комплекс реакций, направленных на остановку кровотечения. В действительности значение системы гемостаза намного сложнее и далеко выходит за рамки борьбы с кровотечением. Основными задачами гемостаза являются: сохранение жидкого состояния крови, регуляция транскапиллярного обмена, резистентности сосудистой стенки, влияние на интенсивность репаративных процессов и другие.
Принято различать сосудисто-тромбоцитарный гемостаз и процесс свертывания крови. В первом случае речь идет об остановке кровотечения из мелких кровеносных сосудов с низким кровяным давлением, во втором – о борьбе с кровопотерей при повреждении артерий и вен. Такое деление носит условный характер, ибо как при повреждении мелких, так и крупных сосудов всегда наряду с образованием тромбоцитарной пробки осуществляется и свертывание крови. Вместе с тем, подобное разделение очень удобно для клиники, ибо при нарушениях сосудисто-тромбоцитарного гемостаза прокол кожи пальца (или мочки уха) сопровождается длительным кровотечением, тогда как время свертывания крови остается в норме. При патологии свертывания крови время кровотечения при проколе пальца значительно не меняется, хотя образование фибринового сгустка может не наступать часами (например, при гемофилии).
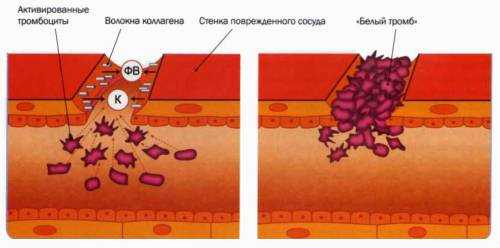
Сосудисто-тромбоцитарный гемостаз
В условиях нормы остановка кровотечения из мелких сосудов занимает от 2-х до 4-х минут. Этот показатель в клинике именуется как время кровотечения.
Чрезвычайно важную роль в регуляции сосудисто-тромбоцитарного гемостаза играют производные арахидоновой кислоты – простациклин и тромбоксан А2. Простациклин образуется эндотелиальными клетками под влиянием фермента простациклинсинтетазы. В физиологических условиях простациклин преобладает над тромбоксаном – мощным агрегирующим агентом тромбоцитов. При повреждении эндотелия в месте травмы образование простациклина нарушается и начинает преобладать действие тромбоксана, и создаются благоприятные условия для агрегации тромбоцитов. Некоторые витамины (А, С, Е) и продукты питания (лук, чеснок) являются ингибиторами агрегации тромбоцитов.
У здоровых доношенных новорожденных отмечается сравнительно низкая адгезия тромбоцитов, а также менее выраженная агрегация. Время кровотечения у детей независимо от возраста остается в пределах нормы взрослых.
Свертывание крови – это ферментативный процесс, в котором принимают участие как плазменные, так и клеточные факторы. Большинство факторов свертывания крови, находящихся в плазме, являются проферментами, их активация происходит за счет протеолиза и сопровождается отщеплением пептидных ингибиторов. Для обозначения этого процесса к номеру фактора (плазменные факторы обозначаются римскими цифрами) присоединяется буква «а» (активный).
I , фибриноген – белок, образуется в печени, в процессе свертывания крови переходит в фибрин. Фибриноген необходим также, для агрегации тромбоцитов, репарации тканей. В норме его содержание в крови 2-4 г/л. Минимальный уровень – 0,8 г/л. Встречается гипо- и гиперфибриногенемия.
II, протромбин – гликопротеин, образуется в печени в присутствии витамина К. Под влиянием протромбиназы переходит в тромбин. В норме – 0,1-0,15 г/л. Минимальный уровень – 40%. Различают гипо и гиперпротромбинемию.
III, тромбопластин – состоит из белка апопротеина III и комплекса фосфолипидов. Входит в состав мембран многих тканей. Является матрицой для образования протромбиназы по внешнему пути.
IV, ионы кальция – необходим для образования протромбиназы, агрегации тромбоцитов, реакциях высвобождения и ретракции. В норме – 0,03-0,04 г/л. Процесс свертывания крови остается нормальным при снижении его уровня до развития судорог.
V, акцелератор- глобулин – белок, образуется в печени, активируется тромбином, входит в состав протромбиназного комплекса. В норме до 0,01 г/л. Минимальный уровень – 10-15%. При его отсутствии возникает заболевание – болезнь Оврена или парагемофилия.
VII, проконвертин – гликопротеин, для его образования нужен витамин К, образуется в печени. Принимает участие в формировании протромбиназвы по внешнему пути. В норме около 0,005 г/л, минимальный уровень – 5-10%. При его отсутствии возникает болезнь Александера или парагемофилия.
VIII, антигемофильный глобулин (АГГ) – гликопротеин, образуется в печени, селезенке, сосудистой стенке. Он необходим для образования протромбиназы по внутреннему пути. В плазме образует комплекс с ФВ. В норме – 0,01-0,02 г/л. Минимальный уровень – 30-35%. При его отсутствии или резком снижении концентрации возникает заболевание гемофилия А.
IX, фактор Кристмасса, антигемофильный фактор В – гликопротеин, образуется в печени при участии витамина К, принимает участие в образовании протромбиназы по внутреннему пути. В норме – 0,003 г/л. Минимальный уровень – 20-30%. При его отсутствии или резком снижении концентрации возникает заболевание гемофилия В.
Х, фактор Стюарт — Прауэра – гликопротеин, он образуется в печени, при участии витамина К. Является основной частью протромбиназного комплекса. В норме – 0,01 г/л. Минимальный уровень – 10-20%.
XI, плазменный предшественник тромбопластина – гликопротеин, образуется в печени, принимает участие в образовании протромбиназы по внутреннему пути. В норме – 0,005 г/л. При его отсутствии развивается болезнь Розенталя.
XII, фактор Хагемана или контакта – белок, активируется отрицательно заряженной поверхностью, адреналином, калликреином. Запускает внешний и внутренний механизм образования протромбиназы и фибринолиза. В норме – 0,03 г/л. Кровотечение не возникает даже при дефиците этого фактора до 1%.
XIII, фибринстабилизирующий фактор (ФСФ), фибриназа – глобулин, синтезируется фибробластами, мегакариоцитами, стабилизирует фибрин. Он необходим для нормального течения репаративных процессов. В норме 0,01-0,02 г/л. Минимальный уровень – 2-5%.
Фактор Флетчера (прекалликреин) – белок, принимает участие в активации XII фактора, плазминогена и высокомолекулярного кининогена (ВМК). В норме – 0,05 г/л. Минимальный уровень – 1%.
Фактор Фитцджеральда, ВМК — активируется калликреином, принимает участие в активации XII,XI факторов и фибринолиза. В норме – 0,06 г/л. Минимальный уровень – 1%.
Важная роль в процессе свертывания крови принадлежит тромбоцитам. Они содержат много (более 30) различных веществ, которые имеют отношение к процессу гемостаза. Некоторые из них (по разным литературным источникам от 5 до 15) так и называют тромбоцитарные факторы свертывания крови, которые обозначаются арабскими цифрами. О наиболее важных из них мы уже упоминали выше. Это фосфолипид тромбоцитов является субстратом для образования протромбиназы по внутреннему пути. Тромбостенин принимает участие в ретракции, не только тромбоцитарного тромба, но и кровяного (фибринового) сгустка.
В эритроцитах обнаружен ряд соединений, аналогичных тромбоцитарным факторам. Они получили название эритроцитарных факторов свертывания крови. Они не имеют цифрового обозначения. Наиболее важным из них является фосфолипидный фактор (напоминает такой же фактор тромбоцитов и является частичным тромбопластином). Особенно велика роль эритроцитов в свертывании крови при массовом их разрушении, что наблюдается при переливании крови, резус-конфликте матери и плода и гемолитических состояниях.
Лейкоциты содержат факторы свертывания, получившие название лейкоцитарные. В частности, моноциты и макрофаги при стимуляции антигеном синтезируют белковую часть тромбопластина – апопротеин III (тканевой фактор).
Важная роль в процессе свертывания крови отводится тканевым факторам, к которым, в первую очередь, относится тромбопластин. Тромбопластин или тканевой фактор состоит из белковой части – апопротеина III и комплекса фосфолипидов и нередко представляет собой отломок клеточных мембран. При разрушении тканей или стимуляции эндотелия провоспалительными цитокинами или эндотоксином тканевой фактор способен поступать в кровоток. В различных регионах кровообращения в сосудах его содержание неодинаково (например, в венах и артериях, нижних или верхних конечностей, справа или слева у одноименных сосудов).
После того как мы рассмотрели основные факторы свертывания крови, можно перейти к характеристике в целом всего процесса. Процесс свертывания крови может быть разделен на 3 фазы. Первая включает в себя комплекс последовательных реакций, приводящих к образованию протромбиназы. Образование протромбиназы может осуществляться по внешнему и внутреннему пути. Внешний путь образования протромбиназы предполагает обязательное присутствие тромбопластина (или фактора III, тканевого фактора). Формирование протромбиназы по внешнему пути начинается с активации фактора VII при его взаимодействии с тромбопластином. В свою очередь фактор VIIa переводит фактор Х в активное состояние. В последующем Ха активирует фактор V. Факторы III+ IV + Xa +Va образуют комплексное соединение, получившее название протромбиназы. По внешнему пути протромбиназа образуется очень быстро (занимает секунды!).
Инициатором внутреннего пути образования протромбиназы является фактор XII. В этой реакции принимает участие калликреин и ВМК. Фактор контакта активируется травмированной поверхностью, кожей, коллагеном, адреналином и переводит фактор XI в активное состояние. XIa оказывает непосредственное влияние на фактор IX, переводя его в фактор IXa. Специфическая деятельность последнего направлена на протеолиз фактора Х (переводя его в активный) и протекает на поверхности фосфолипидов тромбоцитов при обязательном участии фактора VIII. Весь комплекс факторов на фосфолипидной поверхности тромбоцитов получил наименование теназы (теназного комплекса). В процессе свертывания крови, как уже отмечалось выше, принимают участие прекалликреин и ВМК, благодаря которым происходит объединение внешнего и внутреннего путей. Внутренний путь более продолжителен по времени (до 5-6 минут), так как осуществляется с участием большого количества различных факторов свертывания крови. Он осуществляется и без повреждения сосудистой стенки (например, при увеличении в крови концентрации адреналина, активирующего фактор XII).
Вторая фаза свертывания крови – это переход протромбина в тромбин, который осуществляется протромбиназой и сводится к протеолитическому расщеплению протромбина, благодаря чему появляется фермент тромбин, обладающий свертывающей активностью. Происходит это очень быстро (всего за несколько секунд).
Третья фаза свертывания крови – это переход фибриногена в фибрин. Вначале под влиянием тромбина от фибриногена отщепляются два фибринопептида А и два фибринопептида В. В результате этого образуется фибрин-мономер. В дальнейшем, благодаря полимеризации образуется легко или быстрорастворимый фибрин. Но вследствии активации XIII фактора происходит его переход в труднорастворимый фибрин или фибрин-полимер. Образовавшийся фибриновый сгусток, благодаря тромбоцитам, входящим в его структуру, сокращается (уплотняется) – наступает ретракция фибринового сгустка. Вследствие этого сгусток прочно закупоривает поврежденный сосуд и, кровотечение из него прекращается.
У новорожденного наблюдается физиологическое снижение уровня факторов свертывания II,VII, IX, X, XI, XII, XIII. Концентрация же факторов V и VIII у доношенных новорожденных соответствует цифрам, характерным для взрослых. У недоношенных детей наблюдается более выраженное снижение этих факторов. На показатели системы гемостаза оказывают влияние сроки перевязки пуповины и время первого прикладывания ребенка к груди. Надо не торопиться с первым и как можно раньше осуществлять второе. На 3-й день после рождения ребенка содержание прокоагулянтов падает, что приводит к замедлению свертывания крови. В дальнейшем концентрация факторов свертывания крови начинает нарастать и 14 дню практически нормализоваться до уровня взрослых.
studfile.net
— тромбоцитарный гемостаз — Биохимия
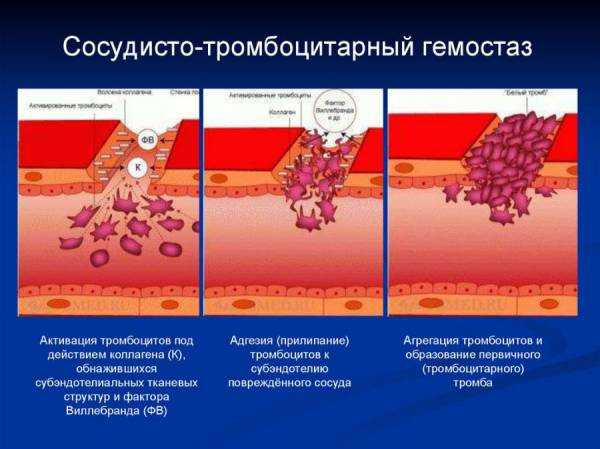
В кровотоке постоянно содержится от 20 до 40% активированных «дежурных» тромбоцитов, готовых при появлении молекул адгезии моментально начать процесс свертывания крови. В процессе тромбоцитарно-сосудистого взаимодействия различают стадии адгезии тромбоцитов, их активации и агрегации.
Адгезия
При повреждении стенки сосуда обнажается коллаген базальной мемраны и создается чужеродная «тромбогенная» контактная поверхность, одновременно из активированного эндотелия высвобождаются белки адгезии, в первую очередь фактор Виллебранда. Контактная поверхность адгезирует тромбоциты и запускает процесс свертывания.
Процесс адгезии заключается в прикреплении тромбоцитов, оказавшихся в зоне повреждения, к субэндотелиальным структурам. При этом происходит прямой контакт тромбоцитов и коллагена базальной мембраны через тромбоцитарные рецепторы GPIa/IIa. Одновременно выделенный из поврежденных эндотелиоцитов ф.Виллебранда связывается одной своей частью с тромбоцитарным рецептором GPIb, а другой – с коллагеном субэндотелия.
Адгезия тромбоцитов
После прикрепления к поврежденной поверхности тромбоциты активируются.
Активация
Адгезия тромбоцитов к коллагену (рецепторы GPIa/IIa) и взаимодействие с фактором Виллебранда (рецептор GPIb) приводит к их активации.
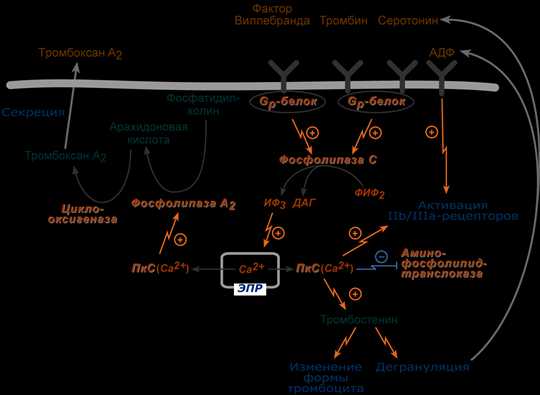
Связывание фактора Виллебранда с рецептором GPIb запускает фосфолипид-кальциевый механизм передачи сигнала, что, в конце концов, приводит к повышению внутриклеточной концентрации ионов Cа2+ и активации протеинкиназы С. В результате:
- ингибируется АТФ-зависимая аминофосфолипид-транслоказа, поддерживающая мембранную асимметрию фосфолипидов, и в результате на наружной поверхности мембраны появляется отрицательно заряженный фосфатидилсерин.
- вместе с фосфатидилсерином на поверхность выходит особый гликопротеин (тканевой фактор), формируется комплекс тканевого фактора. Мембрана становится поверхностью для взаимодействия плазменных факторов свертывания, которая также называется тромбоцитарный тромбопластин.
- происходит сокращение белка тромбостенина, в результате происходит дегрануляция и наружу высвобождаются факторы, активирующие адгезию и агрегацию,
- изменяется форма тромбоцита, появляются псевдоподии, и он распластывается на контактной поверхности,
Процессы, происходящие при активации тромбоцита
- происходит активация фосфолипазы А2, которая от фосфатидилхолина мембраны отщепляет полиненасыщенную (например, арахидоновую) кислоту и из нее синтезируется тромбоксан А (например, тромбоксан А2) – сильный индуктор агрегации тромбоцитов и вазоконстриктор. Тромбоксан противодействует влиянию простациклинов, препятствуя активации аденилатциклазы и прерывая эффекты простациклинов.
Антагонизм действия простациклинов и тромбоксанов
Тромбоксан далее ускоряет высвобождение активных веществ (протромбина, PAF, АДФ, ионов Ca2+, серотонина, тромбоксана А и др.) из активированного тромбоцита, что поддерживает и усиливает активацию этого и соседних тромбоцитов. Активация усиливается также под действием АДФ, выделяющейся из поврежденных эритроцитов и эндотелиоцитов сосудистой стенки.
Уже активированные тромбоциты имеют на своей поверхности рецепторы для активных и неактивных факторов V, VIII, IX, X, XI, протромбина и тромбина.
Агрегация
Процесс агрегации заключается в стабилизации тромба фибрином и в слипании активированных тромбоцитов друг с другом.
Любой пусковой сигнал приводит в активированном тромбоците к конформационным изменениям рецептора GPIIb/IIIa, который перемещается на мембрану. После связывания с этим рецептором фибриноген действует как мостик между прилегающими тромбоцитами и в зоне повреждения образуется тромбоцитарный тромб, армированный фибриногеном. Поначалу связь между тромбоцитами еще не прочна и такая агрегация является обратимой. Активация и агрегация поддерживается непрерывной секрецией содержимого гранул из связывающихся тромбоцитов.
Продолжающаяся дегрануляция тромбоцитов и секреция ими простагландинов (PgG2 и Pgh3), тромбоксана А2, АДФ, превращение фибриногена в фибрин (катализируемое тромбином) делают агрегацию необратимой. Такой тромбоцит прочно связан с другими клетками, он потерял содержимое гранул и не может вернуться в исходное состояние.
Агрегация тромбоцитов
Ретракция
Ретракция – это уплотнение сгустка крови с выделением из него избытка сыворотки. Стимулом для ретракции являются различные вещества, выделяемые тромбоцитом на этапах активации и агрегации. Ретракция осуществляется благодаря тому, что к внутриклеточной части рецепторов GPIIb/IIIa присоединен сократительный белок тромбостенин (подобен актомиозину мышечных волокон), который при накоплении в цитозоле ионов Ca2+ сокращается и сжимает сгусток.
Сжатие сгустка обусловливает повышение давления внутри тромбоцита и вызывает дополнительный выброс веществ из его гранул, что еще более усиливает ретракцию и окончательно уплотняет тромб. В норме кровотечение из мелких сосудов продолжается не более 5 минут.
biokhimija.ru
Сосудисто — тромбоцитарный гемостаз
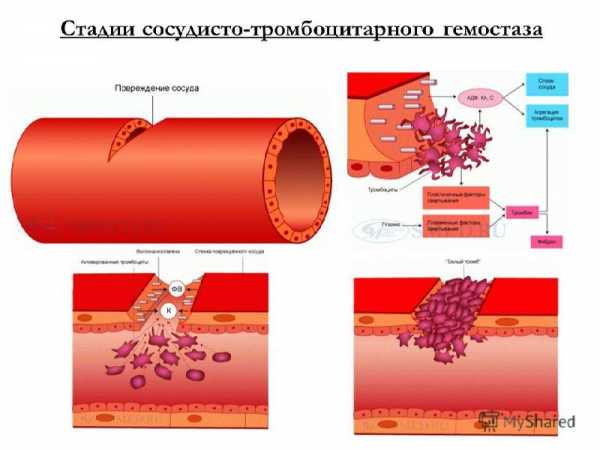
Этот механизм способен самостоятельно прекратить кровотечение из наиболее часто травмируемых микроциркуляторных сосудов с низким артериальным давлением. Он складывается из ряда последовательных процессов:
| 1.Рефлекторный спазм поврежденных сосудов. | Эта реакция обеспечивается сосудосуживающими веществами, освобождающимися из тромбоцитов (серотонин, адреналин, норадреналин). Спазм приводит лишь к временной остановке или уменьшению кровотечения. |
| 2. Адгезия тромбоцитов (приклеивание) к месту травмы. | Данная реакция связана с изменением отрицательного электрического заряда стенки сосуда в месте повреждения на положительный. Отрицательно заряженные тромбоциты прилипают к обнажившимся волокнам коллагена базальной мембраны. Адгезия тромбоцитов обычно завершается за 3-10 секунд. |
| 3. Обратимая агрегация (скучивание) тромбоцитов | Она начинается почти одновременно с адгезией. Главным стимулятором этого процесса являются «внешняя» АДФ, выделяющаяся их поврежденного сосуда, и «внутренняя» АДФ, освобождающаяся из тромбоцитов и эритроцитов. Образуется рыхлая тромбоцитарная пробка, которая пропускает через себя плазму крови. |
| 4. Необратимая агрегация тромбоцитов (при которой тромбоцитарная пробка становиться непроницаемой для крови). | Эта реакция возникает под влиянием тромбина, изменяющего структуру тромбоцитов («вязкий метаморфоз» кровяных пластинок). Следы тромбина образуются под влиянием тканевой тромбиназы, которая появляется через 5-10 сек. после повреждения сосуда. Тромбоциты теряют свою структурность и сливаются в гомогенную массу. Тромбин разрушает мембрану тромбоцитов, и их содержимое освобождается в кровь. При этом выделяются все пластиночные факторы и новые количества АДФ, увеличивающие размеры тромбоцитарного тромба. Освобождение фактора 3 дает начало образованию тромбоцитарной протромбиназы, включению механизма коагуляционного гемостаза. На агрегатах тромбоцитов образуется небольшое количество нитей фибрина, в сетях которого задерживаются эритроциты и лейкоциты. |
| 5. Ретракция тромбоцитарного тромба — его уплотнение и закрепление в поврежденных сосудах за счет сокращения тромбостенина. | В результате образования тромбоцитарной пробки кровотечение из микроциркуляторных сосудов, чаще всего повреждаемых при бытовых травмах (ссадины, порезы кожи), останавливается за несколько минут. |
24. Гемокоагуляционный гемостаз, его фазы. Первая фаза свертывания крови. Вторая и третья фазы свертывания крови:
Сосудисто-тромбоцитарные реакции обеспечивают гемостаз лишь в микроциркуляторных сосудах с низким кровяным давлением. Они же начинают гемостаз и в крупных сосудах, однако тромбоцитарные тромбы не выдерживают высокого давления и вымываются. В таких сосудах гемостаз может быть достигнут путем образования фибринового тромба, представляющего собой более прочную пробку. Его образование осуществляется ферментативным коагуляционным механизмом, протекающим в 3 фазы.
Коагуляционный гемостаз (схема)
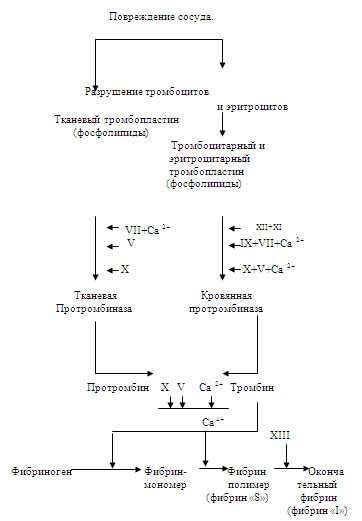
Фаза 1. Самой сложной и продолжительной фазой является формирование протромбиназы. В этом процессе различают внешнюю (тканевую) и внутреннюю (кровяную) систему. Внешний путь запускается тканевым тромбопластином, который выделяется из стенок поврежденного сосуда и окружающих тканей. Во внутренней системе фосфолипиды и другие факторы поставляются самой кровью. В 1 фазу образуются тканевая, тромбоцитарная и эритроцитарная протромбиназы. Последние две части называют кровяной протромбиназой. Образование тканевой протромбиназы длиться 5-10 секунд, а кровяной — 5-10 мин.
Толчком для образования тканевой протромбиназы служит повреждение стенок сосудов с выделением из них в кровь тканевого тромбопластина (фосфолипидов), представляющего собой фрагменты (осколки) клеточных мембран. Наряду с ними обнажаются торцевые ткани мембран поврежденных клеток с регулярной структурой двойного слоя фосфолипидов. Как видно из схемы, в формировании тканевой протромбиназы участвуют плазменные факторы V,VII, X и кальций.
Образование тканевой протромбиназы в большинстве тканей является лишь запалом или пусковым механизмом для последующих реакций, протекающих с меньшей скоростью. Тканевая протромбиназа приводит к образованию небольших количеств тромбина, которые достаточны лишь для агрегации тромбоцитов с освобождением их пластиночных факторов, а также для активации факторов V и VIII.
Кровяная протромбиназа образуется намного медленнее. Это связано с тем, что фосфолипиды находятся в клетках крови и требуется их предварительное разрушение. Как правило, в месте травмы сосудов разрушается небольшое количество эритроцитов. Из тромбоцитов фосфолипиды освобождаются только после вязкого метаморфоза, вызываемого тромбином.
Инициаторы образования кровяной протромбиназы не осколки мембран клеток крови, а обнажающиеся при повреждении сосуда волокна коллагена. Начальной реакцией является активация фактора Хагемана при контакте с данными волокнами. После этого он с помощью активированного им калликреина и кинина активируют фактор XI, образуя с ним комплекс — продукт контактной активации. К этому времени происходит разрушение эритроцитов и тромбоцитов, на фосфолипидах которых завершается образование комплекса факторXII + факторXI. Эта реакция самая продолжительная, на нее уходит 5-7 мин из 5-10 мин всего времени свертывания крови.
Дальнейшие реакции образования кровяной протромбиназы протекают на матрице фосфолипидов. Под влиянием фактора XI активируется фактор IX, который реагирует с фактором VIII и ионами Са 2+, образуя кальциевый комплекс. Он адсорбируется на фосфолипидах и после этого активируется фактор Х на матрице фосфолипидов и образует последний комплекс фактор Х+факторV+кальций завершает образование кровяной протромбиназы. Главной ее частью служит активный фактор Х.
Фаза II. Появление протромбиназы знаменует начало II фазы свертывания крови — образование тромбина. По сравнению с I фазой этот процесс протекает практически мгновенно — за 2-5 сек. Такая скорость обусловлена тем, что протромбиназа адсорбирует протромбин и на своей поверхности превращает его в тромбин. Этот процесс протекает при участии факторов V, X и Ca 2+ .
Фаза III. В III фазе происходит превращение фибриногена в фибрин. Этот процесс протекает в три этапа. На 1-м этапе под влиянием тромбина из фибриногена образуется золеобразный фибрин-мономер. На 2-м этапе под влиянием ионов Ca 2+ наступает полимеризация фибрин-мономеров и образуется фибрин-полимер (растворимый фибрин «S»). На 3-м этапе при участии фактора XIII нерастворимый фибрин «I». Фибриназа образует прочные пептидные связи между соседними молекулами фибрин-полимера, что цементирует фибрин, увеличивает его механическую прочность и устойчивость к фибринолизу. Образование фибрина завершает образование кровяного тромба.
Таким образом, свертывание крови представляет собой цепной ферментативный процесс, в котором на матрице фосфолипидов последовательно активируются факторы свертывания и образуются их комплексы. Фосфолипиды клеточных мембран выступают как катализаторы взаимодействия и активации факторов свертывания, ускоряя течение процесса гемокоагуляции.
25. Фибринолиз, его значение и маханизмы. Ретракция кровяного сгустка:
Фибринолиз.
После образования фибринового сгустка начинается послефаза свертывания крови, включающая два процесса — ретракцию и фибринолиз.
Ретракция обеспечивает уплотнение и закрепление тромба в поврежденном сосуде. Она осуществляется лишь при достаточном количестве тромбоцитов за счет их сократительного белка тромбостенина. При своем сокращении он сжимает сгусток до 25-50% первоначального объема, что закрепляет его в сосуде более надежно. Ретракция заканчивается в течение 2-3 ч после образования сгустка.
Одновременно с ретракцией, но с меньшей скоростью начинается фибринолиз — расщепление фибрина, составляющего основу тромба. Главная функция фибринолиза — восстановление просвета (реканализация) закупоренного сгустком сосуда.
Расщепление фибрина осуществляется протеолитическим ферментом плазмином, который находится в плазме в виде профермента плазминогена. Для его превращения в плазмин требуются активаторы, содержащиеся в крови и тканях. Таким образом, система фибринолиза, как и система свертывания крови, имеет внутренний и внешний механизмы активации. Внутренний механизм осуществляется ферментами самой крови, а внешний — тканевыми активаторами.
В плазме крови находится кровяной проактиватор плазминогена, требующий активации, осуществляемой кровяной лизокиназой, которой является фактор Хагемана. Активация происходит не только в месте повреждения сосуда, но и в кровотоке под влиянием адреналина. В крови находятся и другие стимуляторы фибринолиза: урокиназа (фермент, вырабатываемый почками), трипсин, кислая и щелочная фосфатазы, калликреинкининовая система и комплемент С1.
Основными регуляторами фибринолиза служат сами ткани, особенно стенки сосудов. Они содержат тканевые лизокиназы, поступающие в кровь и превращающие кровяной проактиватор в активатор. В тканях найдены также активаторы фибринолиза, которые действуют прямо на плазминоген, превращая его в плазмин. Такой путь активации называют прямым. Часть тканевых активаторов неспособна выделяться в кровь и действует локально, обеспечивая фибринолиз в тканях. Другая часть тканевых активаторов водорастворима и поступает в кровь. Особенно много тканевых лизокиназ и активаторов сосредоточено в микроциркуляторных сосудах, где они синтезируются и депонируются.
В каждой фазе фибринолитического процесса имеются свои ингибиторы: антилизокиназы, антиактиваторы, антиплазмины.
Схема 2. Фибринолиз
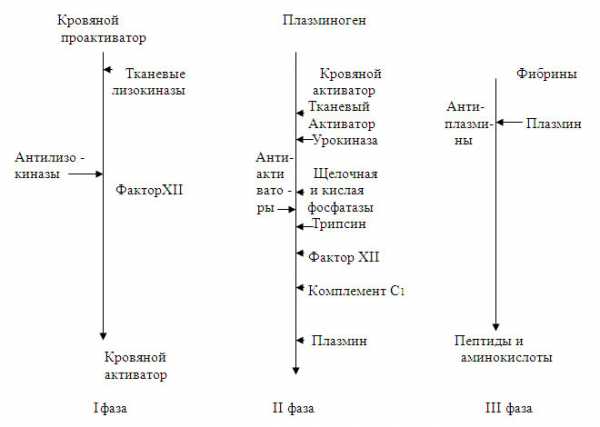
Как видно из схемы 2, фибринолиз протекает в 3 фазы. В 1 фазу образуется кровяной активатор плазминогена, во II фазу он и другие стимуляторы превращают плазминоген в плазмин и в III фазу плазмин расщепляет фибрин до пептидов и аминокислот. Эффективность фибринолиза определяется тем, что при свертывании крови фибрин адсорбирует плазминоген, который превращается в плазмин в сгустке.
Естественным стимулятором фибринолиза является внутрисосудистое свертывание крови или ускорение этого процесса. У здоровых людей активация фибринолиза всегда происходит вторично — в ответ на усиление гемокоагуляции.
По некоторым данным, кроме ферментативного фибринализа, в организме имеется неферментативный фибринолиз. Он осуществляется комплексами гепарина с адреналином, фибриногеном, фибриназой, антиплазминами и др., которые тормозят свертывание крови и лизируют растворимые предстадии фибрина. Угнетение этой системы фибринолиза повышает риск внутрисосудистого свертывания и тромбообразования
26. Противосвертывающие механизмы:
Циркулирующая кровь имеет все необходимое для свертывания, однако остается жидкой. Сохранение жидкого состояния крови — главная функция системы гемокоагуляции. Свертывание крови представляет вторичное, защитное приспособление, включающееся при повреждении сосуда. Система гемокоакуляции в естественных условиях поддерживает жидкое состояние крови и оптимальное состояние стенок сосудов.
Жидкое состояние крови сохраняется за счет многих механизмов:
1) свертыванию крови препятствует гладкая поверхность эндотелия сосудов, что предотвращает активацию фактора Хагемана и агрегацию тромбоцитов;
2) стенки сосудов и форменные элементы крови имеют отрицательные заряды, что отталкивает клетки крови от сосудистых стенок;
3) стенки сосудов покрыты тонким слоем растворимого фибрина, адсорбирующим активные факторы свертывания, особенно тромбин;
4) свертыванию мешает большая скорость тока крови, что не позволяет факторам гемокоагуляции достигнуть нужной концентрации в одном месте;
5) жидкое состояние крови поддерживается имеющимися в ней естественными антикоагулянтами.
И.П. Павлов еще в 1887 г. обратил внимание на то, что кровь, оттекающая от легких, свертывается медленнее, чем притекающая. Это он объяснил поступлением в кровь из легких веществ, тормозящих гемокоагуляцию.
Имеющиеся в организме антикоагулянты делят на две группы:
1) предшествующие (первичные)
2) образующиеся в процессе свертывания крови и фибринолиза (вторичные).
В первую группу входит несколько антитромбопластинов, тормозящих образование и действие протромбиназы. Самым мощным из них является антитромбин III. При врожденном дефиците антитромбина III развиваются тяжелые тромбоэмболические явления. Вторым по мощности среди первичных антикоагулянтов является a2-макроглобулин (или антитромбин IV).
Очень активным первичным антикоагулянтом является гепарин, продуцируемый базофилами и тучными клетками соединительной ткани. Количество базофилов мало, зато все тучные клетки организма имеют массу 1,5 кг. Гепарин тормозит все фазы гемокоагуляции, подавляет активность многих плазменных факторов и динамические превращения тромбоцитов, в малых дозах стимулирует фибринолиз. Наряду с действием на гемокоакуляцию, гепарин подавляет активность гиалуронидазы, уменьшает проницаемость стенки сосудов, ингибирует реакцию антиген — антитело, обладает противоболевым и противовоспалительным эффектом. Эти свойства послужили основанием для широкого применения гепарина в клинике.
Вторичные антикоагулянты представляют собой «отработанные» факторы свертывания. Так, образовавшийся фибрин адсорбирует и нейтрализует до 90% тромбина, поэтому фибрин называют антитромбином 1.
Пептиды, отщепляемые от фибриногена тромбином, обладают антикоагулянтными свойствами. Фактор XI после взаимодействия с факторами XII и IX начинает тормозить активность фактора XII. Мощные антикоагулянты образуются при фибринолизе. Они тормозят действие тромбина, нарушают агрегацию тромбоцитов, образуют несвертывающиеся комплексы с фибриногеном и фибрин-мономером. Эти факты говорят о том, что на всех этапах гемокоагуляции действуют силы самоограничения процесса.
В состоянии покоя содержание антикоагулянтов невелико, но оно резко возрастает в ответ на ускорение свертывания крови.
27. Причины несвертываемости крови в сосудистом русле:
Афибриногенемия — это отсутствие в крови фибриногена; снижение его содержания в крови — фибриногенопения (гипофибриногенемия).
При афибриногенемии свертывания крови не происходит, при фибриногенопении оно замедлено, образуется рыхлый или крошковатый сгусток.Свертывание крови прекращается при содержании в плазме менее 60 мг% фибриногена (в норме содержание фибриногена в плазме составляет 300— 500 мг%).
Афибриногенемия бывает врожденной (крайне редко) и приобретенной. При врожденной афибриногенемии любая травма у ребенка приводит к кровотечению, а с началом ходьбы появляются экхимозы, гематомы, кровоизлияния в полость сустава. Диагноз афибриногенемия ставится при обнаружении полной несвертываемости крови и отсутствии фибриногена в плазме при нормальных результатах других проб геморрагического синдрома (отрицательный симптом жгута, время кровотечения и ретракция сгустка нормальные, количество тромбоцитов и протромбиновый индекс не изменены). Дети с врожденной афибриногенемией редко доживают до зрелого возраста.
Приобретенная афибриногенемия может зависеть как от недостаточного образования фибриногена при поражении органов, где он вырабатывается (печень, легкие, костный мозг), так и от повышенного его растворения — фибринолиза. В первом случае чаще имеет место фибриногенопения, которая проявляется экхимозами, образованием гематом при малейшей травме, гематурией. Свертывание крови наступает, но через несколько минут или часов кровь снова становится жидкой. Такая картина наблюдается при циррозах печени и остром некрозе ее, при раке предстательной или поджелудочной железы с метастазами в костный мозг, при острых лейкозах. В менее выраженной форме фибриногенопения отмечается иногда при полиглобулии, панцитопении, хроническом миелолейкозе. В этих случаях образовавшийся сгусток крови не растворяется, но легко крошится.
28. Регуляция свертывания крови и фибринолиза. Контуры регуляции, ведущие причины гиперкоагуляции. Механизмы стимуляции фибринолиза:
Еще в начале прошлого векаВ.Кеннон отметил, что при болевом раздражении, эмоциях страха и гнева, т.е. состояниях протекающих с возбуждением симпатического отдела вегетативной нервной системы и гиперадреналинемией, свертывание крови ускоряется. Это наблюдается при всех стрессорных воздействиях, ускоряющих гемокоагуляцию на 25-50% и более — с 5-10 мин до 3-4 мин. Совершенно ясно, что такое укорочение времени свертывания может быть достигнуто лишь за счет самой продолжительной фазы гемокоакуляции — образования протромбиназы.
Ускорение свертывания крови называют гиперкоагулемией, а замедление — гипокоагулемией.
Развитие гиперкоагулемии при активации симпатического отдела вегетативной нервной системы и стрессовых реакциях обусловлено действием адреналина и норадреналина. Ведущей причиной гиперкоагуляции является то, что адреналин освобождает из стенок сосудов тромбопластин, который в кровотоке быстро превращается в тканевую протромбиназу. Под влиянием адреналина из стенок сосуда выделяются также естественные антикоагулянты и активаторы фибринолиза, но определяющим является действие более мощного тромбопластина. Сейчас сосуды считают главным эффектором в регуляции свертывания крови. Эту же задачу выполняют почки и желудочно-кишечный тракт, выводящие из организма избыток прокоагулянтов.
Вторая причина гиперкоагулемии связана с тем, что адреналин прямо в кровотоке активирует фактор Хагемана, являющийся инициатором образования кровяной протромбиназы.
Адреналин активирует тканевые липазы, что усиливает расщепление жиров и приводит к поступлению в кровь жирных кислот, обладающих тромбопластической активностью.
Адреналин усиливает «эффект отдачи» — освобождение фосфолипидов из форменных элементов крови, особенно из эритроцитов.
Гиперкоагулемия достигается за счет расходования факторов свертывания, поэтому после прекращения действия раздражителя на организм она сменяется вторичной гипокоагулемией. Развитие гиперкоагулемии подготавливает организм к более быстрому образованию сгустка при угрозе травмы или других повреждений.
Раздражение блуждающего нерва (или внутривенное введение ацетилхолина) приводит к выделению из стенок сосудов веществ, аналогичных тем, которые выделяются при действии адреналина. Таким образом, в процессе эволюции в системе гемокоагуляции сформировалась лишь одна защитно-приспособительная реакция — гиперкоагулемия, направленная на срочную остановку кровотечения.
Идентичность сдвигов гемокоагуляции при возбуждении симпатического и парасимпатического отделов еще раз подтверждает тот факт, что первичной гиперкоагулемии не существует. Она всегда вторична и развивается после первичной гиперкоагулемии вследствие использования части факторов свертывания крови.
У здоровых людей ускорение гемокоагуляции, как правило, вызывает вторичную стимуляцию фибринолиза, что обеспечивает расщепление избытка фибрина, который образуется в результате усиления латентного микросвертывания крови. Активация фибринолиза наблюдается при физической работе, эмоциях, болевом раздражении.
На свертывание крови оказывает влияние кора больших полушарий мозга. Свои воздействия она реализует через вегетативную нервную систему и те эндокринные железы, гормоны которых обладают вазоактивным действием. Расширение и сужение сосудов приводит к освобождению из стенок тромбопластина, естественных антикоагулянтов и активаторов фибринолиза.
Система свертывания крови входит в состав более обширной системы — системы регуляции агрегатного состояния крови и коллоидов (система РАСК), которая поддерживает гомеостаз внутренней среды организма и ее агрегатное состояние на таком уровне, который необходим для нормальной жизнедеятельности. Система РАСК обеспечивает поддержание жидкого состояния крови и восстановление свойств стенок сосудов, изменяющихся даже при нормальном их функционировании. Она же поддерживает на оптимальном уровне содержание факторов свертывания на случай катастрофы — повреждения сосудов, органов и тканей.
Читайте также:
Рекомендуемые страницы:
Поиск по сайту
poisk-ru.ru
Сосудисто-тромбоцитарный и коагуляционный гемостаз (первичный): что это такое, функции
Защитная функция крови заключается в ее способности к свертыванию. Благодаря этому процессу, происходит локальная остановка кровотечения с целью сохранения полноценного функционирования кровеносной системы. Так сосудисто-тромбоцитарный гемостаз обеспечивает полную остановку кровотечения из сосудов мелкого диаметра, которые имеют низкое артериальное давление. Однако при повреждении артерий и вен данного механизма недостаточно для остановки кровотечения, так как он является первичным гемостазом, выступающим основной для формирования всех фаз гемостаза. Какие же механизмы включаются для ликвидации кровотечения, и как осуществляется их регуляция?
Роль первичного гемостаза в процессе свертывания крови
Стенки кровеносных сосудов не только поддерживают постоянство гемостаза, но и обеспечивают жидкое состояние крови. Одним из важных условий сохранения крови в жидком состоянии является возможность эндотелия не пропускать тромбоциты. При нарушении целостности кровеносных сосудов происходит активация тромбоцитов, они увеличиваются в размерах и приобретают дополнительные отростки, чтобы закрыть место повреждения.
В структуре тромбоцита содержится большое количество веществ, участвующих в остановке кровотечения
Первичный гемостаз состоит из двух основных компонентов:
- Сосудистый. Повреждение сосудов вызывает их спазм, что служит быстрой первичной реакцией системы кровообращения. Сужение просвета сосудов возникает как ответная реакция на боль при повреждении, которую обеспечивают гормоны надпочечников. Однако за счет спазма невозможно ликвидировать кровотечение, которое продолжается 2–3 минуты.
- Тромбоцитарный. Динамические превращения тромбоцитов происходят в несколько этапов, в результате чего происходит их разрушение с дальнейшим включением факторов свертываемости крови.
Благодаря двум компонентам первичного гемостаза, на месте повреждения формируется рыхлая тромбоцитарная пробка, препятствующая появлению кровотечения.
При сближении большого количества тромбоцитов формируется белый тромб, стягивающий раневую поверхность поврежденного сосуда
При возникновении кровотечения в области микроциркуляции первичный сосудисто-тромбоцитарный гемостаз способен в полной мере остановить кровопотерю. Однако сформировавшаяся тромбоцитарная пробка без последующего образования фибрина в сосудах большего диаметра способна лишь временно остановить кровотечение, но не исключено его последующее возобновление.
Функции тромбоцитов в тромбоцитарно-сосудистом гемостазе
Тромбоциты являются важным звеном, обеспечивающим весь процесс ликвидации кровотечения. Для полноценного функционирования первичного звена гемостаза в кровотоке должны присутствовать структурно целостные клетки.
Процесс налипания тромбоцитов в очаге повреждения
Роль кровяных клеток в гемостазе определяется их действием в кровотоке:
- Ангиотрофическое. Обеспечивают нормальную функциональную способность и проницаемость стенок кровеносных сосудов.
- Репарационное. В местах повреждения микрососудов активируется ростовой фактор, стимулирующий образование коллагеновых волокон.
- Ангиоспастическое. Поддерживают спазм микрососудов путем выработки активных веществ.
- Коагуломодулирующие. Регулирование процессов свертывания крови.
- Ретрактильное. Уплотнение образовавшегося тромба.
- Адгезивно-агрегационное. Прилипание клеток к поверхности поврежденных сосудов.
Замедление или остановка кровотечения происходит в результате формирование тромба небольшого диаметра, однако он не может вернуться в кровоток, вызвав полную закупорку сосуда.
Механизм первичного гемостаза
Механизм первичного гемостаза заключается в образовании тромбоцитного сгустка на месте поврежденного сосуда. Данный процесс необходим для остановки кровотечения и для дальнейшего заживления поврежденных участков.
Фазы первичного гемостаза
В механизме выделяют следующие этапы сосудисто-тромбоцитарного гемостаза:
- Повреждение внутренней оболочки сосуда и его спазм (процесс обусловлен рефлекторным спазмом сосуда вследствие сократительных движений клеток кровеносных сосудов).
- Склеивание тромбоцитов в участке повреждения (под силой действия электростатического притяжения происходит адгезия тромбоцитов с участием специфического белка).
- Активирование тромбоцитов и повторный спазм сосудов (активирование вызывает тромбин в процессе метаболических реакций мембран кровяных клеток, из которых высвобождаются вазоактивные компоненты, провоцирующие повторный спазм).
- Агрегация тромбоцитов (происходит слипание тромбоцитов и коллагена, этот процесс стимулируют вещества, вырабатываемые поврежденным кровеносным сосудом и гормонами, усиливающими его спазм).
- Формирование гемостатической пробки (вследствие слипания кровяных клеток образуется временная гемостатическая пробка, перекрывающая дефект сосуда, после чего включается вторичный гемостаз с образованием тромба).
В механизме сосудисто-тромбоцитарного и коагуляционного гемостаза кровяные тела выступают в роли поверхности, на которой формируется тромб.
Нарушение функционирования первичного гемостаза
В большинстве случаев патология, связанная с нарушением в работе сосудисто-тромбоцитарного гемостаза, вызвана изменениями в синтезе одного из рецепторов, расположенного на поверхности тромбоцитарной мембраны.

Врожденные формы пониженной свертываемости крови развиваются вследствие нарушенного процесса адгезии тромбоцитов
Наиболее распространенные заболевания, связанные с нарушением данной системы:
- Синдром Бернара-Сулье. Наследственная геморрагическая дистрофия тромбоцитов, когда на мембране отсутствуют рецепторы, необходимые для присоединения фактора Виллебранда.
- Тромбастения Гланцмана-Негли. На поверхности тромбоцитов отсутствует специальный белок, что приводит к невозможности клеток контактировать между собой, вследствие чего они не стягивают место дефекта.
Синдром Ослера
Врожденное генетическое заболевание сопровождается разрушением сосудистой стенки в результате сниженного количества коллагена в организм, что приводит к уменьшению адгезии тромбоцитов. Болезнь проявляется образованием на коже и слизистых оболочках ангиоэктазий после перенесенной механической травмы.
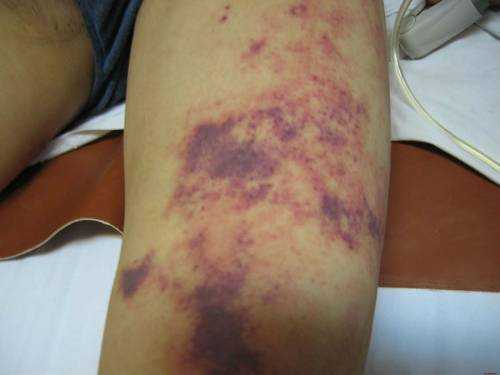
Заболевание Ослера сопровождается кровоизлияниями, по характеру схожими с гематомой
Макроцитарная тромбоцитодистрофия
Наследственная патология, которая заключается в отсутствии рецептов к гликопротеину плазмы крови, из-за чего поверхности кровяных клеток не взаимодействуют между собой. В клинической картине наблюдаются кровотечения из пищеварительного тракта, кровоточивость, образование гематом при незначительных механических повреждениях.
Заболевание Гланцмана
Генетическое нарушение развивается на фоне функционального расстройства тромбоцита. Причиной патологии является отсутствие рецепторов на мембране к фибриногену.
Характеристика клинической картины:
- Повышенная проницаемость сосудистой стенки, из-за чего наблюдаются частые кровотечения.
- Значительно удлиняется время кровотечения.
- Появление петехий в местах повреждений.
У новорожденных нарушение первичного звена гемостаза развивается на фоне несовместимости матери и ребенка по тромбоцитарному антигену или рождение детей от женщины, страдающей системными заболеваниями, и после проведенной спленэктомии.
Методы оценки функции тромбоцитов
Оценка первичного гемостаза заключается в определении следующих диагностических методов:
- Манжетная проба. Позволяет выявить степень ломкости сосудов. Путем дозированного повышения венозного давления на поверхности предплечья образуются петехии в количестве не более 10.
- Метод Айви. Позволяет оценить время свертываемости крови. Кожу верхней трети предплечья прокалывают, в норме кровь сворачивается в течение 5–8 минут.
- Проба Дьюка. Определение скорости свертывания крови при помощи прокола мочки уха, в норме – 2–4 минуты.
- Агрегация тромбоцитов. Оценка начальной стадии формирования тромба.
- Фотоэлектроколориметрия с применением агрегометра. Определяет уровень фактора Виллебранда в плазме.
- Степень ретракции кровяного сгустка.
Методы исследования свойств и структуры тромбоцитов позволяют уточнить характер патологии
Сниженное количество тромбоцитов в крови приводит к неполноценному функционированию эндотелия, вследствие чего повышается ломкость капилляров. Параллельно происходит нарушение адгезивной и агрегационной функции тромбоцитов, что способствует усилению и удлинению времени кровотечения при повреждении сосудов.
Повышенный уровень тромбоцитов и увеличение их вязкости приводит к развитию тромбоза, инфаркта миокарда, ишемии и облитерирующим болезням сосудов конечностей.
Первичное звено гемостаза является важным этапом в остановке кровотечения. Так, при травмах микрососудов компенсаторный механизм включается в первые секунды и продолжается до полной остановки кровопотери. Однако нарушение функций тромбоцитов приводит к дисбалансу в организме, что выявляется различными патологическими состояниями.
icvtormet.ru
этапы, симптомы, причины и последствия
Организм человека – очень сложное и интересное устройство, состоящее из нескольких общебиологических систем. Тромбоцитарное звено гемостаза лишь часть систем, в обязанности которых входит контроль за жизненно важными составляющими и структурами организма.
Что такое гемостаз

Сам термин можно перевести с греческого как система, которая сдерживает кровь в нужном положении. В первую очередь она должна быть определенной консистенции, а система кровообращения замкнутой. Если же произошло повреждение, то кровь должна оставаться в замкнутой системе и не покидать ее пределов за счет способности свертываться, что обеспечивает предотвращение сильной кровопотери.
Система, сохраняющая кровь в жидком состоянии, называется гемостазом. При травмировании стенок сосудов система незамедлительно приступит к ослаблению и устранению кровотечения.
Основные компоненты
Сосудисто-тромбоцитарный гемостаз подразделяется на четыре составляющие:
- Эндотелиальный слой – это внутренняя выстилка кровеносных сосудов человека, отделяет кровоток от более глубоко расположенных слоев стенки.
- Форменные кровяные элементы – сюда включают клетки тромбоцитов, эритроцитов и лейкоцитов.
- Плазменные компоненты – которые состоят из противосвертывающей, фибринолитической и системы свертывания.
- Регуляторные факторы.
Механизмы устранения кровотечения
Сосудисто-тромбоцитарное звено гемостаза состоит из трех первостепенных структур, которые работают упорядоченно и одновременно.
Делятся они на три вида, по типу условий работы:
- Сосудисто-тромбоцитарный (первостепенный).
- Коагуляционный (второстепенный).
- Растворение тромба.
Основная задача данной системы заключается в том, что при помощи воздействия тромбина белок под названием фибриноген преобразуется в нерастворимый в жидкости фибрин. Каждый сгусток крови в организме представляет собой своеобразное сочетание тромбоцитов с фибрином. Они играют главную роль в обновлении поврежденных стенок кровеносного сосуда, а фактор их роста помогает в стимуляции регенерации тканей.
Состоит из нескольких нераздельных систем. Их стабильное функционирование обеспечивает постоянное нейрогуморальное регулирование. Микромеханизмы отрицательной и положительной связи в пределах системы функционируют безупречно, что позволяет быстро создавать сгустки для предотвращения кровопотери. А затем так же быстро растворять их за ненадобностью.
Первичный гемостаз
Непрекращающаяся совместная работа органичных покрытий кровоснабжения и тромбоцитов обеспечивает создание удивительных механизмов.
Сосудисто-тромбоцитарный гемостаз – это процесс уменьшения или полной остановки кровопотери в микроциркуляторных сосудах, не превышающих в разрезе 100 мкм. Это сочетание очень сложных, выполняемых в одно время функций. Основная задача состоит в уменьшении или же полной остановке кровопотери в промежутке 2-3 минут после разрушения капилляров.
Бытует мнение, что кровопотерю при повреждениях крупных магистралей данный механизм способен полностью остановить. А венозное, артериальное или артериальное кровотечение – лишь отчасти.
Причиной является различная скорость, а также разница в давлении, вследствие чего в крупных системах кровотока образование тромбоцитной пробки просто невозможно. Ведь внутреннее давление гораздо больше проницаемости самой преграды. Из-за этого оно хотя и замедляет темп, но без дополнительных манипуляций остановить его не получится.
Тромбоцитарный гемостаз приступает к работе буквально в первые секунды после получения повреждений. В последующем именно он отвечает за заживляемость стенок.
Этапы работы

Современная медицина выделяет несколько основных этапов:
- Первичный спазм – нарушение целостности покрытия и спазм приводят к сокращению телец клеток, что вызывает рефлекторный спазм.
- Адгезия – при участии электростатического притяжения производится склейка тромбоцитов при помощи специального белка, которым чаще является коллаген. На данном этапе остановка кровотечения обеспечивается при помощи своеобразной пробки, состоящей из кровяных сгустков.
- Вторичный спазм – активизация тромбоцитов провоцирует тромбин в последовательности метаболических реакций у мембран клеток крови, за счет чего освобождаются вазоактивные компоненты. Это происходит за счет связывания тромбоцитарных клеток при помощи специальных отростков, которые образуются на поверхности клеток после того, как они изменяют форму с привычной овальной на сферическую. При этом происходит полная остановка кровотечения.
- Агрегация – вещества, которые образуются при помощи кровеносного сосуда с повреждением в сочетании с усиливающими гормонами, вызывают склеивание коллагена и тромбоцитов. Полное и правильное прохождение данного процесса в дальнейшем гарантирует быстрое заживление раны в будущем.
- Ретракция сгустка – за счет слипшихся клеток происходит формирование временной гемостатической пробки, которая перекрывает дефект и является временной заменой тромба.
Этапы сосудисто-тромбоцитарного гемостаза важны для достижения положительного результата, как по отдельности, так и все вместе. А нарушения хотя бы в одном, скорее всего, приведут к тому, что замедлить или остановить потерю крови будет почти невозможно.
Как происходит остановка кровотечения
Первостепенную роль выполняет непосредственно нарушение целостности стенок. Ведь именно вследствие этого в кровоток вбрасывается коллаген, образовавшийся вследствие обнажения субэндотелиальных тканевых структур.
Затем начинается активация тромбоцитов. Это происходит по причине появления в крови фактора Виллебранда, что в свою очередь вызвано резким скачком количества белка.
Находясь под влиянием определенного ряда факторов, они начинают набухать, покрываться многочисленными отростками и закрывают участок с повреждением.
Освобождение содержимого происходит при помощи образовавшегося коллагена.
Последняя ступень происходит не без помощи таких гормонов надпочечников, как серотонин, адреналин и норадреналин, которые при попадании в кровоток вызывают спазм, за счет чего кровотечение планомерно замедляется.
Помимо этого:
- тромбоцитарная агрегация значительно усиливается;
- происходит спазм кровеносного сосуда с повреждением.
Все процессы, входящие в тромбоцитарный гемостаз, значительно уменьшают количество крови, которая выделяется из раны, а также обеспечивают накапливание гемостатических веществ в районе повреждения.
Затем новообразованная пробка постепенно приобретает более плотную структуру и сильнее закрепляется на поврежденном месте. Это происходит за счет актомиозиноподобных белков – тромбостенинов, которые делают клетки более плотными, отжимая его.
Все вместе создает сам тромбоцитарный гемостаз. В поврежденном месте не начинается формирование коагуляционного звена, а образуется неустойчивый мягкий тромб, который в случае необходимости вполне может прекратить начавшееся кровотечение.
Однако стоит запомнить, что при повреждении вен и артерий данный метод не принесет желаемых результатов, т. к. кровоток там в разы быстрее и под более высоким давлением.
Функциональные нарушения процесса
В основном любое нарушение тромбоцитарно-сосудистого гемостаза спровоцировано переменами в синтезе какого-либо из рецепторов, располагающихся на плоскости мембраны.
Самыми часто диагностируемыми заболеваниями являются:
- Синдром Бернара-Сулье. Данное нарушение является наследственным и проявляется в геморрагической дистрофии клеток. Это тот случай, когда рецептора, который требуется для соединения с фактором Виллебранда, не имеется на мембране.
- Тромбастения Гланцмана-Негли. Белка, который необходим для контакта клеток, нет на тромбоцитах. Это не позволяет стянуть место дефекта естественным путем.
- Синдром Ослера. Является унаследованным генным заболеванием. Проявляется в снижении адгезии за счет уменьшения содержания коллагена и распада сосудистой стенки.
- Макроцитарная тромбоцитодистрофия. Данная патология передается исключительно по наследству. Суть заболевания состоит в отсутствии взаимодействия поверхностей клеток крови. Как правило, вызвано тем, что нет рецепторов к гликопротеину кровяной плазмы.
- Заболевание Гланцмана. Является следствием генетических нарушений. Причина состоит в отсутствии на мембране рецепторов к фибриногену. Развитие изменений напрямую взаимосвязано с нарушениями функциональности тромбоцита.
У детей, как правило, механизмы сосудисто-тромбоцитарного гемостаза нарушены в случае, если мать и дитя несовместимы по тромбоцитному антигену. Также причиной может стать системные болезни девушки или спленэктомия.
Клиническая картина заболевания

Основной симптоматикой является:
- На кожном покрове и слизистой оболочке образовываются ангиоэктазии, по своему характеру похожие на гематому после механических повреждений.
- Кровотечение из желудочно-кишечного тракта.
- Появление гематомы после незначительной механической травмы.
- Частое проявление гематом, которое вызвано увеличившейся проницаемостью стенок сосудов.
- В поврежденных местах появляются петехии.
- Если тромбоцитарный гемостаз нарушен, то наблюдается повышение или понижение свертываемости крови.
Несколько нюансов
Во время изучения крайне важно помнить несколько важных нюансов:
- Первичный и вторичный гемостаз являются одновременно взаимосвязанными и независимыми.
- Суть состоит в первичной остановке кровопотери или хотя бы ее снижении.
- Преимущественно несильное кровотечение останавливается в течение 3-5 минут.
- Плазменный и тромбоцитарный гемостаз происходит при помощи тромбоцитов и факторов Виллебранта.
- Является первостепенным при устранении любой кровопотери. Но он не может завершить кровотечение из сосудов среднего или крупного звена.
Методы исследования
В основным, оценка тромбоцитарного гемостаза производится такими методами:
- Манжетная проба – проводится для определения степени ломкости капилляров. Способ проведения: при помощи врачебного вмешательства постепенно повышается венозное давление, за счет чего на предплечье появляются максимум 10 петехий.
- Метод Айви – используется для оценки времени, затрачиваемого организмом на свертывание крови. Способ проведения: прокалывается кожа в первой трети предплечья. В идеале она должна свернуться за 5-8 минут.
- Проба Дьюка – определяет темпы свертывания. Способ проведения: прокалывается мочка уха. Процесс должен занять не больше 2-4 минут.
- Агрегация – используется при необходимости оценить начально формирование тромба.
- Фотоэлектроколориметрия с использованием агрегометра – применяется для определения содержания фактора Виллебранда в плазме.
- Степень ретрактации сгустка крови.
Пониженный уровень содержания тромбоцитов ведет к патологиям функционирования эндотелия, что, в свою очередь, увеличивает ломкость капилляров. Одновременно нарушается адгезионные и агрегационные свойства клеток, за счет чего усиливается и повышается время кровопотери при нарушении целостности.
Количество клеток, превышающее стандарт, и их увеличенная вязкость может спровоцировать появление таких заболеваний, как тромбоцитоз, инфаркт миокарда, ишемию и облитерирующие заболевания сосудов рук или ног.
Выводы
Тромбоцитарный гемостаз — один из первостепенных этапов остановки кровопотери. Например, при получении травм микрососудов данный механизм начинает свою работу буквально сразу же и продолжает ее до полного прекращения потери крови. Тем не менее функциональные изменения в его работе провоцируют дисбаланс, и приводят к разнообразным патологическим состояниям.
Согласно исследованиям, весь процесс в целом занимает не больше 4 минут. Искать у него симптомы, а тем более методы его лечения крайне нелепо. Ведь сосудисто-тромбоцитарный гемостаз – это не болезнь, а естественный механизм защиты организма.
fb.ru
Сосудисто тромбоцитарный гемостаз
Главная / Сосудисто тромбоцитарный гемостазТромбоцитарный гемостаз
Сосудисто-тромбоцитарный гемостаз, или первичный, – явление, при котором у человека уменьшается либо же полностью останавливается кровопотеря.
Механизм такого явления обеспечивается за счет сокращения травмированных сосудов, на месте повреждения которых формируется тромбоцитарный агрегат.
Многие врачи называют такое явление первичной гемостатической пробкой поврежденного сосуда. Благодаря такому явлению организм в случае необходимости может полностью останавливать или минимизировать кровопотерю.
Принято считать, что порезы капилляров и венул остановить таким образом можно полностью, а вот кровопотерю из вен, артерий или артериол – лишь частично.
Дело в том, что скорость кровотока в таких крупных магистралях гораздо выше. Также там отличается и давление на стенки кровеносных сосудов.
По этой причине на месте повреждения не может быть образована тромбоцитная пробка – ее проницаемость выше, чем давление в сосудах. Таким образом, кровотечение пусть и замедляется, однако полностью избавиться от него без дополнительной помощи невозможно.
Сам механизм сосудисто-тромбоцитарного гемостаза начинает работать уже после первых секунд повреждения. Именно он обеспечивает заживляемость в будущем.
Современные специалисты выделяют 3 этапа в работе этого механизма:
Каждый из этих этапов крайне важен для полной остановке кровотечения. При нарушении хотя бы одного из них остановить потерю крови или замедлить ее будет практически невозможно.
 Сосудисто тромбоцитарный гемостаз
Сосудисто тромбоцитарный гемостазЧто обеспечивают тромбоциты?
Тромбоциты – особые кровяные пластины, которые и обеспечивают весь процесс остановки кровотечения. Это безъядерные образования овальной формы и практически без объема, поверхность который отличается гладкостью.
В среднем размер одного тромбоцита колеблется от 2 до 4 мкм, также внешне он окружен мембраной. Чтобы обеспечивать полноценный физиологический баланс, а также первичное звено гемостаза, очень важно иметь в крови функциональные тромбоциты.
При сосудисто-тромбоцитарном гемостазе такие кровяные тельца выполняют следующие функции:
- Ангиотрофическая – подпитывают сосудистый эндотелий, поддерживают нормальную функцию и структуру мелких кровеносных сосудов по всему телу. Также благодаря этой функции все кровеносные сети в организме защищены от механических воздействий, не пускают в русло эритроциты.
- Секреция вазоактивных веществ – помогают поддерживать и полностью обеспечивают спазм поврежденных кровеносных сосудов. Это обеспечивается выработкой гормонов щитовидной железы и коры надпочечников.
- Образование и транспортировка питательных веществ – крайне важно для нормальной агрегации и адгезии тромбоцитов.
- Адгезивно-агрегационная – помогает остановить кровотечение при помощи образования тромбоцитарной пробки. Она помогает остановить кровопотерю за счет прилипания тромбоцитов к стенкам поврежденного сосуда, после чего склеивает две плоскости между собой.
- Гемокоагуляция – обеспечивает тромбоцитов свертываемости, что является наиболее важной функцией при остановке кровотечения. Здесь наиболее важным фактором является мембранный фосфолипидный фактор. Именно он служит основой для образования активных комплексов.
Остановка кровотечений или замедление и уменьшение кровопотери проходит при помощи образования небольшого тромба. Он не способен вернуться в кровеносное русло и вызвать закупорку сосудов. Такие пробки могут образоваться лишь при контакте с воздухом. Нужно отметить, что формирование первичного тромба проходит в следующие этапы:
- Адгезия тромбоцитов – процесс налипания таких кровеносных телец на компоненты поврежденного эпителия, чаще всего коллаген. Также такие образования могут закрепиться и на чужеродных предметах, которые находятся непосредственно в ране. В среднем продолжительность этого этапа занимает около 5 секунд. Данный механизм остановки кровотечения обеспечивается взаимосвязью сразу трех компонентов: рецепторов мембран тромбоцитов, фактора Виллебранда и коллагена. Взаимодействуя между собой, такие компоненты образую своеобразную пробку из сгустков крови.
- Активация и дегрануляция тромбоцитов – явления, при котором происходит окончательная остановка кровотечения из сосудов. Тромбоциты меняют свою привычную овальную форму на сферическую, после чего у них начинают разрастаться отростки. Благодаря этим отросткам тромбоциты начинают крепко связываться между собой, а также выделять ряд активных веществ.
- Агрегация тромбоцитов – слипание кровеносных клеток между собой под воздействием активных веществ. Полнота этого процесса обеспечивает то, насколько быстро у вас заживет рана в будущем.
[ads-pc-2]
Механизм сосудисто-тромбоцитарного гемостаза
Суть сосудисто-тромбоцитарного гемостаза сводится к тому, что на месте повреждения кровеносных сосудов возникают тромбоцитарные пробки.
Такой механизм крайне важен как для остановки кровотечения, так и последующего заживления поврежденных участков.
Это явление принято делить на три отдельных этапа: первичный спазм сосудов, формирование тромбоцитарной пробки, сокращение и уплотнение возникшей пробки. Каждый этап в этом процессе крайне важен для полноценного сосудисто-тромбоцитарного гемостаза.
Первые действия сосудисто-тромбоцитарного гемостаза возникают сразу же после повреждения. Именно тромбоциты сразу же формируются в месте пореза и значительно замедляют скорость кровотока.
Кроме того, особое значение в этом процессе имеют гормоны надпочечников – адреналин и норадреналин. Они выделяют в течение первых 10-20 секунд после травмирования.
На этом первичный спазм сосудов заканчивается, возникает вторичный. Он характеризуется повышением активности тромбоцитов, а также выбросом в крови ТхА2, адреналина и серотонина.
Нужно отметить, что повреждение кровеносных сосудов сразу же вызывает активацию тромбоцитов. Это обусловлено повышением количества АДФ в крови из-за нарушения структуры эритроцитов – кровяных телец.
Кроме того, особую роль здесь играет обнаженный субэндотелий, фибриллярный и коллагеновые структуры.
В результате такого воздействия в организме человека раскрываются вторичные рецепторы, которые и обеспечивают возникновение оптимальных условий для агрегации, адгезии и формирования тромбоцитарной пробки.
Адгезия, или связывания клеток тромбоцитов при помощи особо белка – фактора Виллебранда, является одной из наиболее важных функций сосудисто-тромбоцитарного гемостаза.
Именно этот момент обеспечивает то, насколько полно и быстро будет проходить заживание поврежденных кровеносных сосудов.
Во время этого периода кровеносная система начинает самостоятельно вырабатывать необходимое количество коллагеновых волокон. Таким образом, поврежденный кровеносный сосуд оказывается в подвешенном состоянии.
Практически в одно и то же время с адгезией возникает момент агрегации тромбоцитов. Такое явление обеспечивается специальными белками фибриногенами, которые содержатся в плазме крови и непосредственно в самих тромбоцитах.
В таких кровеносных тельцах фибриногены выполняют функцию мостика, который и обеспечивает формирование тромбоцитарной пробки.
Не менее важную роль в сосудисто-тромбоцитарном гемостазе выполняет комплекс полипептидов и белков. Врачи называют их интегринами.
Они являются связующим агентом между тромбоцитами и непосредственно структурами поврежденного кровеносного сосуда и участка кожного покрова.
Именно такие белки обеспечивают формирование связи между поврежденными участками, что способствует остановке кровотечения. Нужно отметить, что агрегация может носить обратимый характер.
Дело в том, что после агрегации наступает период дезагрегации. Это возникает на фоне недостаточного количества агрегирующего агента.
Как происходит остановка кровотечения?
Важную роль в реализации сосудисто-тромбоцитарного гемостаза играет непосредственно повреждение сосудистых стенок. Из-за этого обнажаются субэндотелиальные тканевые структуры, что становится причиной выброса коллагена в кровеносное русло.
Из-за появившегося в крови белка, организм начинает выбрасывать в кровь определенное количество фактора Виллебранда. Это вызывает активацию тромбоцитов.
Под воздействием ряда определенных факторов они набухают, покрываются множественными отростками и покрывают поврежденный участок кровеносного сосуда.
Коллаген, образовавшийся из стенки поврежденного сосуда, способствует высвобождению содержимого тромбоцитов. При этом появившийся фактор Виллебранда обеспечивает адгезию благодаря сосудосуживающим веществам.
[ads-pc-1]
Этот процесс обеспечивается гормонами надпочечников – серотонином, адреналином и норадреналином. Попадая в кровь, они обеспечивают спазм сосуда, благодаря чему кровоток значительно уменьшается.
Нужно отметить, что процесс адгезии тромбоцитов на участках поврежденного сосуда происходит крайне быстро и обычно занимает не более 10 секунд.
После этого к повреждению сосудистого просвета прилипают тромбоциты, которые набухают и склеиваются между собой. Такое явление также обеспечивается специальными отростками, которые возникают в тот момент, когда такое кровяное тельце начинает менять свою форму.
Благодаря наложению кровеносных клеток на поврежденный сосуд, его просвет полностью закрывается, что и обеспечивает остановку кровотечения. Также такой процесс обеспечивает два эффекта:
- Усиление процесса агрегации тромбоцитов.
- Спазм поврежденного кровеносного сосуда.
Все это приводит к тому, что количество выделяемой из раны крови значительно падает. Кроме того, в месте повреждения начинают накапливаться гемостатические вещества.
В будущем тромбоцитарная пробка начинает уплотняться, она все больше закрепляется в месте повреждения кровеносного сосуда. Это обеспечивается актомиозиноподобными белками – тромбостенинами. Они помогают отжать тромбоцит, что делает его более плотным.
Описанные выше процессы полностью обеспечивают сосудисто-тромбоцитарный гемостаз. Благодаря этому возникает нестойкий, рыхлый тромб из тромбоцитов, который и способствует остановки кровотечения в случае необходимости. Кроме того, на месте повреждения не формируется коагуляционное звено.
Именно это и обеспечивает полноценную остановку кровотечения из крупных кровеносных сосудов. Нужно отметить, что такой способ не сможет полностью остановить кровоизлияние из вен или артерий – там кровь движется с большей скоростью и под высоким давлением.
При изучении сосудисто-тромбоцитарного гемостаза важно знать:
- Сосудисто-тромбоцитарный и коагуляционный гемостазы – взаимосвязаны и независимы одновременно.
- Цель сосудисто-тромбоцитарного гемостаза – первичная остановка кровотечения или уменьшение ее скорости.
- В среднем устранить небольшое кровотечение удается за 2-4 минуты.
- Первичный сосудисто-тромбоцитарный гемостаз обеспечивается за счет факторов Виллебранда и тромбоцитов.
- Первичный сосудисто-тромбоцитарный гемостаз – первый этап в остановке любого кровотечения. Однако самостоятельно он не сможет оставить кровопотерю из средних или крупных сосудов.
loveset.ru
Схема сосудисто тромбоцитарного гемостаза — Все про холестерин
Содержание статьи
Сосудисто-тромбоцитарный гемостаз
Многие годы безуспешно боретесь с ХОЛЕСТЕРИНОМ?
Глава Института: «Вы будете поражены, насколько просто можно снизить холестерин просто принимая каждый день…
Читать далее »
Защитная функция крови заключается в ее способности к свертыванию. Благодаря этому процессу, происходит локальная остановка кровотечения с целью сохранения полноценного функционирования кровеносной системы. Так сосудисто-тромбоцитарный гемостаз обеспечивает полную остановку кровотечения из сосудов мелкого диаметра, которые имеют низкое артериальное давление. Однако при повреждении артерий и вен данного механизма недостаточно для остановки кровотечения, так как он является первичным гемостазом, выступающим основной для формирования всех фаз гемостаза. Какие же механизмы включаются для ликвидации кровотечения, и как осуществляется их регуляция?
Роль первичного гемостаза в процессе свертывания крови
Стенки кровеносных сосудов не только поддерживают постоянство гемостаза, но и обеспечивают жидкое состояние крови. Одним из важных условий сохранения крови в жидком состоянии является возможность эндотелия не пропускать тромбоциты. При нарушении целостности кровеносных сосудов происходит активация тромбоцитов, они увеличиваются в размерах и приобретают дополнительные отростки, чтобы закрыть место повреждения.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для снижения холестерина наши читатели успешно используют Aterol. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Первичный гемостаз состоит из двух основных компонентов:
- Сосудистый. Повреждение сосудов вызывает их спазм, что служит быстрой первичной реакцией системы кровообращения. Сужение просвета сосудов возникает как ответная реакция на боль при повреждении, которую обеспечивают гормоны надпочечников. Однако за счет спазма невозможно ликвидировать кровотечение, которое продолжается 2–3 минуты.
- Тромбоци
holesterin-sredstvo.ru

