Классификация химических реакций
Химические реакции следует отличать от ядерных реакций. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например превращение алюминия в магний:
2713Аl + 11Н = 2412Мg + 42Не
Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Реакции, идущие без изменения состава веществ.
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
С (графит) ↔ С (алмаз)
S (ромбическая) ↔ S (моноклинная)
Р (белый) ↔ Р (красный)
Sn (белое олово) ↔ Sn (серое олово)
3O2 (кислород) ↔ 2O3 (озон)
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, так как углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
CH3— CH2— С= — СН ↔ СН3— С= — С- СН3
этилацетилен диметнлацетилен
4. Изомеризация галогеналканов (А. Е. Фаворский, 1907 г.).
5. Изомеризация цианита аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1828 г. изомеризацией цианата аммония при нагревании.
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество
В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы:
1. Получение оксида серы (IV):
S + O2 = SO — из двух простых веществ образуется одно сложное.
2. Получение оксида серы (VI):
SO2 + 02 → 2SO3 — из простого и сложного веществ образуется одно сложное.
3. Получение серной кислоты:
SO3 + Н2O = Н2SO4 — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
4NО2 + O2 + 2Н2O = 4НNO3
В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1. Реакция гидрирования — присоединения водорода:
CH2=CH2 + Н2 → Н3-СН3
этен → этан
2. Реакция гидратации — присоединения воды.
3. Реакция полимеризации.
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами:
1. Разложение оксида ртути(II) — из одного сложного вещества образуются два простых.
2. Разложение нитрата калия — из одного сложного вещества образуются одно простое и одно сложное.
3. Разложение перманганата калия — из одного сложного вещества образуются два сложных и одно простое, то есть три новых вещества.
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности:
1. Реакция дегидратации (отщепления воды) этанола:
С2H5OH → CH2=CH2 + H2O
2. Реакция дегидрирования (отщепление водорода) этана:
CH3-CH3 → CH2=CH2 + H2
или СН3-СН3 → 2С + ЗН2
3. Реакция крекинга (расщепления) пропана:
CH3-СН2-СН3 → СН2=СН2 + СН4
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1. Взаимодействие щелочных или щелочноземельных металлов с водой:
2Na + 2Н2O = 2NаОН + Н2
2. Взаимодействие металлов с кислотами в растворе:
Zn + 2НСl = ZnСl2 + Н2
3. Взаимодействие металлов с солями в растворе:
Fе + СuSO4 = FеSO4 + Сu
4. Металлотермия:
2Аl + Сr2O3 → Аl2O3 + 2Сr
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена. Другой пример — бромирование ароматического соединения (бензола, толуола, анилина).
FеВr3
С6Н6
+ Вr2 → С6Н5Вr + НВrбензол → бромбензол
Обратим внимание на особенность реакции замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещество, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола. Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2O).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1. Реакция нейтрализации, идущая с образованием соли и воды.
2. Реакция между щелочью и солью, идущая с образованием газа.
3. Реакция между щелочью и солью, идущая с образованием осадка:
СuSO4 + 2КОН = Сu(ОН)2 + К2SO4
или в ионном виде:
Сu2+ + 2OН— = Сu(ОН)2
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1. Реакция, идущая с образованием слабого электролита — Н2O:
СН3СООН + NаОН → Nа(СН3СОО) + Н2O
2. Реакция, идущая с образованием газа:
2СН3СООН + СаСO3 → 2СН3СОО + Са2+ + СO2 + Н2O
3. Реакция, идущая с образованием осадка:
2СН3СООН + К2SO3 → 2К(СН3СОО) + Н2SO3
или
2СН3СООН +SiO → 2СН3СОО + Н2SiO3По этому признаку различают следующие реакции:
1. Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1. Mg0 + H+2SO4 = Mg+2SO4 + H2↑
2. 2Mg0 + O02 = Mg+2O-2
Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса.
2KMn+7O4 + 16HCl— = 2KCl— + 2Mn+2Cl—2 + 5Cl02↑ + 8H2O
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов.
1. Они восстанавливаются в соответствующие спирты:
Альдекиды окисляются в соответствующие кислоты:
2. Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, многие реакции разложения, реакции этерификации:
НСООН + CHgOH = НСООСН3 + H2O
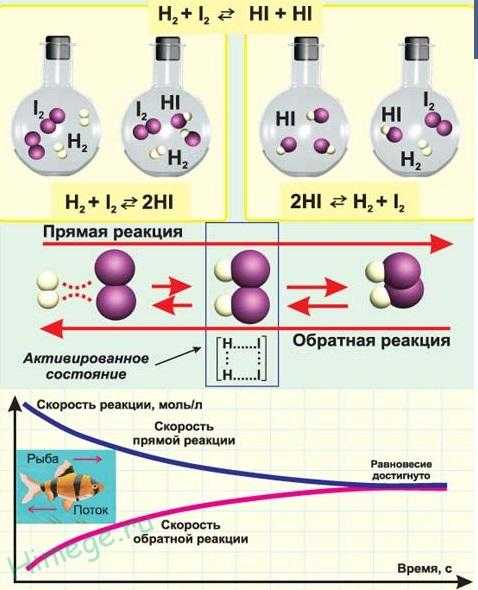
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1. Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота(II) из азота и кислорода и реакция газообразного водорода с твердым иодом.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения. Гидрирование этилена — пример экзотермической реакции. Она идет при комнатной температуре.
2. Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
1. Обжиг известняка
2. Крекинг бутана
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением:
Н2(г) + С12(г) = 2НС1(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) — 90,4 кДж
По агрегатному состоянию реагирующих веществ различают:
1. Гетерогенные реакции — реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах).
2. Гомогенные реакции — реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе).
По участию катализатора различают:
1. Некаталитические реакции, идущие без участия катализатора.
2. Каталитические реакции , идущие с участием катализатора. Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным. Следует отметить, что более 70% химических производств используют катализаторы.
По направлению различают:
1. Необратимые реакции протекают в данных условиях только в одном направлении. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
2. Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия — антонимы процессов:
• гидрирование — дегидрирование,
• гидратация — дегидратация,
• полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма — обмена веществ.
1. Радикальные реакции идут между образующимися в ходе реакции радикалами и молекулами.
Как вы уже знаете, при всех реакциях происходит разрыв старых и образование новых химических связей. Способ разрыва связи в молекулах исходного вещества определяет механизм (путь) реакции. Если вещество образовано за счет ковалентной связи, то могут быть два способа разрыва этой связи: гемолитический и гетеролитический. Например, для молекул Сl2, СН4 и т. д. реализуется гемолитический разрыв связей, он приведет к образованию частиц с неспаренными электронами, то есть свободных радикалов.
Радикалы чаще всего образуются, когда разрываются связи, при которых общие электронные пары распределены между атомами примерно одинаково (неполярная ковалентная связь), однако многие полярные связи также могут разрываться подобным же образом, в частности тогда, когда реакция проходит в газовой фазе и под действием света, как, например, в случае рассмотренных выше процессов — взаимодействия С12 и СН4—. Радикалы очень реакционноспособны, так как стремятся завершить свой электронный слой, забрав электрон у другого атома или молекулы. Например, когда радикал хлора сталкивается с молекулой водорода, то он вызывает разрыв общей электронной пары, связывающей атомы водорода, и образует ковалентную связь с одним из атомов водорода. Второй атом водорода, став радикалом, образует общую электронную пару с неспаренным электроном атома хлора из разрушающейся молекулы Сl2, в результате чего возникает радикал хлора, который атакует новую молекулу водорода и т. д
Реакции, представляющие собой цепь последовательных превращений, называют цепными реакциями.
За разработку теории цепных реакций два выдающихся химика — наш соотечественник Н. Н. Семенов и англичанин С. А. Хиншелвуд были удостоены Нобелевской премии.
Аналогично протекает и реакция замещения между хлором и метаном:
По радикальному механизму протекают большинство реакций горения органических и неорганических веществ, синтез воды, аммиака, полимеризация этилена, винилхлорида и др.
Типичные ионные реакции — это взаимодействие между электролитами в растворе. Ионы образуются не только при диссоциации электролитов в растворах, но и под действием электрических разрядов, нагревания или излучений. γ-Лучи, например, превращают молекулы воды и метана в молекулярные ионы.
По другому ионному механизму происходят реакции присоединения к алкенам галогеноводородов, водорода, галогенов, окисление и дегидратация спиртов, замещение спиртового гидроксила на галоген; реакции, характеризующие свойства альдегидов и кислот. Ионы в этом случае образуются при гетеролитическом разрыве ковалентных полярных связей.
инициирующей реакцию, различают:
1. Фотохимические реакции. Их инициирует световая энергия. Кроме рассмотренных выше фотохимических процессов синтеза НСl или реакции метана с хлором, к ним можно отнести получение озона в тропосфере как вторичного загрязнителя атмосферы. В роли первичного в этом случае выступает оксид азота(IV), который под действием света образует радикалы кислорода. Эти радикалы взаимодействуют с молекулами кислорода, в результате чего получается озон.
Образование озона идет все время, пока достаточно света, так как NO может взаимодействовать с молекулами кислорода с образованием того же NO2. Накопление озона и других вторичных загрязнителей атмосферы может привести к появлению фотохимического смога.
К этому виду реакций принадлежит и важнейший процесс, протекающий в растительных клетках, — фотосинтез, название которого говорит само за себя.
2. Радиационные реакции. Они инициируются излучениями большой энергии — рентгеновскими лучами, ядерными излучениями (γ-лучами, а-частицами — Не2+ и др.). С помощью радиационных реакций проводят очень быструю радиополимеризацию, радиолиз (радиационное разложение) и т. д.
Например, вместо двухстадийного получения фенола из бензола его можно получать взаимодействием бензола с водой под действием радиационных излучений. При этом из молекул воды образуются радикалы [•OН] и [•H•], с которыми и реагирует бензол с образованием фенола:
С6Н6 + 2[ОН] → С6Н5ОН + Н2O
Вулканизация каучука может быть проведена без серы с использованием радиовулканизации, и полученная резина будет ничуть не хуже традиционной.
3. Электрохимические реакции. Их инициирует электрический ток. Помимо хорошо известных вам реакций электролиза укажем также реакции электросинтеза, например, реакции промышленного получения неорганических окислителей
4. Термохимические реакции. Их инициирует тепловая энергия. К ним относятся все эндотермические реакции и множество экзотермических реакций, для начала которых необходима первоначальная подача теплоты, то есть инициирование процесса.
Рассмотренная выше классификация химических реакций отражена на схеме.
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам. Например, составим характеристику процесса синтеза аммиака.
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гетерогенная (точнее, гетерогенно-каталитическая), протекающая с уменьшением давления в системе. Для успешного управления процессом необходимо учитывать все приведенные сведения. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки.
examchemistry.com
Классификация химических реакций, с примерами
Наиболее часто под химическими реакциями понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы, число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения, а формулы продуктов – в правой. Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой химической реакции будет выглядеть следующим образом:
A + B (+D) = C
Например:
СаСО3 + СО2 + Н2О = Са(НСО3)2
SO3 + H2O = H2SO4
2Mg + O2 = 2MgO.
2FеСl2 + Сl2 = 2FеСl3
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения. В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
A= B+ C + D
Например:
CaCO3CaO + CO2 ↑ (1)
2H2O =2H2 ↑+ O2↑ (2)
CuSO4 × 5H2O = CuSO4 + 5H2O (3)
Cu(OH)2 = CuO + H2O (4)
H2SiO3 = SiO2 + H2O (5)
2SO3 =2SO2 + O2 ↑ (6)
(NH4)2Cr2O7 = Cr2O3 + N2↑ +4H2O (7)
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов, кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
С18H38 = С9H18 + С9H20 (8)
C4H10 = C4H6 + 2H2 ↑ (9)
При реакциях замещения простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение химической реакции замещения будет выглядеть следующим образом:
A + BC = AB + C
Например:
2Аl + Fe2O3 = 2Fе + Аl2О3 (1)
Zn + 2НСl = ZnСl2 + Н2 (2)
2КВr + Сl2 = 2КСl + Вr2 (3)
2КСlO3 + l2 = 2KlO3 + Сl2 (4)
СаСО3+ SiO2 = СаSiO3 + СО2 (5)
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5 (6)
СН4 + Сl2 = СН3Сl + НСl (7)
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения степеней окисления немногочисленны (5, 6).
Реакциями обмена называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
АВ + СD = АD + СВ
Например:
CuO + 2HCl = CuCl2 + H2O (1)
NaOH + HCl = NaCl + H2O (2)
NаНСО3 + НСl = NаСl + Н2О + СО2↑ (3)
AgNО3 + КВr = АgВr ↓ + КNО3 (4)
СrСl3 + ЗNаОН = Сr(ОН)3 ↓+ ЗNаСl (5)
Реакции обмена не являются окислительно-восстановительными. Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка (4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO2 = 2MgO + C (1)
Mg0 – 2e = Mg2+ (восстановитель)
С4+ + 4e = C0 (окислитель)
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O (2)
Fe2+ -e = Fe3+ (восстановитель)
N5+ +3e = N2+ (окислитель)
AgNO3 +HCl = AgCl ↓ + HNO3 (3)
Ca(OH)2 + H2SO4 = CaSO4 ↓ + H2O (4)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
N2 + 3H2 = 2NH3 +46,2 кДж (1)
2Mg + O2 = 2MgO + 602, 5 кДж (2)
N2 + O2 = 2NO – 90,4 кДж (3)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
А + В ↔ АВ
Например:
СН3СООН + С2Н5ОН↔ Н3СООС2Н5+ Н2О
Примерами необратимых реакций может служить следующие реакции:
2КСlО3 → 2КСl + ЗО2↑
С6Н12О6 + 6О2 → 6СО2↑+ 6Н2О
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание некоторых реакций вообще невозможно без присутствия катализатора:
2H2O2 = 2H2O + O2 ↑ (катализатор MnO2)
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF2 + H2O, где Ме – металл.
Примеры решения задач
ru.solverbook.com
Классификация химических реакций — схема, таблица — Схемо.РФ
- Войти
- Регистрация
- Схемы
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
- Социология
- Физика
- Философия
- Химия
- Экономика
- Прочее
- Книги
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
- Социология
- Физика
- Философия
xn--e1aogju.xn--p1ai
Классификация химических реакций — HimHelp.ru
Химические свойства веществ выявляются в разнообразных химических реакциях.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями. Часто встречается и такое определение: химической реакцией называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются посредством химических уравнений и схем, содержащих формулы исходных веществ и продуктов реакции. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части — веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т.д.), это указывается соответствующим символом, как правило, над (или «под») знаком равенства.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки.
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом — выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом — поглощением энергии в форме теплоты (Q<0, ∆H >0):
N2 +О2 = 2NО — Q.
Такие реакции относят к термохимическим.
Рассмотрим более подробно каждый из типов реакций.
Классификация по числу и составу реагентов и конечных веществ
1. Реакции соединения
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са(НСО3)2,
так и относиться к числу окислительно-восстановительных:
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
| to | ||
| CuSO4 5H2O | = | CuSO4 + 5H2O |
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
| to | ||
| 4HNO3 | = | 2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.
Реакции разложения в органической химии носят название крекинга:
С18H38 = С9H18 + С9H20,
или дегидрирования
C4H10 = C4H6 + 2H2.
3. Реакции замещения
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,
Иногда эти реакции рассматривают как реакции обмена:
СН4 + Сl2 = СН3Сl + НСl.
4. Реакции обмена
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами — оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена — реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
5. Реакции переноса.
При реакциях переноса атом или группа атомов переходит от одной структурной единицы к другой:
АВ + ВС = А + В2С,
А2В + 2СВ2 = АСВ2 +АСВ3.
Например:
2AgCl + SnCl2 = 2Ag + SnCl4,
H2O + 2NO2 = HNO2 + HNO3.
Классификация реакций по фазовым признакам
В зависимости от агрегатного состояния реагирующих веществ различают следующие реакции:
1. Газовые реакции
2. Реакции в растворах
NaОН(р-р) + НСl(p-p) = NaСl(p-p) + Н2О(ж)
3. Реакции между твердыми веществами
| to | ||
| СаО(тв) +SiO2(тв) | = | СаSiO3(тв) |
Классификация реакций по числу фаз.
Под фазой понимают совокупность однородных частей системы с одинаковыми физическими и химическими свойствами и отделенных друг от друга поверхностью раздела.
Все многообразие реакций с этой точки зрения можно разделить на два класса:
1.Гомогенные (однофазные) реакции. К ним относят реакции, протекающие в газовой фазе, и целый ряд реакций, протекающих в растворах .
2.Гетерогенные (многофазные) реакции. К ним относят реакции, в которых реагенты и продукты реакции находятся в разных фазах. Например:
газожидкофазные реакции
CO2(г) + NaOH(p-p) = NaHCO3(p-p).
газотвердофазные реакции
СO2(г) + СаО(тв) = СаСO3(тв).
жидкотвердофазные реакции
Na2SO4(р-р) + ВаСl3(р-р) = ВаSО4(тв)↓ + 2NaСl(p-p).
жидкогазотвердофазные реакции
Са(НСО3)2(р-р) + Н2SО4(р-р) = СО2(r)↑ +Н2О(ж) + СаSО4(тв)↓.
Классификация реакций по типу переносимых частиц
1. Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием — вещество, способное присоединять протон, например:
| CH3COOH | + H2O = | CH3COO— + | H3O+ |
| кислотаI | основаниеI | основаниеI | кислотаII |
| NH3 + | H2O = | NH4+ + | OH— |
| основаниеI | кислотаII | кислотаII | основаниеII |
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
3. Лиганднообменные реакции.
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2,
Fe + 5CO = [Fe(CO)5],
Al(OH)3 + NaOH = [NaAl(OH)4].
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
Обратимые и необратимые химические реакции
Обратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом:
А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например:
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании:
2КСlО3 → 2КСl + ЗО2↑,
или окисление глюкозы кислородом воздуха:
С6Н12О6 + 6О2 → 6СО2 + 6Н2О.
www.himhelp.ru
Классификация химических реакций по числу и составу исходных и образующихся веществ
- Войти
- Регистрация
- Схемы
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
- Социология
- Физика
- Философия
- Химия
- Экономика
- Прочее
- Книги
- Биология
- География
- История
- Математика и алгебра
- Медицина
- Обществознание
- Педагогика
- Политология
- Право
- Психология
- Русский язык
- Социология
- Физика
xn--e1aogju.xn--p1ai
Классификация химических реакций в неорганической и органической химии » HimEge.ru
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.


По изменению степени окисления элементов
Первый признак классификации — по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
б) без изменения степени окисления
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.

По числу и составу реагентов и продуктов
Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из нескольких более простых, например:
4Li + O2 = 2Li2O
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
CaCO3 = CaO + CO2
Реакции разложения можно рассматривать как процессы, обратные соединению.
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Fe + 2HCl = FeCl2 + H2
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
— обмена (в том числе и нейтрализации).
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
AgNO3 + KBr = AgBr + KNO3

По возможности протекать в обратном направлении
По возможности протекать в обратном направлении – обратимые и необратимые.
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr

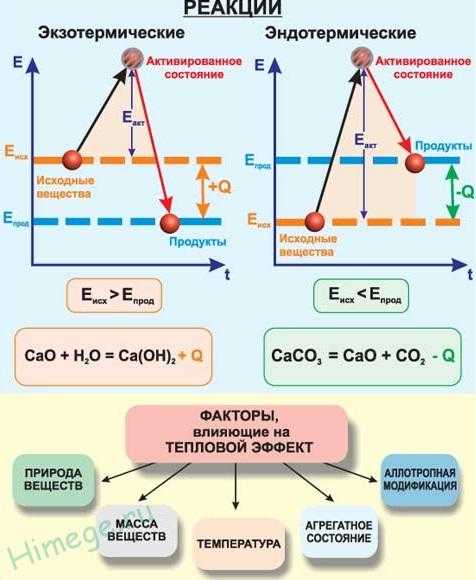
По тепловому эффекту
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
По фазе
Гомогенными называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатора
Катализатор – вещество ускоряющее химическую реакцию.
Каталитические реакции протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции идут в отсутствие катализатора.
По типу разрыва связей
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
- гомолитические (равный разрыв, каждый атом по 1 электрону получает)
- гетеролитический (неравный разрыв – одному достается пара электронов)
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
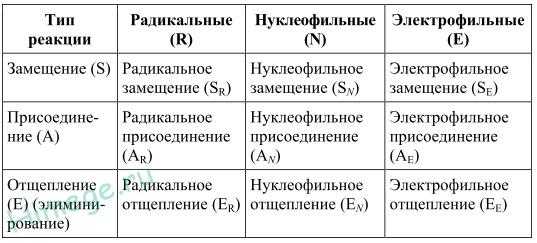
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Классификация органических реакций
Классификация органических реакций приведена в таблице:
Таблицы по теме «Типы химических реакций»

himege.ru
Классификация химических реакций
Было изучено много химических реакций. У них есть общие признаки, но и отличительные, так как каждая реакция непохожа на другую.
По числу и составу исходных веществ и продуктов реакции делятся на реакции соединения, разложения, замещения и обмена.
К реакциям соединения относятся реакции, в результате которых из двух или нескольких простых или сложных веществ образуется одно сложное. Например, в реакциях металла или неметалла с кислородом образуются оксиды. В реакции серы с кислородом, образуется оксид серы (II), в реакции фосфора с кислородом – оксид фосфора (V), а в реакции магния с кислородом – оксид магния. Все эти реакции сопровождаются выделением света и тепла. Поэтому их ещё называют реакциями горения.
S + O2 = SO2
4P + 5O2 = 2P2O5
2Mg + O2 = 2MgO
Реакции соединения
Реакцией соединения можно получить и соли, например, когда металл реагирует с неметаллом, так в реакции горения железа в хлоре, образуется соль – хлорид железа (III).
2Fe + 3Cl2 = 2FeCl3
В реакцию соединения могут вступать и два сложных вещества с образованием одного сложного. Например, в реакции сложных веществ оксида кальция с водой образуется сложное вещество гидроксид кальция.
СаО + Н2О = Са(ОН)2
К реакциям разложения относятся реакции, в результате которых из одного сложного вещества образуется два или более новых веществ. Например, реакция разложения оксида ртути (II). В результате этой реакции образуется ртуть и кислород. Или, например, при разложении воды в электролизёре образуется кислород и водород.
2HgO = 2Hg + O2
2Н2О = 2Н2 + О2
Реакции разложения
К реакциям замещения относятся реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе, при этом образуется новое простое и новое сложное вещество. К реакциям замещения относятся реакции взаимодействия металлов с кислотами и металлов с солями. Так, в реакции цинка с серной кислотой образуется новое сложное вещество – сульфат цинка и выделяется газ водород (новое простое вещество).
Zn + H2SO4 = ZnSO4 + H2↑
Или, как в реакции железа с раствором сульфата меди (II) атомы железа замещают атомы меди в сложном веществе и образуется новое сложное вещество – сульфат железа (II) и новое простое – медь.
Fe + CuSO4 = FeSO4 + Cu↓
Реакции замещения
В реакциях обмена обязательно участвуют два сложных вещества, которые обмениваются своими составными частями. Например, реакция между гидроксидом натрия и соляной кислотой. В реакцию ступают два сложных вещества и образуется два новых сложных вещества – хлорид натрия и вода. К тому же, эта реакция ещё является и реакцией нейтрализации, т.к. в реакцию вступает щёлочь и кислота, при этом образуется соль и вода.
NaOH + HCl = NaCl + H2O
К реакциям обмена относятся и реакции между основанием и солью, так если в реакцию вступает хлорид железа (III) и гидроксид калия, то в результате реакции образуется соль – хлорид калия и выпадает осадок – гидроксид железа (III).
FeCl3 + 3KOH = 3KCl + Fe(OH)3↓
Соли могут также вступать друг с другом в реакцию, это также будут реакции обмена, в результате которых образуются две новые соли. Так, в реакции сульфата натрия с хлоридом бария образуется две новые соли – хлорид натрия и сульфат бария.
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
Реакции обмена
По признаку выделения теплоты реакции делятся на экзотермические и эндотермические. Если реакции протекают с выделением теплоты, то такие реакции называются экзотермическими (в переводе с греческого экзо обозначает «наружу»), если реакции протекает с поглощением теплоты, то их называют эндотермическими (эндо означат «внутрь»).
Экзотермические и эндотермические реакции
Количество теплоты, которое выделяется или поглощается в результате реакции, называют тепловым эффектом реакции. Тепловой эффект реакции обозначают латинской буквой Q («ку») и выражают в килоджоулях (кДж). Для экзотермических реакций Q > 0, для эндотермических реакций, наоборот, Q < 0. К экзотермическим реакциям относятся реакции горения серы, магния, фосфора, а реакция разложения ртути является эндотермической.
S + O2 = SO2 + Q
4P + 5O2 = 2P2O5 + Q
2Mg + O2 = 2MgO + Q
2HgO = 2Hg + O2 – Q
По признаку обратимости реакции делятся на обратимые и необратимые. Обратимые реакции всегда протекают одновременно в двух противоположных направлениях, как реакция получения аммиака их двух простых веществ – азота и водорода. В этих реакциях вместо знака равенство ставится знак обратимости.
N2 + 3H2 ↔ 2NH3
Необратимые реакции идут до конца, т.е. в результате этих реакций образуется газ, осадок или слабый электролит. Например, в реакции соляной кислоты и карбоната калия образуется углекислый газ и вода, т.е. реакция прошла до конца.
2HCl + K2CO3 = 2KCl + CO2↑ + H2O
Обратимые и необратимые реакции
По признаку участия катализатора реакции делятся на каталитические и некаталитические. Каталитические реакции – это реакции, протекающие с участием катализатора. Например, реакция получения оксида серы (VI) из оксида серы (IV) является каталитической, т.к. необходимым условием её протекания является наличие катализатора оксида ванадия (V). Катализатор всегда указывается над знаком равенства или обратимости.
V2O5
2SO2 + O2 ↔ 2SO3
По признаку изменения степени окисления реакции делятся на реакции, протекающие без изменения степени окисления и реакции, протекающие с изменением степени окисления, или окислительно-восстановительные. Так, реакция разложения гидроксида меди (II) на оксид меди (II) и воду протекает без изменения степени окисления, а реакция взаимодействия нитрата серебра (I) с медью является окислительно-восстановительной, т.к. медь изменяет степень окисления с 0 до +2, а серебро понижает свою степень окисления с +1 до 0.
videouroki.net

